Чем отличаются сильные и слабые основания
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
13 лучших примеров слабых оснований и их использование
Конъюгированная кислота слабого основания всегда является слабой кислотой, а сопряженное основание слабой кислоты всегда является слабым основанием.
Как определить слабое основание?
Кроме того, слабые основания имеют более низкую константу диссоциации основания (K b). Она аналогична константе диссоциации кислоты и представляет собой относительную силу основания. По мере того как основания становятся слабее, их значения Kb становятся меньше.
В этой статье мы использовали значения pK b для обозначения основности соединения. Это просто отрицательный десятичный логарифм Kb раствора.
Теперь, когда у вас есть общее представление о значениях pH и K b, давайте рассмотрим некоторые из наиболее распространенных примеров слабого основания и их важность.
13. Гидроксиламин
Формула: NH2OH
Основность (pK b): 8.05
Гидроксиламин также является промежуточным продуктом в процессе биологической нитрификации микробами, например, бактериями. В полупроводниковой промышленности он часто используется для удаления фоторезистов после литографии.
Поскольку гидроксиламин представляет опасность возгорания при воздействии сильного тепла, его потенциальное использование должно быть тщательно оценено. Природа взрывоопасности до сих пор недостаточно хорошо изучена.
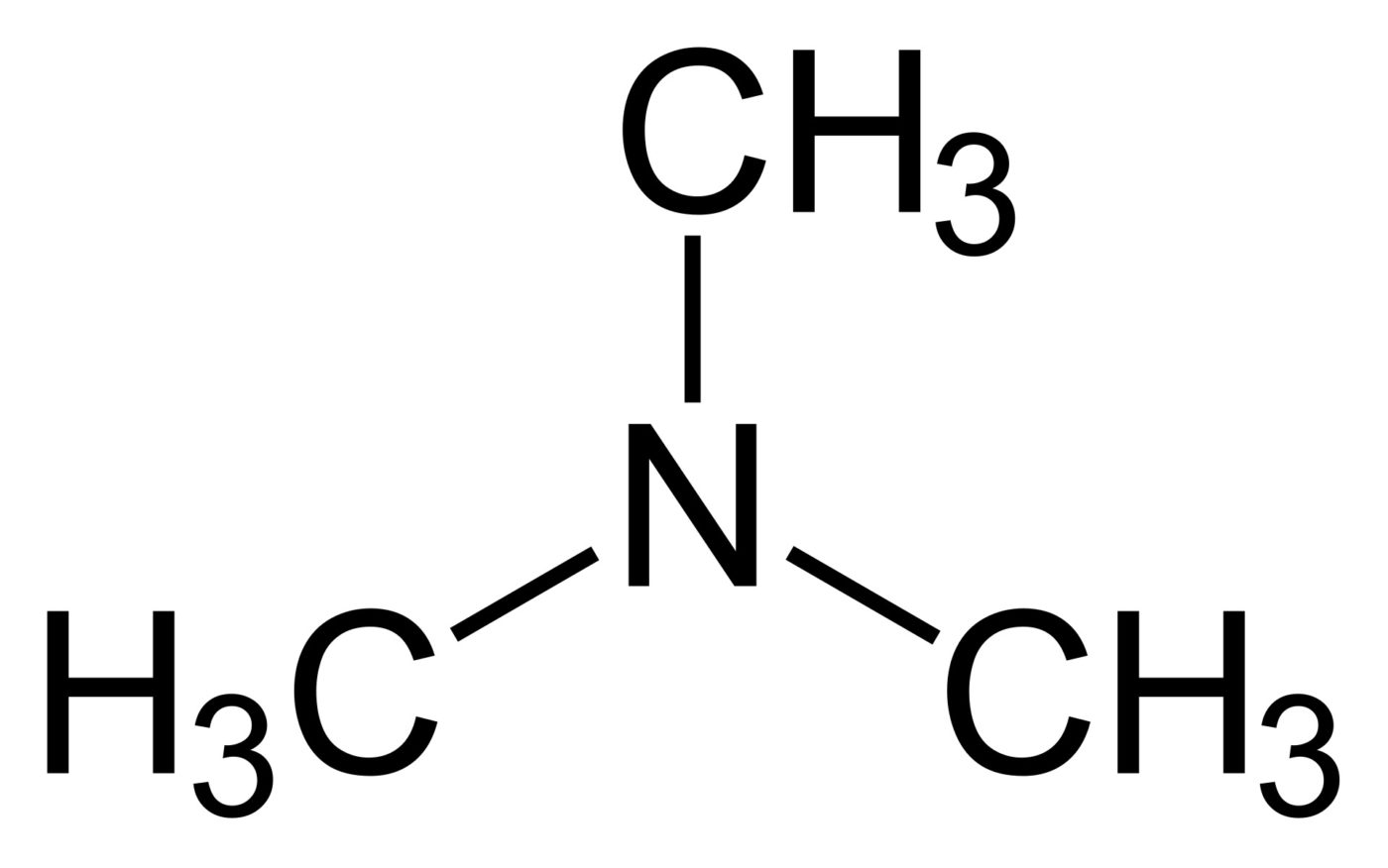
12. Триметиламин
Формула: N(CH3)3
Основность (pK b): 4,20
Триметиламин является газом при комнатной температуре, но хорошо растворяется в воде. Обычно он продается в виде 40% раствора в воде. При более низких концентрациях пахнет гниющей рыбой. При более высоких концентрациях пахнет аммиаком. Кратковременное вдыхание высоких концентраций или длительное вдыхание низких концентраций может вызвать серьезные проблемы со здоровьем.
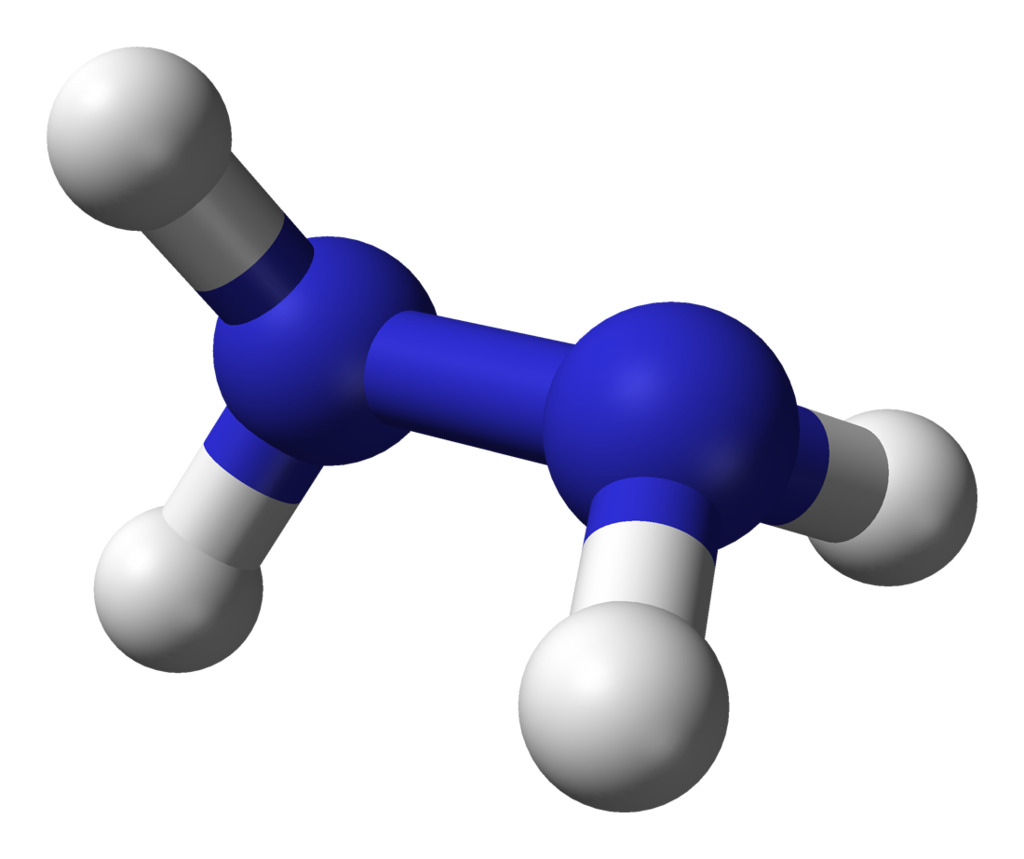
11. Гидразин
Формула: N2H4
Основность (pK b): 8.1
Гидразин представляет собой соединение, содержащее два атома азота с одинарной связью и четыре периферийных атома водорода. Его водный раствор (концентрация более 37%) бесцветен, вызывает коррозию и токсичен при проглатывании и абсорбции через кожу.
Когда гидразин смешивается с водой, он образует более плотный моногидрат (1,032 г/см3), чем безводное вещество.
Как и аммиак, гидразин обладает основными (щелочными) химическими свойствами. Это высокореакционная основа и восстановитель, используемый в широком спектре медицинских и промышленных применений.
Ежегодно во всем мире производится около 100,00 метрических тонн гидразина. В основном он используется как пенообразователь для производства пенопласта.
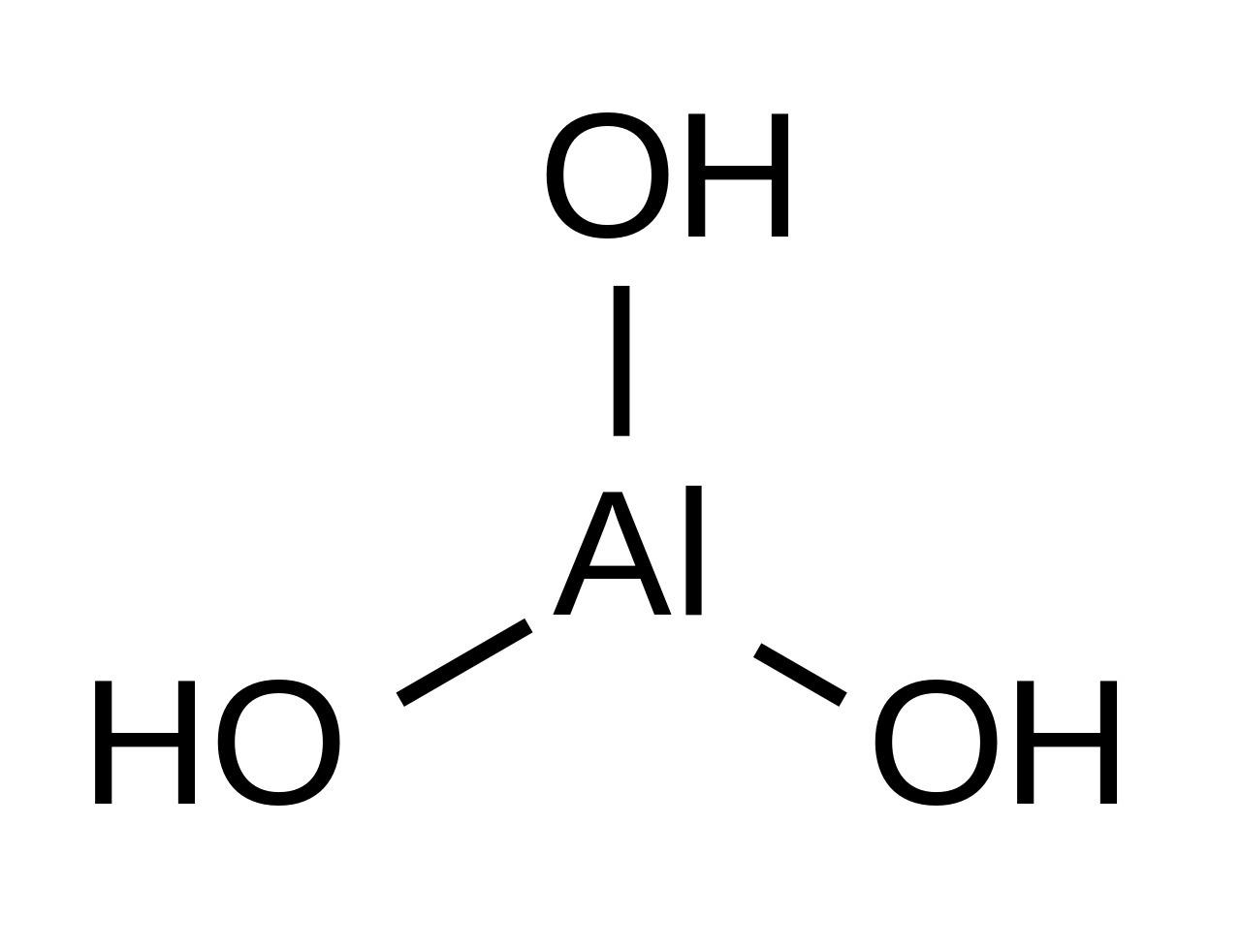
10. Гидроксид алюминия
Формула: Al(OH)3
Основность (pK b): 7,5
В чистом виде гидроксид алюминия представляет собой белые гранулы или порошок плотностью около 2,4 г/мл. Хотя он не растворяется в воде, он быстро растворяется в сильных основаниях и кислотах.
Гидроксид алюминия обладает двумя уникальными свойствами:
Гидроксид алюминия обычно используется в качестве дополнительного ингредиента в антацидных препаратах. Доказано, что он эффективен при лечении изжоги, кислотного расстройства желудка и расстройства желудка. Он также используется в обрабатывающей промышленности и в качестве огнезащитного наполнителя для полимеров.
9. Гидроксид цинка
Формула: Zn(OH)2
Основность (pK b): 8.15
Гидроксид цинка выглядит как белое твердое вещество и имеет плотность 3,05 г / см3. Он встречается в природе в трех редких минералах, а именно ашоверите, сладките и вульфингите. Его также синтезируют в лаборатории путем смешивания раствора гидроксида натрия с раствором любой соли цинка.
Подобно гидроксидам других металлов, таких как хром, олово, бериллий, свинец и алюминий, гидроксид цинка является амфотерным. Это означает, что он может реагировать и как кислота, и как основание. Он легко растворяется в растворе сильного основания (например, гидроксида натрия), а также в растворе сильной кислоты (например, соляной кислоты).
Гидроксид цинка в основном используется в качестве абсорбирующего агента в хирургических повязках. Он также используется в качестве промежуточного продукта при производстве пестицидов и пигментов.
8. Гидрокарбонат натрия
Формула: NaHCO3
Основность (pKb): 3.67
Соединение гидролизуется в воде с образованием катиона натрия и гидроксид-иона. Присутствие гидроксид-ионов делает соединение слегка основным.
Он в основном используется в выпечке как разрыхлитель. При смешивании с водой он действует как антацид, который довольно эффективен при лечении кислотного расстройства желудка и изжоги.
Бикарбонат натрия быстро реагирует с кислотами, образуя углекислый газ. Вот почему он широко используется для нейтрализации разливов кислоты и нежелательных кислотных растворов в химических лабораториях.
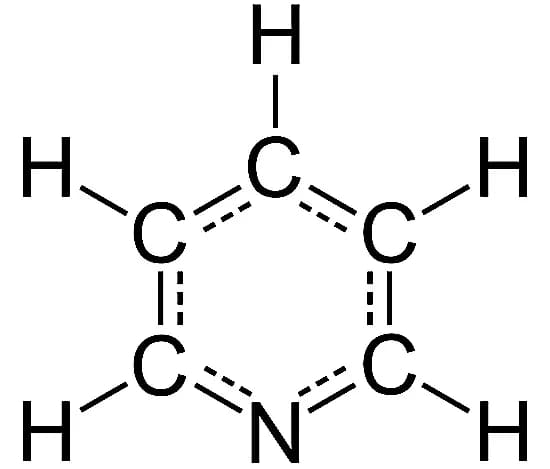
7. Пиридин
Формула: C5H5N
Основность (pKb): 8,75
Структура пиридина очень похожа на структуру бензола, но одна метиновая группа заменена атомом азота. Наличие азота (и его одинокой пары) в бензольном кольце делает пиридин уникальным соединением в химии.
Пиридин является значительно более слабым основанием, чем алкиламины и типичные алифатические третичные амины. Это водорастворимая и легковоспламеняющаяся жидкость с неприятным «рыбоподобным» запахом. Хотя чистый пиридин не имеет цвета, нечистые или старые образцы могут казаться желтыми.
Это основание в основном используется для растворения других соединений и изготовления различных продуктов, включая красители, краски, инсектициды, лекарства, пищевые ароматизаторы, витамины, клеи и резиновые изделия. Оно также содержится во многих природных материалах в окружающей среде.
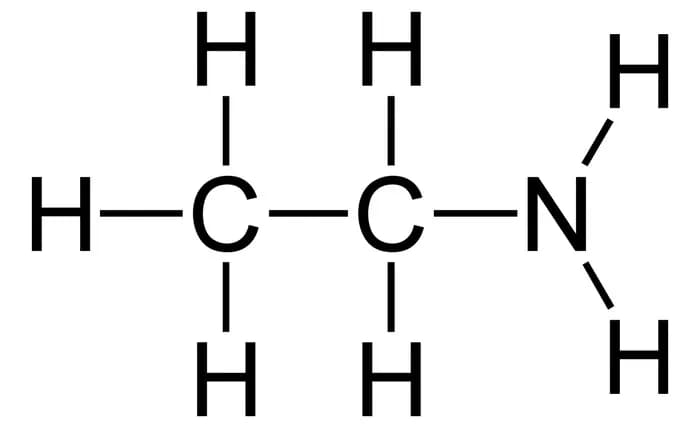
6. Этиламин
Формула: C2H5NH2
Основность (pKb): 3,35
Равновесие устанавливается между неионизированными молекулами этиламина и двумя ионами, которые образуются в результате его ионизации.
Как и другие первичные амины, этиламин является отличным растворителем для металлического лития. Эти растворы используются для восстановления ненасыщенных органических веществ, таких как алкины и нафталины.
Кроме того, этиламин образует токсичные оксиды азота при сгорании. Обычно его хранят в закрытом контейнере; однако длительное воздействие высоких температур может привести к его резкому разрыву.
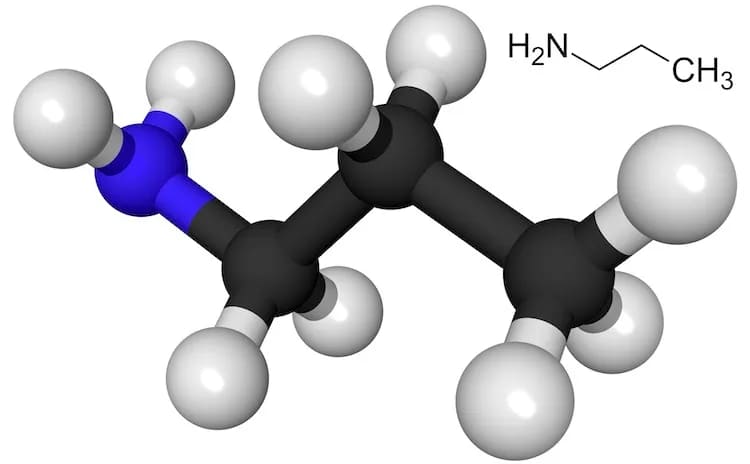
5. Пропиламин
Формула: C3H7NH2
Основность (pKb): 3,45
Пропиламин относится к классу органических соединений, называемых моноалкиламинами. Эти соединения содержат первичную алифатическую аминную группу.
Пропиламин растворим в воде и имеет меньшую плотность, чем вода. Это бесцветная летучая жидкость, а его пары тяжелее воздуха. При сгорании он образует токсичные оксиды азота.
Пропиламин обычно содержится в меньшей концентрации в нескольких различных продуктах питания, таких как зеленый болгарский перец, оранжевый болгарский перец, и в наибольшей концентрации в красном болгарском перце и желтом болгарском перце. Исследователи также обнаружили его в диком сельдерее и обычном винограде.
В лаборатории гидрохлорид пропиламина получают путем смешивания хлорида аммония с 1-пропанолом при высоком давлении и температуре с использованием катализатора кислоты Льюиса, например, хлорида железа.
Пропиламин в основном используется для синтеза и анализа других химических веществ.
4. Гидроксид аммония
Формула: NH4OH
Основность (pKb): 4,75
Хотя гидроксид аммония является соединением природного происхождения, он также производится человеком по ряду причин. Он изготавливается путем растворения аммиака в воде. Полученная жидкость бесцветна и имеет резкий запах.
Раствор содержит значительное количество воды и аммиака и меньшее количество иона аммония и гидроксид-иона. Поскольку гидроксид аммония не полностью диссоциирован на ионы, он является слабым основанием. Его pH колеблется между 7 и 10.
У этого соединения есть несколько применений. Например, в продуктах питания гидроксид аммония используется в концентрации 0,7%, тогда как бытовые чистящие средства производятся с концентрацией 5-10%. Он также используется в обычном качественном неорганическом анализе в качестве комплексообразователя и основания.
3. Метиламин
Формула: CH3NH2
Основность (pKb): 3,34
Как видно из формулы, основное различие между аммиаком и метиламином заключается в наличии у последнего группы CH3. Поскольку алкильная группа отталкивает электроны от себя, на атоме азота накапливается небольшой отрицательный заряд, что делает его одинокую пару еще более привлекательной для ионов водорода.
А поскольку аммиак не имеет электронодонорной группы, он является более слабым основанием, чем метиламин (в котором азот имеет более отрицательный заряд, поэтому он охотнее принимает H+).
Как и аммиак, метиламин представляет собой бесцветный газ или жидкость с резким запахом. Он может легко загореться. При длительном воздействии высоких температур емкости с метиламином могут разорваться. Поэтому обращаться с ним нужно осторожно.
Метиламин продается в основном в виде раствора в тетрагидрофуране, этаноле, метаноле или в виде безводного газа в контейнерах под давлением. Он широко используется для производства пестицидов, поверхностно-активных веществ, фармацевтических препаратов, растворителей краски и химических веществ для резины.
2. Анилин
Формула: C6H5NH2
Основность (pKb): 9,13
Более конкретно, одинокая пара над атомом азота в группе NH2 находится в сопряжении с электроном Pi бензольного кольца. Поэтому анилин не может легко потерять электронную пару, что делает его слабым основанием.
Он хорошо растворим в спирте и эфире и слабо растворим в воде. При реакции с сильными кислотами он образует ионы анилиния.
Анилин токсичен в природе. Он быстро всасывается в кожу, легкие и желудочно-кишечный тракт подопытных животных. Однако он широко используется для синтеза химических веществ, особенно сельскохозяйственных, фотохимикатов и красителей.
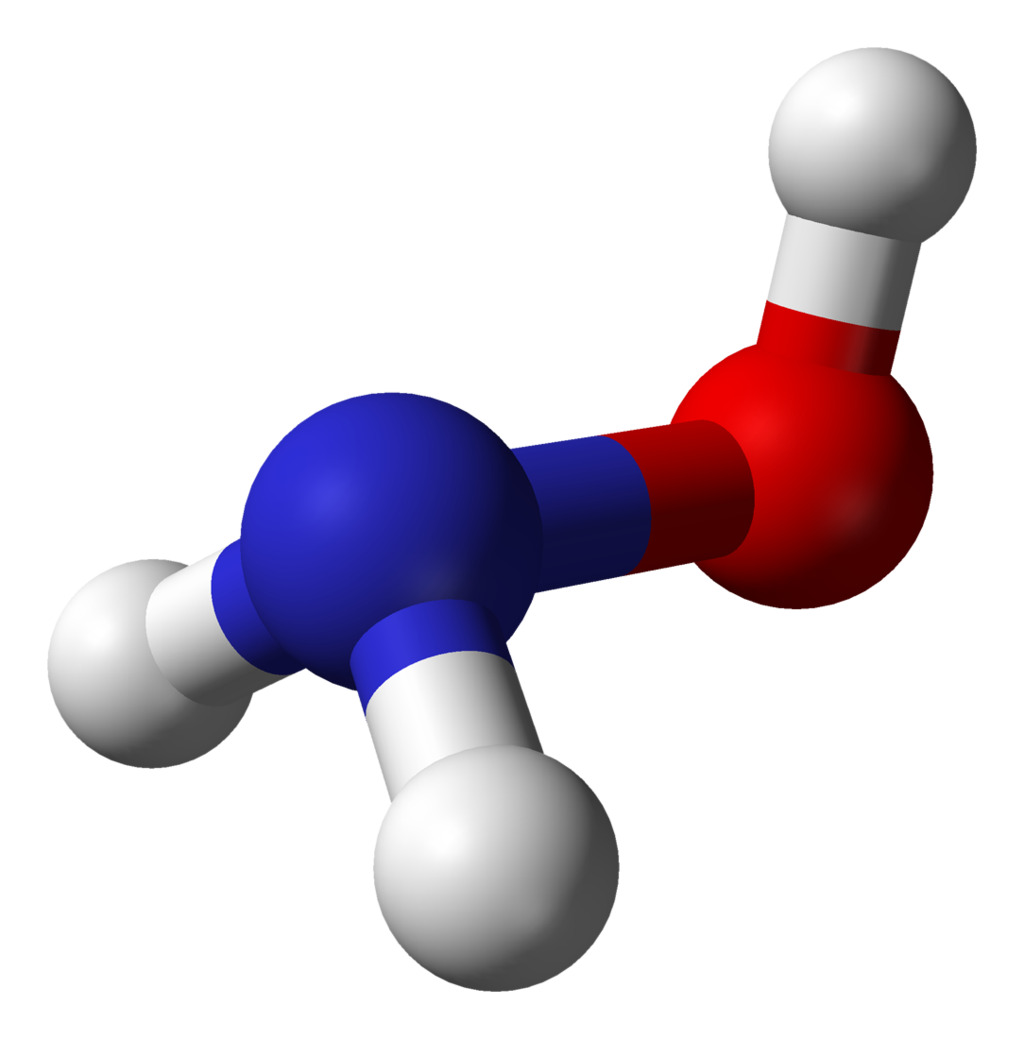
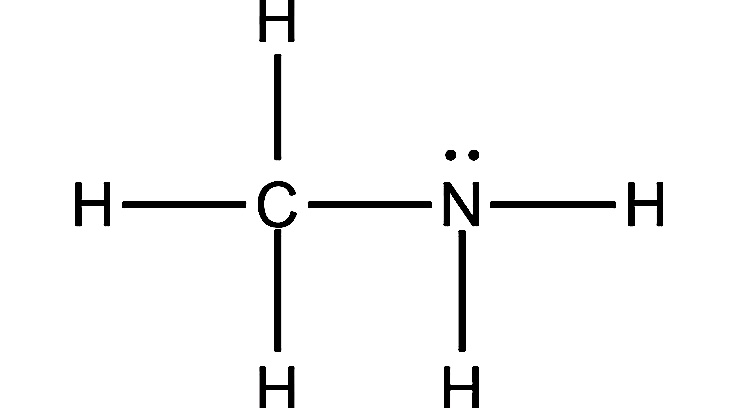
1. Аммиак
Формула: NH3
Основность (pKb): 4,75
Аммиак обладает большой способностью образовывать водородные связи. Когда он растворяется в воде, он получает ионы водорода из воды, образуя ионы аммония и гидроксида.
Эта реакция протекает в обоих направлениях, что означает ее обратимость. В любой момент реакции почти 99% вещества все еще остается в виде молекул аммиака, и только 1% действительно производит гидроксид-ионы. Поскольку лишь небольшая часть аммиака превращается в гидроксид-ионы в растворе, он является слабым основанием.
Урок 16. Кислоты и основания
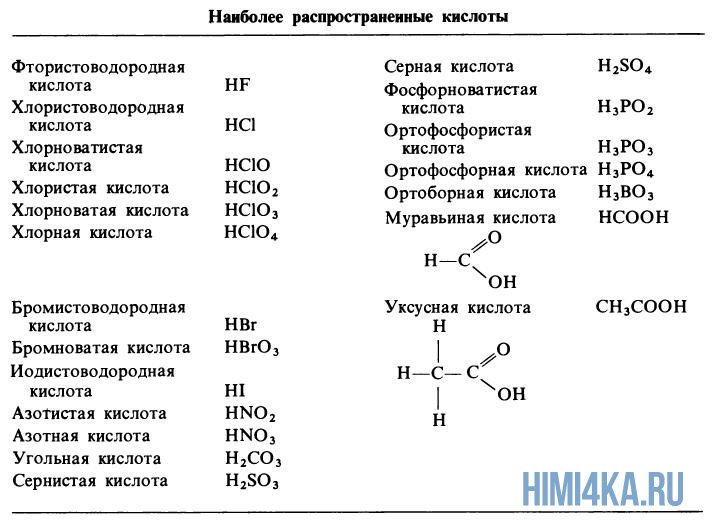
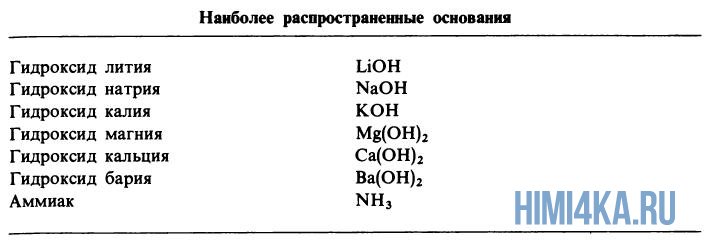
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».
Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H + ].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH — ]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H + ].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
Органические кислоты, такие как уксусная и муравьиная кислота, дают H + из своих карбоксигрупп –COOH.
Диссоциация оснований
Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH — :
Хотя у аммиака отсутствуют OH — ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.