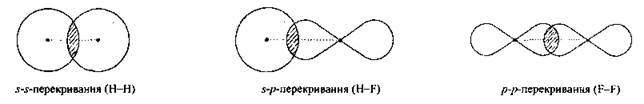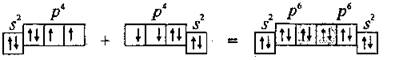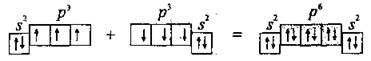Чем отличаются сигма и пи связи
Связь Сигма и Пи 2021
Что такое облигация Сигма?
Молекулярные связи
Молекулы образуются, когда атомы обмениваются или обмениваются электронами посредством химической связи. Существуют, по существу, три типа облигаций. Ионные связи, металлические связи и ковалентные связи. В ионных связях атомы будут просто обмениваться электроном так, чтобы один атом стал заряженно заряженным, а другой отрицательно заряжен, заставляя их притягиваться электромагнитной силой. В металлических связях электроны будут равномерно распределены по всей молекуле, создавая море свободных, делокализованных электронов, обволакивающих положительно заряженные ионы, притягиваемые к электронам.
В ковалентных связях электроны разделены, и способ, которым они делятся, осуществляется через облака вероятности электронов и орбитали, в которых они расположены, перекрываясь грубо симметричным образом.
Орбитальные и сигма-облигации
Сигма-связи и сигма-орбитали
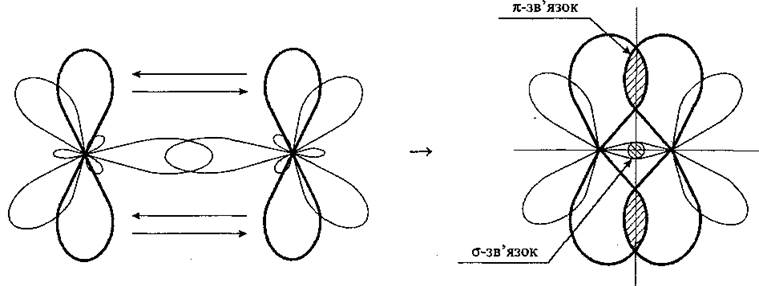
Электроны, составляющие сигма-связь, будут находиться внутри сигма-орбиталей и, следовательно, будут находиться где-то вдоль оси, соединяющей ядра связанных атомов. Однако сигма-связь может быть стабильной или неустойчивой в зависимости от того, находятся ли электроны в орбитальной сигма-связи или антисвязывающей орбите.
Сигма-связывающие орбитали будут находиться в промежутке между ядрами, тогда как антисвязывающие орбитали будут вдоль оси, соединяющей ядра, но с боков атомов, противоположных пространству между ними. Сигма-связь будет устойчивой, если большее количество электронов находится в связанных орбиталях и нестабильно, если больше в антисвязывающих орбиталях или если в обоих имеется одинаковое количество электронов.
Что такое связь Pi?
Связи Pi представляют собой связи между атомами внутри молекул, где электроны находятся выше и ниже оси, соединяющей ядра соединенных атомов, но не вдоль оси. Это второй тип связи, который образуется внутри молекулы после сигма-связи.
Pi и п орбитали
Причина, заключающаяся в том, что pi-связи образуются выше и ниже оси сцепления, но не вдоль нее, состоит в том, что они обычно образуются из перекрывающихся орбиталей, таких как п орбиталей на связанных атомах. Эти орбитали не имеют электронной плотности в ядре. В результате электроны, образующие связи pi, которые образуются из перекрывающихся п орбитали всегда будут кластеризоваться в области, которая непосредственно не примыкает к ядру. Связи Pi могут также образовываться между другими атомными орбиталями, такими как d орбиталей, которые имеют общие черты с п орбитали.
Pi-связи и pi-орбитали
когда п орбитали разных атомов перекрываются, они создают молекулярные pi-орбитали, которые позволяют образовывать pi-связи. Связь может снова быть стабильной или неустойчивой в зависимости от орбиты, в которой находится электрон. Связывание pi будет устойчивым, если больше электронов находится в орбиталях, связывающих пи. Он будет неустойчивым, если на анти-склеивающих орбиталях больше, или если одинаковое число в обоих.
Сходства между сигма-облигациями и pi-облигациями
Sigma-связи и pi-связи основаны на определенных молекулярных орбиталях, которые получены из перекрытия отдельных атомных орбиталей, например, s орбиталей в случае сигма-связей и п орбиталей в случае pi-связей. Они также могут быть стабильными или неустойчивыми в зависимости от того, находятся ли электроны в молекулярных орбиталях связи или антисвязывающих молекулярных орбиталях.
Различия между сигма-облигациями и пи-облигациями
Несмотря на их сходство, существуют важные различия.
Сигма-облигации против пи-облигаций
| Sigma bond | Связь Pi |
| Атомные орбитали перекрываются вдоль оси сцепления | Атомные орбитали перекрываются сверху и снизу оси сцепления |
| Первые связи образуют между атомами внутри молекул | Вторые связи образуют между атомами внутри молекул |
| Сформированные из перекрывающихся орбиталей, таких как s орбитали | Сформированные из перекрывающихся орбиталей, таких как п орбитали |
| Перекрывающиеся орбитали, перпендикулярные орбитам pi | Перекрывающиеся орбитали, перпендикулярные орбитам сигма |
Основная информация: Sigma and Pi Bonds
Сигма-связь представляет собой связь между атомами внутри молекулы, которая образуется s орбиталей, перекрывающихся вдоль оси, соединяющей соединенные ядра. Он формируется первым и его устойчивость зависит от того, как электроны распределены в сигма-склеивании и антисвязывающих орбиталях. Связи Pi представляют собой молекулярные связи, образующиеся часто от перекрытия п орбиталей от разных атомов. Электроны, составляющие pi-связи, будут распределены выше и ниже оси, соединяющей ядра связанных атомов, но не вдоль оси. Стабильность этих связей также зависит от связывания и антисвязывающих pi-орбиталей. Сигма-облигации будут первыми связями, образующимися в молекулах, тогда как pi-связи будут вторыми связями. Связи Pi также образуются из атомных орбиталей, ориентированных перпендикулярно тем, которые составляют сигма-связи.
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
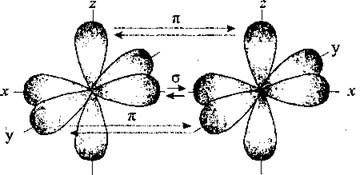
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Чем отличаются сигма и пи связи
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В результате образования трех общих электронных пар N≡N каждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2 s 2 2 p 6 (октет электронов).
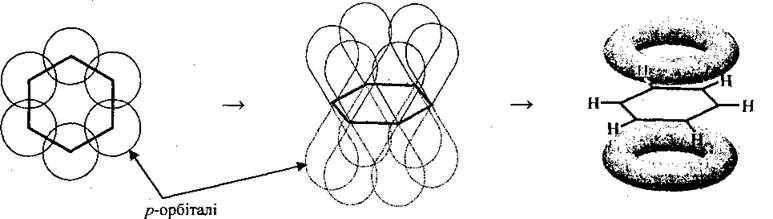
С помощью π-связи формируется молекула бензену и других аренов. Длина связи (ароматического, «полуторного», сказывается 
1 Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
В чём различие между σ-связью и π-связью?
Обсуждение вопроса:
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.
Концепцию сигма- и пи-связей разработал Лайнус Полинг в 30-х годах прошлого века.
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.
Концепцию Сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей, а Пи-связь образуется за счёт перекрывания p-орбиталей.
Однако сам Л.Полинг не был удовлетворён описанием сигма- и пи-связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958 г.), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи. Последняя теория чётко учитывала физический смысл ковалентной химической связи.
Сигма-связь более прочная, чем пи-связь. На пи-МО электроны более подвижны, поэтому поляризуемость пи-связи намного выше, чем сигма-связи.
Вокруг сигма-связи может происходить свободное внутримолекулярное вращение, в то время как вращение по двойной пи-связи не возможно без её разрыва.
Одиночные и кратные связи. Сигма- и пи- связи.
Одиночная связь – ковалентная связь, при которой между двумя атомами образуется только одна общая электронная пара.
Сигма-связь – ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей ядра атомов. Одинарные связи всегда являются сигма-связями.
Пи-связь – ковалентная связь, при образовании которой область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра. Образуются в тех случаях, когда между двумя атомами возникают две или три общие электронные пары. Число общих электронных пар между связанными атомами характеризует кратность связи.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной сигма-связи и одной пи-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной сигма-связи и двух пи-связей.
Двойные и тройные связи имеют общее название: кратные связи.
Основные типы структур неорганических соединений. Вещества с молекулярной и
немолекулярной структурой. Атомные, молекулярные, ионные и металлические
кристаллические решетки.
| Тип | молекулярная | ионная | атомная | металлическая |
| В узлах | молекулы | Положительно и отрицательно заряженные ионы (катионы и анионы) | Атомы | Атомы и положительно заряженные ионы металлов |
| Хар-тер связи | Силы межмолекулярного взаимодействия ( в т.ч. водородные связи) | Электростатические ионные связи | Ковалентные связи | Металлическая связь между ионами металлов и свободными электронами. |
| Прочн | Слабая | Прочная | Очень прочная | Разной прочности |
| Отл. Физ. Св-ва | Легкоплавкие, небольшой твердости, многие растворимы в воде. | Тугоплавкие, твердые, многие растворимы в воде, растворы и расплавы проводят электрический ток (проводники 2 рода) | Очень тугоплавкие, очень твердые, практически нерасворимы в воде | Разнообразны по свойствам: имеют блеск, обладают электропроводностью (проводники 1 рода) и теплопроводностью. |
| прим | Йод, лёд, «сухой лед». | NaCl, KOH, Ba(NO3)2 | Алмаз, кремний | Медь, калий, цинк. |
Молекулярные и немолекулярные вещества — один из признаков химических веществ относительно их строения.
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства. Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Существуют вещества с молекулярным и немолекулярным строением. Молекулярное строение имеют все газы, все жидкости. Твердые вещества могут иметь молекулярное и немолекулярное строение. Молекулярное строение имеют летущие твердые вещества (лед, иод, белый фосфор, органические вещества). В узлах кристаллической решетки легколетучих твердых веществ находятся молекулы. Большинство неорганических твердых веществ имеют немолекулярное строение, в узлах решеток находятся ионы (соли, основания) или атомы (металлы, алмаз, кремний). Вещества с молекулярным строением составляют более 95% от всех известных веществ, так как органические вещества имеют молекулярное строение, а органических веществ известно гораздо больше, чем неорганических.
Химические реакции. Классификация химических реакций. Основные задачи химической кинетики и химической термодинамики.
Химические реакции–это явления, при которых происходит превращение одних веществ в другие.
Признаки химических реакций:
Na2CO3+2HCl=2NaCl+H2O+CO2
ü Выпадение или растворение осадка
BaCl2+H2SO4=BaSO4 
ü Появление запаха.
ü Излучение света и тепла
Для протекания химических реакций необходимы условия: соприкосновения реагирующих веществ, нагревание, освещение.
Классификации химических реакций:
I. По числу и составу исходных реагентов:
a) Реакция соединения – реакция, при которой из нескольких веществ образуется одно вещество, более сложное, чем исходные: А+В=АВ
b) Реакция разложения – реакция, при которой из одного сложного вещества образуется несколько веществ. Конечными продуктами могут быть как простые, так и сложные вещества: АВ=А+В
c) Реакция замещения – реакция, при которых атомы адного элемента замещают атомы другого элемента в сложном веществе и при этом образуются два новых – простое и сложное: Х+АВ=АХ+В
d) Реакция обмена – реакция, при которой реагирующие вещества обмениваются своими составными частями, в результате чего из двух сложных веществ образуются два новых сложных вещества: АВ+СХ=АХ+СВ
II. По знаку теплового эффекта реакции делятся на:
a) эндотермические — реакции, протекающие с поглощением тепла
b) экзотермические— реакции, в результате которых тепло выделяется.
III. С учетом явления катализа:
a) каталитическими (протекающие с участием катализатора)
IV. По признаку обратимости реакции делят на:
a) обратимые – протекающие одновременно в пярмом и обратном направлении
b) необратимые – протекающие толкьов одном направлении
V. По признаку изменений степеней окисления элементов в молекулах реагирующих веществ:
a) ОВР – реакции с переносом электронов
b) Не ОВР – реакции без переноса электронов.
VI. По признаку однородности реакционной системы:
a) Гомогенные – протекающие в однородной системе
b) Гетерогенные – протекающие в неоднородной системе
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).