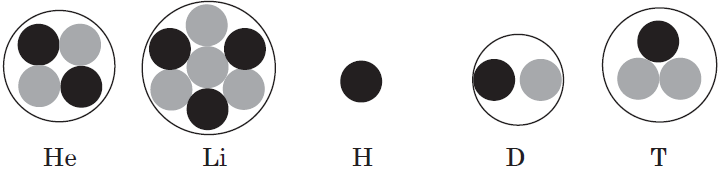
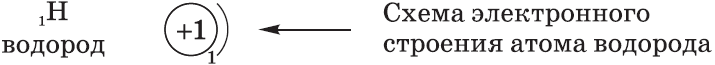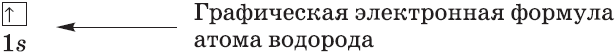Чем отличаются s электроны первого и второго энергетического уровня
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
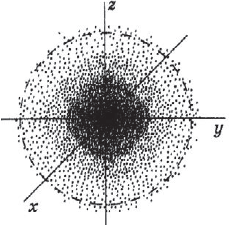
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.
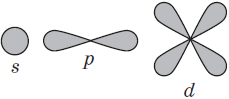
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.
Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:
Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
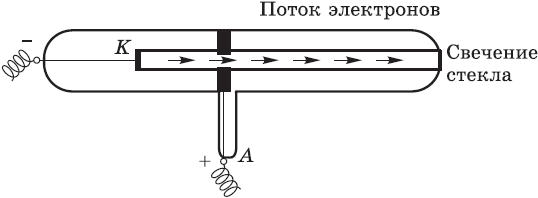
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
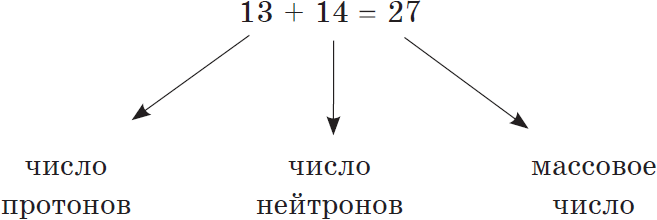
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 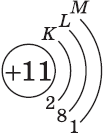 | $1s^2<2>s^2<2>p^6<3>s^1$ | 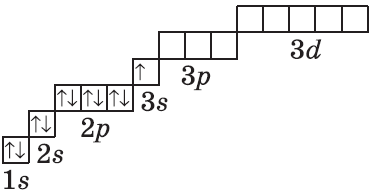 |
| $↙<13> | 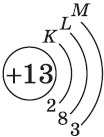 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 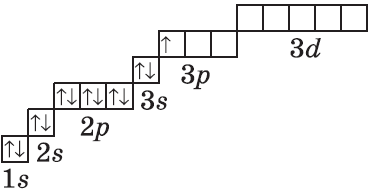 |
| $↙<18> | 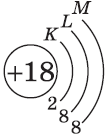 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 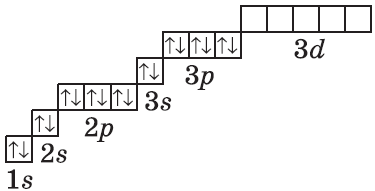 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
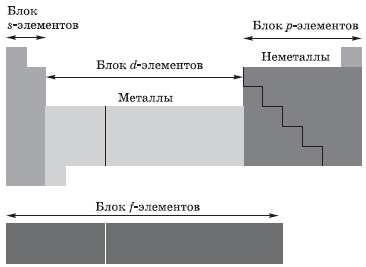
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
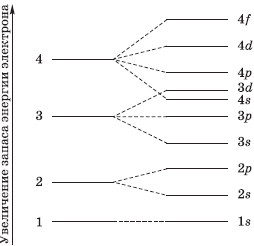
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
§ 13. Распределение электронов в электронной оболочке атомов
Вспомните:
• как определить состав атомов (§ 9);
• структуру электронной оболочки атома (§ 12).
Вместимость орбиталей
Электроны распределяются по орбиталям согласно определенным правилам. Первым рассмотрим правило, определяющее число электронов, которое может содержать одна орбиталь: на каждой орбитали максимально могут разместиться два электрона, которые имеют одинаковую энергию, но отличаются особым свойством — спином.
Спин электрона — это его внутреннее свойство, характеризующее отношение электрона к магнитному полю. Наглядно это свойство можно представить как возможность вращения электрона вокруг своей оси. Если два электрона вращаются вокруг собственной оси в одном направлении, то говорят, что их спины параллельны, а если в разных направлениях — то их спины антипараллельны (рис. 13.1).
Рис. 13.1. Электроны с параллельными спинами (а) и антипараллельными спинами (б) в магнитном поле
Таким образом, одна орбиталь может содержать только такие два электрона, спины которых являются антипараллельными. Это правило называют принципом запрета Паули:
На одной орбитали могут находиться не более двух электронов, причем их спины должны быть антипараллельными.
Графически орбиталь изображают в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз, показывающих направление спина электрона. Стрелки, направленные в противоположные стороны, обозначают электроны с противоположными спинами:
Вольфганг Эрнест Паули (1890-1958)
Австрийский и швейцарский физик, лауреат Нобелевской премии по физике 1945 г. Еще школьником прочитал труд Эйнштейна о теории относительности. В 20 лет написал статью об общей и специальной теории относительности, которую одобрил сам Эйнштейн. Работал ассистентом у Нильса Бора. Высказал предположение, что электронам присуще свойство, которое позднее назвали спином. Сформулировал закон, известный как принцип запрета Паули, который является фундаментальным для понимания строения атомов, атомных ядер, свойств металлов и других физических явлений. За его личностные качества и склонность к беспощадному критическому анализу коллеги называли его «совестью физики».
Принцип наименьшей энергии
Все химические свойства веществ определяются строением электронных оболочек атомов. Для того чтобы описать электронное строение атома, необходимо знать, как именно распределены электроны по его орбиталям. Давайте рассмотрим, как электроны заполняют электронные орбитали атомов.
Электроны занимают орбитали последовательно, начиная с первого энергетического уровня, в порядке возрастания энергии уровней.
Сначала «заселяется» первый энергетический уровень, затем — второй, третий и т. д. Этот принцип называют принципом наименьшей энергии.
Число энергетических уровней, заполняемых в атоме элемента, определяют по номеру периода Периодической системы, в котором расположен этот химический элемент.
Так, в атомах химических элементов первого периода заполняется только первый энергетический уровень, в атомах элементов второго периода — первые два энергетических уровня, третьего — три и т. д.
Например, Гидроген расположен в первом периоде под номером 1. Это означает, что в электронной оболочке его атомов имеется только один электрон, который находится на первом энергетическом уровне на единственной s-орбитали.
Графически строение электронной оболочки атомов Гидрогена записывают следующим образом:
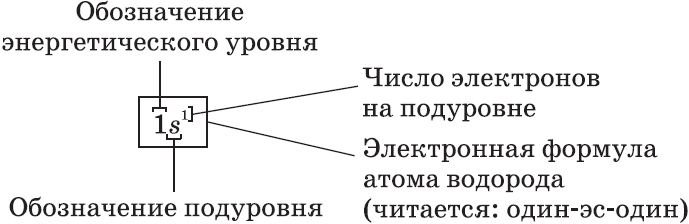
Кроме графического изображения строения электронной оболочки используют также ее запись в виде электронной формулы (электронной конфигурации), в которой приводят все занятые энергетические подуровни с указанием числа электронов на каждом из них.
Электронная формула Гидрогена выглядит так:
Гелий также расположен в первом периоде, следовательно, в электронной оболочке его атомов также заполняется первый энергетический уровень, который состоит из одной s-орбитали. Но на этой орбитали уже находится два электрона, так как порядковый номер Гелия — 2. Согласно принципу Паули, на одной орбитали эти электроны имеют антипараллельные спины:
У элементов второго периода начинает заполняться электронами второй энергетический уровень. На втором уровне уже два подуровня: s-подуровень (одна орбиталь) и p-подуровень (три орбитали):
Независимо от числа энергетических уровней электроны сначала заполняют самый низкий уровень, т. е. в данном случае первый, а затем уже второй. Например, рассмотрим строение электронной оболочки Лития, которая содержит три электрона (порядковый номер — 3). Поскольку первый уровень максимально вмещает два электрона, то на втором должен находиться только один электрон. Как вы считаете, какую орбиталь «выберет» третий электрон? Согласно принципу наименьшей энергии, каждый электрон располагается так, чтобы его энергия была наименьшей, следовательно, среди свободных орбиталей он выбирает орбиталь с наиболее низкой энергией.
Среди всех орбиталей s-орбитали обладают наименьшей энергией, поэтому единственный электрон второго энергетического уровня будет занимать s-орбиталь, а р-орбитали в данном случае останутся свободными:
Рассмотрим строение электронной оболочки Бериллия. Его четвертый электрон также должен выбрать ту же орбиталь, что и третий электрон Лития. До тех пор, пока не заполнится текущий подуровень, следующий заполняться не начинает. Так, в атоме Бериллия (порядковый номер — 4) полностью заполнен s-подуровень, образуя электронную пару, а p-подуровень снова остается свободным:
Только если s-орбиталь заполнена, электроны начинают располагаться на р-орбиталях. Так, в атоме Бора (порядковый номер — 5) на р-орбитали уже появляется один электрон:
Анализируя электронные формулы последних трех рассмотренных элементов, можно сделать вывод, что у других элементов второго периода также будут заполняться электронами орбитали первых двух энергетических уровней, а электронная оболочка каждого следующего элемента будет отличаться от электронной оболочки предыдущего только на один электрон.
Распределение электронов по орбиталям на энергетическом подуровне
Часто бывают случаи, когда на подуровнях, состоящих из нескольких орбиталей, размещается несколько электронов. Возникает вопрос: какие орбитали они занимают? Например, если на p-подуровне находится два электрона, то они могут занять или одну р-орбиталь, или две разные р-орбитали:
Для такого случая существует правило, согласно которому электрон занимает свободную орбиталь, а при отсутствии свободной — образует пару с другим электроном в полузаполненной орбитали. Так же, как и люди в троллейбусе сначала садятся на свободные места, а если свободных мест нет, то подсаживаются к другим пассажирам. Это правило называют правилом Хунда:
В пределах одного энергетического подуровня электроны распределяются по орбиталям таким образом, чтобы число неспаренных электронов было максимальным.
Фридрих Хунд (1896-1986)
Немецкий физик-теоретик. Родился в городе Карлсруэ. В возрасте 26 лет закончил Геттингенский университет. На протяжении следующих 40 лет работал почти во всех известных университетах Германии. Важнейшие труды Хунда посвящены квантовой механике, спектроскопии атомов и молекул, магнетизму, квантовой химии и истории физики. В 1927 г. сформулировал эмпирические правила, регулирующие порядок заполнения атомных орбиталей электронами (правила Хунда). Ввел представление о сигма- и пи-связях. Вместе с Маликеном и Леннард-Джонсом участвовал в разработке нового метода квантовой химии — метода молекулярных орбиталей.
Согласно этому правилу, в электронной оболочке атома Карбона есть два неспаренных электрона:
Только если на p-подуровне должно расположиться более трех электронов, то «лишний» электрон образует электронную пару с другим электроном, который уже размещен на этом подуровне:
Таким образом, в атомах Неона первый и второй энергетические подуровни полностью заполнены электронами:
Строение электронных оболочек атомов элементов третьего и четвертого периодов
Электронные оболочки атомов элементов других периодов заполняются по таким же правилам. Так, у атомов первого элемента третьего периода — Натрия — начинает заполняться третий энергетический уровень:
Обратите внимание, что в атоме Натрия на третьем энергетическом уровне появляется третий подуровень, который состоит из d-орбиталей. Но, как и р-орбитали, у Натрия орбитали d-подуровня еще не заполняются электронами и остаются свободными.
В атомах последнего элемента третьего периода — Аргона — полностью заняты все s- и р-орбитали:
В атомах элементов четвертого периода начинает заполняться электронами четвертый энергетический уровень, несмотря на то что третий уровень еще не заполнен. Это связано с тем, что энергия 4s-подуровня меньше, чем энергия 3d-подуровня, хотя в данном случае d-подуровень расположен на более близком к ядру электронном уровне. В атомах первого элемента четвертого периода — Калия — один электрон располагается на 4s-подуровне:
У следующего элемента — Кальция — 4s-подуровень заполнен полностью.
Итак, мы рассмотрели основные принципы, которые помогут понять строение электронных оболочек атомов первых двадцати химических элементов. Эти принципы являются универсальными и распространяются также и на другие элементы. Но для других элементов необходимо применять еще некоторые дополнительные правила, которые вы узнаете при более глубоком изучении химии.
Сравнить энергию разных электронных подуровней можно при помощи суммы двух чисел (n + I). Число n — это номер энергетического уровня, на котором находятся орбитали, а I — это число, соответствующее энергетическому подуровню (типу орбитали). Так, для s-орбиталей I = 0, для р-орбиталей I = 1, для d-орбиталей I = 2, для f-орбиталей I = 3. Согласно правилу Клечковского, подуровни заполняются электронами в порядке увеличения суммы (n + I). Если для двух подуровней эта сумма одинаковая, то заполняется тот подуровень, который находится на более близком к ядру электронном уровне. Так, для 4s-подуровня сумма (n + I) равна 4 + 0 = 4, а для 3d-подуровня сумма (n + I) равна 3 + 2 = 5. Следовательно, энергия 4s-подуровня меньше, чем Зd-подуровня, поэтому он заполняется раньше. Таким образом можно сравнивать энергии любых энергетических подуровней.
Интеллектуальные способности Паули значительно превосходили его «умение» работать руками. Коллеги обычно шутили по поводу таинственного «эффекта Паули», когда при появлении невысокого полноватого ученого в лаборатории случались поломки и аварии.
Выводы
1. На одной орбитали может находиться не более двух электронов, причем их спины должны быть антипараллельными. Орбитали заполняются электронами по принципу наименьшей энергии: сначала заполняется первый энергетический уровень, затем — второй и третий.
2. Если на одном энергетическом подуровне находится несколько электронов, то они распределяются таким образом, чтобы число неспаренных электронов было максимальным.
Контрольные вопросы
1. Сколько электронов может максимально находиться на одной электронной орбитали?
2. Сколько электронов максимально может находиться на s-подуровне? р-подуровне? d-подуровне?
3. Какой энергетический уровень заполняется раньше: первый или второй? Ответ поясните.
4. Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали?
5. Как распределяются электроны по орбиталям на р-подуровне?
6. Сколько электронов находится на внешнем энергетическом уровне атомов: а) Гелия; б) Лития; в) Бериллия; г) Бора; д) Карбона; е) Оксигена?
7. Сколько энергетических уровней заняты электронами в атомах: а) Лития, Натрия, Калия; б) Бериллия, Магния, Кальция; в) Флуора, Хлора, Брома?
Задания для усвоения материала
1. Составьте графическую электронную формулу Нитрогена, Флуора, Магния, Алюминия и Силиция. Определите число электронных пар и неспаренных электронов на внешнем энергетическом уровне.
2. По числу орбиталей, составляющих энергетические уровни, определите, какое максимальное число электронов может находиться на втором и третьем энергетических уровнях.
3. Назовите два химических элемента, в атомах которых полностью заполнены внешние энергетические уровни.
4. Сколько неспаренных электронов в электронной оболочке атома Оксигена? Атомы какого еще химического элемента второго периода содержат такое же число неспаренных электронов?
5. Изобразите строение электронных оболочек атомов Нитрогена и Фосфора. Что общего в строении электронных оболочек этих атомов и чем они отличаются?
7. Атом какого элемента второго периода содержит наибольшее число: а) электронов; б) неспаренных электронов; в) электронных пар?