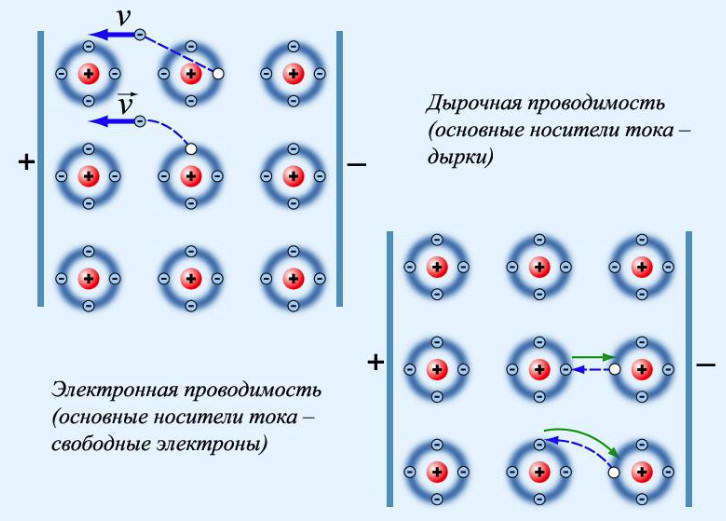
Чем отличаются проводники полупроводники и диэлектрики
Проводники, изоляторы и полупроводники
Электроны атомов, как правило, расположены на внешних или внутренних орбитах. Те электроны, что расположены на внутренних орбитах, относительно прочно связываются с ядром атома. Валентные электроны, т.е. те, которые находятся на внешних орбитах, могут отрываться от атома и находиться в «свободном» состоянии до тех пор, пока не присоединятся к новому атому. Атом, у которого отсутствует какое-либо количество электронов называется ионом с положительным зарядом. А вот атом, к которому присоединились электроны, называется ионом с отрицательным зарядом.
Процесс формирования ионов называется — ионизацией.
Количество «свободных» ионов или электронов, т.е. частиц, переносящих заряд, в единице объема вещества называют концентрацией носителей заряда.
Электрический ток — это упорядоченное движение положительно и отрицательно заряженных частиц.
Электропроводность — это способность вещества, под действием электрического поля, проводить через себя электрический ток.
Чем выше концентрация носителей заряда в веществе, тем больше его электропроводность. В зависимости от способности проводить электрический ток, вещества разделяют на 3 группы: проводники, полупроводники и диэлектрики.
Проводники электрического тока
Проводники — это вещества с высокой электропроводностью. Проводников бывает 2 типа: с электронной проводимостью и ионной проводимостью. К электронной проводимости относятся металлы и их сплавы. В металлах электрический ток создается перемещением электронов. Проходящий через такие проводники ток никак не сказывается на материале и не изменяет его химическую составляющую.
Высокий уровень электропроводности металлов обусловлен тем, что в них много «свободных» электронов, находящихся в состоянии беспорядочного движения и заполняющие объём проводника словно газ. При таком активном движении электроны сталкиваются с ионами неподвижной кристаллической решётки, состоящей из атомов вещества. В следствии чего электроны изменяют направление движения, скорость и свою кинетическую энергию.
Если в проводнике 1-го типа есть электрическое поле, то на заряды проводника действуют силы этого поля, упорядочивая их движение. Свободные электроны двигаются не в хаотическом порядке, а в одном направлении противоположно направлению поля (от минусовой клеммы к плюсовой). Данное упорядоченное движение свободных носителей заряда под действием электрического поля является — электрическим током (проводимости).
Проводники 2-го типа представляют собой растворы или расплавы солей, кислот, щелочей и т. п. в которых не завися от прохождения тока наблюдается электролитическая диссоциация.
Электролитическая диссоциация — это процесс распада нейтральных молекул на отрицательные и положительные ионы.
Положительные ионами выступают водород и ионы металлов. Отрицательные — гидроксильная группа и кислотные остатки.
Данные растворы или расплавы состоящие из ионов, частично или полностью, называются электролитами. Без воздействия внешнее электрическое поля, молекулы и ионы такого проводника будут находиться в состоянии хаотического движения.
При возникновении в таком проводнике электрического поля, движение ионов приобретает направленное упорядоченное движение, т. е. через проводник протекает ток (проводимости). Положительные ионы двигаются по направлению поля, а отрицательные против.
Полупроводники
Полупроводники — это вещества, электропроводность которых зависит от температуры, освещенности, электрических полей и примесей. К таким материалам относят: кремний, теллур, германий, селен, соединения металлов с серой и окислы металлов. Полупроводники отличаются еще и тем, что кроме электронной проводимости имеют и дырочную электропроводность. Дырочная электропроводность вызывается движением «дырок» из-за влияния электрического поля. «Дырки» — это свободные места в атомах, которые не заняты валентными электронами. Это подобно тому, что положительно заряженные частицы перемещаются так же, как и заряды, равные зарядам электронов. На сегодняшний день, использование полупроводников широко распространено в разных устройствах и приборах, например, в фоторезисторах и полупроводниковых диодах.
Электрические диэлектрики
Диэлектрики — это те вещества, в которых при нормальных условиях очень малое количество свободных электрически заряженных частниц. В следствии чего они обладают низкой электропроводностью. К диэлектрикам относятся газы, минеральные масла, лаки и твердые материалы (кроме металлов). Однако, если на диэлектрик будет действовать высокая температура или сильное электрическое поле, то начнется расщепление молекул на ионы, которые потеряют вследствие этого воздействия свои изолирующие свойства.
В чём отличие проводников от диэлектриков, их свойства и сфера применения
Проводники и диэлектрики — физические вещества, имеющие различную степень электропроводимости и по-разному реагирующие на воздействие электрического поля. Противоположные свойства материалов широко используются во всех сферах электротехники.
Что такое проводники и диэлектрики
Проводники — вещества, со свободными электрическими зарядами, способными направленно перемещаться под воздействием внешнего электрического поля. Такими особенностями обладают:
Главное свойство материалов : свободные заряды — электроны у твёрдых проводников и ионы у растворов и расплавов, перемещаясь по всему объёму проводника проводят электрический ток. Под воздействием приложенного к проводнику электрического напряжения создаётся ток проводимости. Удельное сопротивление и электропроводимость — основные показатели материала.
Свойства диэлектрических материалов противоположны проводникам электричества. Диэлектрики (изоляторы) — состоят из нейтральных атомов и молекул. Они не имеют способности к перемещению заряженных частиц под воздействием электрического поля. Диэлектрики в электрическом поле накапливают на поверхности нескомпенсированные заряды. Они образуют электрическое поле, направленное внутрь изолятора, происходит поляризация диэлектрика.
В результате поляризации, заряды на поверхности диэлектрика стремятся уменьшить электрическое поле. Это свойство электроизоляционных материалов называется диэлектрической проницаемостью диэлектрика.
Характеристики и физические свойства материалов
Параметры проводников определяют область их применения. Основные физические характеристики:
При охлаждении до критических температур удельное сопротивление проводника стремится к нулю. Это явление называется сверхпроводимостью.
Свойства, характеризующие проводник:
Особенность диэлектриков — противостоять воздействию электротока. Физические свойства электроизоляционных материалов:
Изоляционные материалы характеризуются по следующим параметрам:
Виды и классификация диэлектрических материалов
Изоляторы подразделяются на группы по нескольким критериям.
Классификация по агрегатному состоянию вещества:
Диэлектрики могут иметь природное или искусственное происхождение, иметь органическую или синтетическую природу.
К органическим природным изоляционным материалам относят растительные масла, целлюлоза, каучук. Они отличаются низкой термо и влагостойкостью, быстрым старением. Синтетические органические материалы — различные виды пластика.
К неорганическим диэлектрикам естественного происхождения относятся: слюда, асбест, мусковит, флогопит. Вещества устойчивы к химическому воздействию, выдерживают высокие температуры. Искусственные неорганические диэлектрические материалы — стекло, фарфор, керамика.
Почему диэлектрики не проводят электрический ток
Низкая проводимость обусловлена строением молекул диэлектрика. Частицы вещества тесно связаны друг с другом, не могут покинуть пределы атома и перемещаться по всему объёму материала. Под воздействием электрического поля частицы атома способны слегка расшатываться — поляризоваться.
В зависимости от механизма поляризации, диэлектрические материалы подразделяются на:
Диэлектрические свойства вещества непостоянны. Под воздействием высокой температуры или повышенной влажности электроны отрываются от ядра и приобретают свойства свободных электрических зарядов. Изоляционные качества диэлектрика в этом случае понижаются.
Надёжный диэлектрик — материал с малым током утечки, не превышающим критическую величину и не нарушающим работу системы.
Где применяются диэлектрики и проводники
Материалы применяются во всех сферах деятельности человека, где используется электрический ток: в промышленности, сельском хозяйстве, приборостроении, электрических сетях и бытовых электроприборах.
Выбор проводника обусловлен его техническими характеристиками. Наименьшим удельным сопротивлением обладают изделия из серебра, золота, платины. Использование их ограничено космическими и военными целями из-за высокой себестоимости. Медь и алюминий проводят ток несколько хуже, но сравнительная дешевизна привела к их повсеместному применению в качестве проводов и кабельной продукции.
Чистые металлы без примесей лучше проводят ток, но в ряде случаев требуется использовать проводники с высоким удельным сопротивлением — для производства реостатов, электрических печей, электронагревательных приборов. Для этих целей используются сплавы никеля, меди, марганца (манганин, константан). Электропроводность вольфрама и молибдена в 3 раза ниже, чем у меди, но их свойства широко используются в производстве электроламп и радиоприборов.
Твёрдые диэлектрики — материалы, обеспечивающие безопасность и бесперебойную работу токопроводящих элементов. Они используются в качестве электроизоляционного материала, не допуская утечки тока, изолируют проводники между собой, от корпуса прибора, от земли. Примером такого изделия являются диэлектрические перчатки, про которые написано в нашей статье.
Газообразные изоляционные материалы. Воздух — естественный изолятор, одновременно обеспечивающий отвод тепла. Азот применяется в местах, где недопустимы окислительные процессы. Водород применяется в мощных генераторах с высокой теплоёмкостью.
Слаженная работа проводников и диэлектриков обеспечивает безопасную и стабильную работу оборудования и сетей электроснабжения. Выбор конкретного элемента для поставленной задачи зависит от физических свойств и технических параметров вещества.
Какая проводка лучше — сравнение медной и алюминиевой электропроводки
Что такое конденсатор, виды конденсаторов и их применение
Какие существуют виды источников электрического тока?
Сила Лоренца и правило левой руки. Движение заряженных частиц в магнитном поле
Что такое нихромовая проволока, её свойства и область применения
Типы твердых тел: проводники, диэлектрики, полупроводники
В зависимости от ширины запрещенной зоны, характера заполнения электронами валентной зоны и величины электропроводности все твердые тела делятся на три класса:
Проводники
Проводники имеют частично заполненную валентную зону, которая перекрывается с зоной проводимости. Это приводит к способности валентных электронов свободно перемещаться в кристалле или направлено двигаться под действием внешнего поля. Отсутствие запрещенной зоны у металлов объясняется тем, что в их кристаллах s- и p-зоны перекрываются, а количество валентных электронов чрезвычайно мало по сравнению с числом свободных орбиталей в валентной зоне.
Спаренные электроны валентной зоны могут свободно переходить с нижних энергетических уровней на свободные уровни, в том числе и на свободные уровни зоны проводимости. Это обеспечивает высокую электропроводность металлов. Наибольшую электропроводность, с точки зрения зонной теории, имеют металлы, в которых количество электронов в валентной зоне равно числу электронных уровней в зоне проводимости. При этом условии все электроны могут переходить в квазисвободное состояние и участвовать в переносе электричества. К металлам с высокой электропроводностью принадлежат щелочные металлы (Li, Na, K), d-металлы I группы (Cu, Ag, Au), а также металлы II группы (Mg, Ca, Sr, Zn, Cd, Hg), в которых наблюдается перекрытие валентной зоны и зоны проводимости.
Диэлектрики
Диэлектрики имеют полностью заполненную валентную зону и большую ширину запрещенной зоны. Электроны валентной зоны, даже при сильном возбуждении атомов (нагрев, облучение и т.д.), не способны преодолеть запрещенную зону и перейти в зону проводимости.
Полупроводники
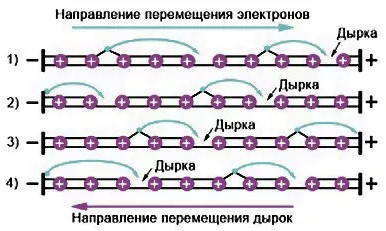
Возникновение электропроводности в полупроводниках объясняется следующим образом. В полупроводниковых кристаллах атомы соединены между собой ковалентными связями, образованными при перекрытии орбиталей валентных электронов — значит, валентная зона заполнена полностью. Но под влиянием внешних факторов (температура, электрическое поле или облучения) некоторые электроны получают энергию, достаточную для отрыва от атомных ядер, и переходят из валентной зоны в зону проводимости. За счет этих электронов может происходить перенос электрического тока, обеспечивает n-проводимость — так обозначают проводимость, обусловленную перемещением электронов (от лат. слова negative).
В валентной зоне электрон, который размещается рядом с дыркой, перемещается на это свободное место, оставляя после себя новую дырку, на которую передвигается следующий электрон и т.д. Такой дрейф электронов эквивалентен перемещению дыр в противоположном направлении. В электрическом поле дырки ведут себя как положительные заряды, но следует еще раз подчеркнуть, что перемещение дырки — это не движение носителя электрического заряда, а результат перескакивание электронов. Это явление получило название p-проводимости (от лат. слова positive).
Электронно-дырочный механизм электропроводности проявляется в собственных полупроводниках — таких, которые не содержат примесей.
Если необходимо усилить проводимость n-типа в полупроводник вводят примесные доноры, атомы которых способны отдавать электроны, увеличивая проводимость. Например, в кристалле кремния Si, атомы которого имеют четыре электрона на внешнем уровне один атом Si замещается атомом Р, на внешнем уровне которого содержится пять электронов; четыре из них образуют ковалентные связи с соседними атомами Si, а один электрон находится на свободной орбитали атома фосфора. При получении кристаллом Si небольшой энергии (≈ 4,4 кДж / моль) этот электрон легко отщепляется от примесного атома Р и переходит из валентной зоны через запрещенную зону в зону проводимости, то есть играет роль переносчика электрического тока. Но в целом кристалл Si сохраняет электронейтральность. По отношению к кремнию Si примесными донорами являются р-элементы V группы.
При необходимости усиления проводимости р-типа вводят примесные акцепторы, Атомы которых способны повышать дырочную проводимость. Например, в кристалле Si (с четырьмя электронами на внешнем уровне атома) один из атомов Si замещается атомом бора B, на внешнем энергетическом уровне которого находится только три электрона. При образовании атомом бора четырех ковалентных связей с атомами Si возникает дефицит одного электрона в каждом узле кристаллической решетки, содержащий атом B. При получении таким кристаллом небольшого количества энергии атом бора захватывает электрон из соседнего ковалентной связи, превращаясь в отрицательно заряженный ион, а на месте захваченного электрона возникает дырка. Если поместить кристалл в электрическое поле, то дырка становится как бы носителем заряда. Однако электрическая нейтральность кристалла не нарушается. По отношению к кремнию Si примесными акцепторами могут быть р-элементы III группы, а также Zn, Fe, Mn.
В зависимости от механизма проводимости полупроводники делят на таки типы:
Иногда полупроводники классифицируют по их химической природе, рассматривая неорганические и органические полупроводники. Однако чаще всего для полупроводников используют другую классификацию, согласно которой их делят на простые и сложные.
Простые полупроводники
Они бывают двух типов:
Сложные полупроводники
Полупроводники широко применяются для изготовления электронных приборов, используемых для преобразования и передачи информации (диоды, транзисторы, фото- и термоэлектронные приборы, микросхемы), также как лазерные материалы, в голографии и др.
Проводники, полупроводники, диэлектрики



По электрическим свойствам материалы делятся на диэлектрики, проводники, полупроводники и сверхпроводники. Они отличаются друг от друга по величине удельного сопротивления, характеру изменения его в зависимости от температуры и механизму проводимости.
Диэлектрики. В отличие от металлов, кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью; они представляют собой диэлектрики. Хотя в этом случае тоже возможно образование энергетических зон, но здесь зона проводимости отдельна от валентной зоны запрещённой зоной, т.е. значительным энергическим промежутком. Энергия слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока. Вид химической связи в основном ионный или ковалентный. Свободные носители заряда отсутствуют. Между валентной зоной и зоной проводимостью находиться широкая запрещённая зона. Основные диэлектрики: соли, оксиды, стекло, полиэтилен, резина и др. Диэлектрики поляризуются в электрическом поле. Под действием электростатического поля положение и величина эффективных зарядов атомов диэлектрика изменяются, при этом внутри диэлектрика возникает собственное энергетическое поле, направленное противоположно к внешнему. Имеются также диэлектрики с высокой диэлектрической проницаемостью. Это обусловлено наличием самопроизвольно поляризующихся областей.
Полупроводники. При нагревании они близки к проводникам, а при охлаждении к диэлектрикам. Из простых это P, I, B, Se. Также многие бинарные соединения ZnO, FeO. Зависимость электрических свойств от температуры и освещённости объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещённой зоной. Однако ширина запрещённой зоны, в случае полупроводников не велика. Поэтому при повышении температуры или освещённости электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением освещённости или температуры число электронов, переходящих в зону проводимости, возрастает, в соответствии с этим увеличивается и электрическая проводимость полупроводника. В полупроводниках с ковалентной химической связью, появление электронов в зоне проводимости одновременно создаёт его вакансию в валентной зоне. Данная вакансия на конкретной молекулярной орбитали может заполняться электронами других занятых ближайших МО. Такой переход электронов внутри валентной зоне как бы создаёт движение вакансий с одного МО на другую МО. Поэтому электрический ток в полупроводнике определяется движением электронов в зоне проводимости и в валентной зоне. Полупроводники применяются в радиоэлектронике.
Проводники. С повышением температуры они увеличивают свою проводимость. Носителями заряда служат электроны. Валентная зона и зона проводимости электронной структуры пересекаются. Это позволяет электронам из валентной зоны при небольшом возбуждении переходить на молекулярные орбитали зоны проводимости, а это значит, что электрон с другой вероятностью появляется в той или иной точке компактного металла. Проводники используются для передачи электроэнергии. Среди проводников выделяются: металлы (Al, Cu, Fe) и сплавы высокой проводимостью (латунный, бронзовый, алюминиевый).
Особенности хим.связи в металлическом и атомном кристалле. По прочности металлическая решётка находиться между атомными и молекулярными металлическими решётками. Это связано с тем, что металлической связи характерны черты ковалентной связи и отдельные черты дальнодействующей связи. Металлическая решётка бывает и малопрочная (ртуть). Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Кристаллическое состояние вещества. Существуют вещества, в кристаллах которых значительную роль играют несколько видов взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентнымй связями локализованного и делокализованного характера, а в других — межмолекулярной связью. Поэтому решетку графита можно рассматривать и как атомную, и как металлическую, и как молекулярную. В узлах атомных решеток находятся атомы; они связаны друг с другом ковалентной связью. Веществ, обладающих атомными решетками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью (алмаз). Они тугоплавкие и практически не растворимы. Такие из свойст обусловлены прочностью ковалентной связи.
При введении трехвалентной примеси одна из валентных связей полупроводника оказывается незаполненной, что эквивалентно образованию дырки и неподвижного отрицательно заряженного иона примеси. Таким образом, в этом случае увеличивается концентрация дырок. Примеси такого типа называются акцепторами, а проводимость, обусловленная введением акцепторной примеси, называют проводимостью р–типа. Полупроводник данного вида называют полупроводником р–типа.
Преобладающие носители заряда в полупроводнике называются основными. Так в полупроводнике n–типа основными носителями являются электроны, а неосновными – дырки, а в полупроводнике р–типа основными носителями являются дырки, а неосновными – электроны. Как видим, в отличие от проводимости проводников, в которых ток обусловлен направленным движением только электронов, в полупроводниках ток может быть обусловлен двумя типами носителей – электронами и дырками.
22. Энтропия и ее изменение при химических реакциях.
23. Энергия Гиббса. Условия самопроизвольного протекания химических процессов.
Энергия Гиббса(G)- называемая также изобарно-термическим потенциалом или свободной порцией при постоянном давлении. G связана с H,S,T: G=H-TS. Если реакция осуществляется при постоянных P и Т, то ?G=?H-T?S. При постоянстве температуры и давления хим.реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается. При низких температурах самопроизвольно могут протекать экзотермические реакции, а при высоких – рекции сопровождающиеся влечение энтропии.
24. Предмет химической кинетики. Скорость химических реакций и факторы, влияющие на нее при гомогенных и гетерогенных процессах.
25. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Билет №26 Энергия Активации. Влиян. Т на V
26. Энергия активации. Влияние температуры на скорость химической реакции.
Ингибиторы- катализаторы, уменьшающие скорость реакции.
27. Энергия активации. Представление о катализе. Катализаторы и ингибиторы
28. Реакции простые и сложные. Лимитирующая стадия химического процесса.
Простые: происх. между простыми в-ми. Сложные: между сложными. Большинство химических реакций идут не в одну стадию, но и одностадийная реакция может кинетически осложняться, если она обратима. К кинетически сложным реакциям относят также последовательные(Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей При k1 >> k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1 29. Константа равновесия. Возможность смещения равновесия химической реакции в прямом и обратном направлениях. Принцип Ле-Шателье.
Константа равновесия: величина с помощью которой описывается равновесие между веществами в растворе, преимущественно между газами и жидкостями. Зависит только от температуры. Равновесный закон действующих масс: отношения произведения молярных концентраций продуктов к произведению молярных концентраций реагентов взятых в степенях равных стехиометрическим коэффициентам есть величина постоянная при данной температуре =Kр [C]с[D]d/[A]a[B]b=K. Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. При увеличении концентрации одного из веществ равновесие смещается в сторону расхода этого вещ-ва. При увеличении давления равновесие сдвигается в сторону уменьшения числа молекул газов т.е. в сторону понижения давления. При повышении температуры равновесие смещается в сторону эндотермической реакции. Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказать какое либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, которое уменьшит указанное воздействие.
30. Область жидкого состояния вещества. Диаграмма состояния воды.
31. Способы выражения количественного состава растворов: массовая, объемная и мольная доли. Массовая, молярная и нормальная концентрации, моляльность.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). Раствор находящийся в равновесии с растворяющимся веществом называется насыщенным. Раствор с низким содержанием растворённых веществ- разбавленный, наоборот-концентрированный. Способы выражения: 1. Массовая доля: отношение массы растворённого вещества к массе раствора. 2. Мольная доля: отношение кол-ва растворённого вещ-ва к сумме кол-в всех веществ составляющих раствор. N=n2\(n1+n2) 3. Молярность(Cm): отношение кол-ва вещ-ва к объёму раствора. 4. Моляльность(m): отношение кол-ва вещ-ва к массе р-ля. 5. Эквивалентная или нормальная конц-ия(Сн): отношение числа эквивалентов к объёму раствора. V1\V2=N2\N1 Объёмы растворов реагирующих веществ обратно пропорциональны их нормальностям. Объемная доля растворенного в-ва представляет собой отношение объема компонента, содержащегося в системе, к общему объему системы(ф=V(растворен)/V(раствора)*100%).
32. Растворы. Тепловые эффекты при растворении.
33. Растворимость. Коэффициент растворимости. Селективные растворители и их использование в процессах осушки и очистки природных газов.
Растворимость-способность в-ва растворятся в том или ином растворителе. Мерой растворимости в-ва при данных условиях служит содержание его в насыщенных растворах.; равновесная концентрация растворённого в-ва в его насыщенном растворе. Если в 100г. Воды раствор. Более 10г. В-ва –хорошо растворимое. Число единиц массы безводного в-ва насыщающего при НУ 100г. Единиц массы р-ля – есть коэффициент растворимости. Температура при которой ограниченная растворимость становится неограниченной называется критической температурой растворения Селективный растворитель: Диметилформамид Основные промышленные применения
34. Представление об идеальных растворах. Влияние концентрации растворенного вещества на давление насыщенного пара раствора, его температуру кипения и кристаллизации (закон Рауля и следствия из него).
Закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества. (Po-P)/Po=N Второй закон Рауля–понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально молярной концентрации раствора.
35. Явление электролитической диссоциации. Степень диссоциации. Классификация электролитов по степени диссоциации. Сильные и слабые электролиты.
Явление электролитической диссоциации: при растворении соли в воде ионы, образующие данный электролит, под действием полярных молекул воды отрываются друг от друга и перераспределяются м/у молекулами растворителя. Степень диссоциации- это отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Чем более полярен растворитель, тем больше степень диссоциации в нем данного электролита. Электролиты, степень диссоциации которых даже в относительно концентрированных растворах велика(à1), называют сильными(почти все соли, мин.соли : H2SO4, HNO3, HI, HMnO4; основания щел и щел-зем металлов), а электролиты, степень диссоциации которых даже в разбавленных растворах мала,-слабыми(Почти все орг. кислоты, некоторые мин.кислоты: H2CO3, H2S, многие гидрооксиды металлов).
36. Электролитическая диссоциация. Факторы, влияющие на диссоциацию электролитов. Слабые электролиты. Константа диссоциации слабых электролитов.
Электролитическая диссоциация- самопроизвольный процесс распада электролита в растворе с образованием положительно и отрицательно заряженных ионов, или соответственно катионов и анионов. 1)Чем более полярен растворитель, тем больше степень диссоциации в нем данного электролита. 2)повышение температуры, как правило, увеличивает диссоциацию и при нагревании степень диссоциации возрастает. 3)при уменьшении концентрации электролита, т.е. при его разбавлении, степень дисс. увеличивается. Электролиты, степень диссоциации которых даже в разбавленных растворах мала,- слабые(Почти все орг. кислоты, некоторые мин.кислоты: H2CO3, H2S, многие гидрооксиды металлов). Константа диссоциации сл.электролитов- это отношение произведения концентраций продуктов реакции к концентрации реагентов.
37. Диссоциация слабых электролитов. Количественные характеристики процесса диссоциации: степень и константа диссоциации. Закон разбавления Освальда.
Константа диссоциации сл.электролитов- это отношение произведения концентраций продуктов реакции к концентрации реагентов. Константа диссоциации – константа равновесия отвечающая диссоциации слабого электролита. Зависит от природы электролита и растворителя, температуры но не зависит от концентрации. Характеризует способность данного в-ва распадаться на ионы. Чем больше К тем лучше в-во диссоциирует. Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом….Константа равновесия Kр этой реакции и есть Kд: Kp=[H + ][An]/[HAn]Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим Kд=(C*a*C*a)/C(1-a)=(C*a 2 )/(1-a). Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α 2 )
38. Диссоциация воды. Понятие «водородный показатель». Кислые и щелочные среды. Понятие о кислотно-основных индикаторах.
| Название индикатора | Цвет индикатора в различных средах | |
| в кислой | в нейтральной | в щелочной |
| Метиловый оранжевый Метиловый красный Фенолофталеин Лакмус | Красный(pH 6,3 ) Малиновый (pH>9,8) Синий (pH>8) |
39.Диссоциация сильных электролитов. Активность ионов в растворах. Коэффициент активности. Представление о ионной силе раствора.
40.Кислоты и основания. Основные положения теории кислот и оснований Аррениуса, Бренстеда-Лоури, Льюиса
Теория кислот и оснований Аррениуса (1887). Теория о процессах диссоциации в водных растворах; в соответствии с ней кислоты представляют собой вещества, которые в водных растворах отдают положительные ионы водорода; основания представляют собой вещества, которые в водном растворе отдают отрицательные гидроксид-ионы. Кислота —> Анион (кислотный остаток) + Н + Основание —* Катион + ОН
41.Гидролиз. Общие закономерности гидролиза солей. Факторы, влияющие на процесс гидролиза. Гидролиз солей различной природы.
42.Количественные характеристики процесса гидролиза: степень и константа гидролиза. Напишите уравнения реакций гидролиза солей Al2(SO4)3, Na2CO3, Сr2(СO3)3, КNO3 в молекулярной и ионно-молекулярной формах.
Степень гидролиза – доля в-ва подвергшееся гидролизу. Зависит: от константы равновесия, от температуры, от концентрации соли. Константа гидролиза – это отношение произведения концентраций кислоты и основания к концентрации образовавшейся соли. 1) Al2 (SO4)3+H2O=2AlOHSO4+H2SO4 (сл. + сильн.)
4)KNO3 гидролизу не подвергается (сильн. + сильн.)
43. Равновесие в гетерогенных системах. Произведение растворимости. Условия образования и растворения осадков.
К равновесным системам следует отнести также и систему труднорастворимый электролит – его насыщенный раствор. В этом случае мы имеем дело с динамическим гетерогенным равновесием осадок-его насыщенный раствор. Например CaSO4=Ca 2+ +SO4 2- Константа равновесия для этого процесса будет иметь вид: K=[ Ca 2+ ][ SO4 2- ]\[ CaSO4] но так как конц. тверд. соли есть Const, то Ур-е имеет вид K=[ Ca 2+ ][ SO4 2- ] В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной Т. И обозначается произведением растворимости (ПР). Характеризует количественно способность электролита растворяться. Численное значение находится исходя из растворимости. НО Произведение растворимости вычисленное без учёта коэффициентов растворимости является постоянной величиной только для малорастворимых электролитов. ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре : если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). Если ПК ПР, ΔG > 0 – возможен только обратный процесс – выпадение осадка.
44. Жесткость природных вод. Временная и постоянная жесткость. Способы устранения жесткости. Представление о системе водоподготовки.
45. Окислительно-восстановительные реакции. Окисление и восстановление. Типичные окислители и восстановители.
46. Типы окислительно-восстановительных реакций. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Приведите примеры реакций каждого типа.
47. Возникновение скачка потенциала на границе раздела металл/электролит. Стандартный электродный потенциал. Водородный электрод. Стандартный водородный электрод.
48. Ряд стандартных электродных потенциалов. Выводы из ряда стандартных электродных потенциалов.
49. Гальванические элементы. Химические гальванические элементы. Анод и катод. Анодный и катодный процессы. ЭДС гальванического элемента.
50. Обратимые и необратимые электроды. Уравнение Нернста. Концентрационный гальванический элемент. Анод и катод в концентрационном элементе.
51. Явление поляризации. Поляризация анодная и катодная. Причины, вызывающие поляризацию электродов (концентрационная и активационная поляризации).
При смещении потенциала электрода в положительную или отрицательную сторону на нём начинает происходить окисление или восстановление. Такое явление смещения называется поляризацией. Иначе говоря поляризация позволяет управлять процессом электролиза и делать электроды анодами или катодами смотря к какому источнику подключать. Поляризация электрода в отрицательную сторону связана с процессом восстановления и наоборот. Процесс восстановления- катодный процесс, процесс окисления – анодный процесс. Чем сильнее поляризован электрод тем с большей скоростью идёт реакция. Величина поляризации необходимая для протекания данного электродного процесса с определённой скоростью называется перенапряжением данного электродного процесса.
52. Коррозия металлов. Классификация коррозионных процессов. Химическая и электрохимическая коррозия.
53. Способы защиты металлов от коррозии. Химическая обработка среды.
54. Способы защиты металлов от коррозии. Защитные покрытия.
Изменение коррозионных св-в металла достигается его легированием или нанесением на поверхность металла защитных покрытий. Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до 18% хрома и до 10% никеля. Покрытия применяемые для защиты металлов подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла. В качестве металла для покрытия обычно применяют металлы, образующие на своей поверхности защитные плёнки(Cr, Ni, Zn, Cd, Al, Sn, реже Au, Ag). Неметаллические: лаки, краски, эмали. Фенолоформальдегидные и другие смолы. Для длительной защиты от атмосферной коррозии металлических сооружении, деталей, машин, приборов чеще всего применяются лакокрасочные покрытия. Покрытия создаваемые хим. и электрохим. обработкой металла представляют собой защитные оксидные и солевые плёнки. (оксидтрование Al, фосфатирование стальных изделий).
55. Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита. Катодная защита.
К электрохимическим методам защиты металлов относятся катодная защита, протекторная защита и др. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа или специально изготовленные сплавы. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает в-во анода. Протекторная защита осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла – протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте м/у металлами защищаемый металл (Fe) и металл протектора (напр Zn) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железе поляризуется катодно, а Zn- анодно. В результате этого, на железе идет процесс восстановления того окислителя, который присутствует в воде(обычно растворенный кислород), а Zn окисляется. И протекторы и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей мрских судов.
57. Химическое взаимодействие металлов с растворами щелочей. Приведите примеры соответствующих уравнений реакций.
Взаимодействие Ме с растворами щелочей. Щелочами металлы окисляться не могут, так как щелочные металлы являются одними из наиболее сильных восстановителей. Поэтому их ионы одни из наиболее слабых окислителей и в водных р-рах практических свойств окислителя не проявляют. Однако в присутствии щелочей окисляющее действие воды может проявиться в большей мере, чем в их отсутствии. При окислении металлов водой образуются гидроксиды и водород. Если оксид и гидроксид относится к амфотерным соединениям, то они будут растворяться в щелочном р-ре. В результате пассивные в чистой воде металлы могут энергично взаимодействовать с растворами щелочей:
| H2O (окислитель H + )+щелочь(например, NaOH ) | ||
| Активные | Средней активности | Малоактивные |
| Реагируют только Be | Реагируют Al, Zn, Sn, Pb | Не реагируют |
58. Химическое взаимодействие металлов с водой и с растворами солей. Объясните закономерности и приведите примеры соответствующих уравнений реакций.
| H2O (окислитель H + ) | ||
| Активные | Средней активности | Малоактивные |
| Реагируют | Реагируют, пассивируются: Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Cd, Pb | Не реагируют |
1. металлы более активные вытесняют менее активные из их солей Zn+CuSO4=ZnSO4+Cu
2. Взаимодействие металла с солями, дающими кислую реакцию среды засчет гидролиза металл., происходит также, как в растворе соответствующей к-ты, если металл, образующий соль, активнее растворяющего металла и кислорода.