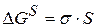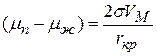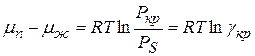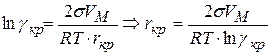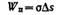Чем отличаются процессы гомогенной и гетерогенной конденсации
Термодинамика образования новой фазы
Конденсационное образование дисперсных систем.
В процессе конденсации образование новой фазы происходит уже на имеющихся поверхностях (стенке сосуда, поверхности других веществе) – гетерогенная конденсация, или на поверхности зародышей, возникающих самопроизвольно в результате флуктуаций плотности и концентраций веществ в системе – гомогенная конденсация.
Чтобы не исчезли зародыши конденсации в системе необходимо пресыщение. Необходимость пересыщения для образования гетерогенной дисперсной системы из гомогенной следует и из того, что появление избыточной поверхностной энергии при конденсации должно быть скомпенсировано избытком энергии Гиббса системы и обеспечивается пересыщением.
Степень пересыщения для пара и раствора выражается соотношениями
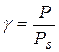
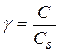
где Р – давление пересыщенного пара
Рs – равновесное давление пересыщенного пара над плоской поверхностью жидкости
С – концентрация вещества в пересыщенном растворе
Сs – равновесная растворимость относительно монокристаллов
Возникновение центов конденсации происходит при критической 
1) объемная составляющая, которая определяется разностью химических потенциалов вещества в паре 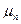
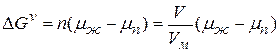
где n – число молей вещества в зародыше
Vм – мольный объем вещества
2) поверхностная составляющая. Возникающая поверхностная энергия равна
3) составляющая, обусловленная энергией упругой деформации при структурном изменении твердого тела. Для газов и жидкостей третьей составляющей можно пренебречь.
Рассмотрим зародышеобразование в системе с жидкой дисперсионной средой в отсутствии посторонних зародышей – гомогенная конденсация. Полное изменение энергии Гиббса при образовании зародыша конденсации составляет
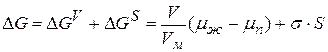
При анализе уравнения видно, что
если 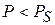

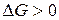
если 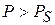
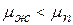
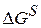
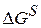
Допустим, что зародыш имеет сферическую форму, тогда

Какой вид имеет зависимость 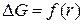
Возникновение новой фазы возможно при r = rкр.
С целью установления экстремума приравниваем производную 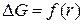
где rкр – критический радиус зародыша в точке экстремума
Известно, что 

Взяв вторую производную от энергии Гиббса, установим, является экстремум max или min

Вторая производная 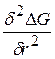
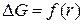
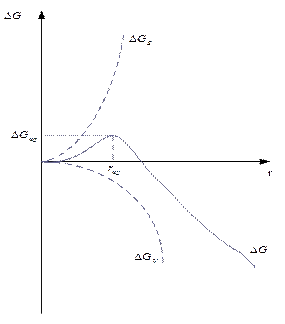
Рис. 2.1. Зависимость энергии Гиббса от радиуса зародыша
Максимум функции говорит о неустойчивом состоянии между фазами (метастабильное состояние)
1) если 
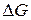
2) если 
3) если 
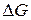
Рассчитаем значение 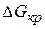

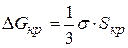
Ранее установили, что


При анализе уравнения видно, что 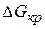

Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Экзаменационный билет № 7. 1. Методы получения дисперсных систем: диспергирование и конденсация



1. Методы получения дисперсных систем: диспергирование и конденсация. Уравнение Ребиндера для работы диспергирования. Адсорбционное понижение прочности (эффект Ребиндера). Конденсация физическая и химическая. Энергия Гиббса образования зародыша новой фазы при гомогенной конденсации; роль пересыщения.
Диспергирование и конденсация — методы получения свободно-дисперсных систем: порошков, суспензий, золей, в том числе аэрозолей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Работа упругого и пластического деформирования пропорциональна объему тела:
Работа образования новой поверхности при диспергировании пропорциональна приращению поверхности:
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения прочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и разрушение твердого тела.
Процесс конденсации предполагает образование новой фазы на уже имеющихся поверхностях (стенках сосуда, частицах посторонних веществ — ядрах конденсации) или на поверхности зародышей, возникающих самопроизвольно в результате флуктуации плотности и концентраций вещества в системе. В первом случае конденсация называется гетерогенной, во втором — гомогенной.
Чтобы сконденсированное вещество не возвращалось в первоначальную фазу и конденсация продолжалась, исходная система должна быть пересыщенной. В противном случае конденсация не может происходить, исчезают и зародыши конденсации (путем их испарения, растворения, плавления).
При гомогенной конденсации происходит самопроизвольное образование зародышей; энергия поверхности выступает в качестве потенциального барьера конденсации. Энергию Гиббса образования зародышей выражают (в соответствии с объединенным уравнением первого и второго начал термодинамики) в виде четырех составляющих: энтропийной, механической, поверхностной и химической.
Для жидких и газообразных фаз можно ограничиться двумя первыми составляющими энергии Гиббса образования зародышей.

Если степень пересыщения больше критической величины, то возникающие зародыши будут самопроизвольно расти.
Критическая энергия Гиббса образования зародышей конденсации соответствует критической точке — максимуму функции ΔG = f(r):
Таким образом, энергия Гиббса образования зародышей при гомогенной конденсации равна одной трети поверхностной энергии зародыша. Если найти радиус зародыша в критической точке, приравняв к нулю первую производную от энергии Гиббса и подставить его в данное выражение, то получим:
Из этого соотношения следует, что энергия образования зародыша конденсации зависит от степени пересыщения, от нее же зависит и размер критического радиуса зародыша. Чем выше степень пересыщения, тем ниже энергия Гиббса образования зародышей и тем меньше размеры образующихся зародышей, способных к дальнейшему росту.
2. Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
В золях через определенное, иногда очень длительное, время оседания частиц может наступить момент, когда диффузионный поток станет равным седиментационному iдиф = iсед, т.е. наступит диффузионно-седцментационное равновесие. Так как такое равновесие наступает при определенном градиенте концентраций, в системе должно установиться соответствующее распределение дисперсной фазы по высоте. Чтобы определить закон этого распределения, воспользуемся данным соотношением (iдиф = iсед), учтя, что
и заменив x на h (расстояние по высоте):
После разделения переменных получим:
Интегрируя в пределах от ν0 до νh и соответственно от h = 0 до h, найдем:

Это уравнение носит название гипсометрического закона (от лат. hypsos — высота).
Если сравнить седиментацию при наличии диффузии и без нее, то обращает на себя внимание различие факторов, обеспечивающих устойчивость дисперсных систем к осаждению — седиментационную устойчивость. Эти факторы позволяют различать кинетическую седиментационную устойчивость (КСУ) и термодинамическую седиментационную устойчивость (ТСУ).
Мерой кинетической седиментационной устойчивости является величина, обратная константе седиментации:
Мерой ТСУ является гипсометрическая высота. Ее удобнее определить как высоту he, на протяжении которой концентрация дисперсной фазы изменяется в е раз.
Данная формула показывает, что гипсометрическая высота и соответственно термодинамическая седиментационная устойчивость тем больше, чем меньше размер частиц и разность между плотностями частиц и среды. Вязкость не влияет на ТСУ, в то (же время повышение температуры способствует устойчивости, так как усиливается тепловое движение. Кинетическая же седиментационная устойчивость с повышением температуры обычно снижается в связи с уменьшением вязкости среды.
Теории Поляни-Дубинина объемного заполнения микропор.
Адсорбция на пористых телах зависит от структуры и размера пор, от природы взаимодействующих веществ, от внешних факторов (температуры, давления), от характера транспортных явлений в порах.Основа теории объемного заполнения пор – теория Поляни о многослойной адсорбции.
Основные положения теории Поляни о многослойной адсорбции:
Теория объемного заполнения микропор адаптирует положения теории Поляни применительно к специфике адсорбции в пористых телах.
Специфика заключается в следующем:
За меру адсорбционного взаимодействия в теории объемного заполнения микропор принят адсорбционный потенциал ε, кот. Соответствуем работе переноса 1 моля газа с поверхности жидкого адсорбата (давление рs) в равновесную газовую фазу (давление р): ε=RTln(ps/p).
Т.о. задача теории объемного заполнения микропор сводится к поиску способа перехода от обычных координат изотермы(А, р) к параметрам адсорбционного поля, т.е к установлению взаимосвязи этих параметров.

На основе характеристических кривых можно, зная изотерму при любой температуре, построить изотерму при любой другой температуре, по схеме: А1→φ→А2 и р1→ ε →р2
Т.о. теория Поляни позволяет вычислить величину адсорбции для любой заданной температуры, если известна хотя бы одна изотерма.
Дубинин показал зависимость м/у адсорбционным объемом и адсорбционным потенциалом V=Vmaxexp[-(ε/E) n ] или A=Amaxexp[-(ε/E) n ], где А и Amax – адсорбция и максимальная адсорбция соответственно, V и Vmax – заполненный объем и предельный объем абсорбционного пространства, Е – характеристическая энергия адсорбции, не зависящая от температуры, n – параметр, не зависящий от температуры.
Интегрируя, получим: lnA=lnAmax- ε n (1/E).
74. Гомогенная и гетерогенная конденсация. Метастабильное состояние. Механизм мицеллообразования при получении золей методом химической конденсации.
Гомогенная конденсация – образование жидкости из паров
Гетерогенная конденсация – слияние мельчайших капелек жидкости.
Метастабильное состояние – неустойчивое состояние системы, кот. легко получается из стационарного режима малейшим внешним воздействием.
Механизм получения мицелл методом хим. конденсации:
1. Образование зародышей.
2 механизма образования зародышей
Происходит кристаллизация ионов на пов-ти зародыша и образование агрегата заданных размеров. Скорость кристаллизации лимитирует скорость диффузии (з-н Фика): 

3. Адсорбция стабилизатора и возникновение ДЭС.
Представляет собой заключительный этап образования золя. На этой стадии прекращают рост кристаллов и стабилизируют коллоидную сис-иу добавками стабилизаторов. Стабилизатором м. служить ионы одного из реагентов, используемых для получения в-ва дисп. фазы, если этот реагент взят в избытке. Ионы стабилизатора адсорбируются на пов-ти микрокристаллического агрегата и заряжают ее. В дальнейшем на заряженной пов-ти формируется ДЭС, кот. определяет устойчивость и электронейтральность ч-ц дисп. фазы.
75. Изотермическая перегонка в дисперсных системах(ИПДС)
ИПДС состоит в том, что в полидисперсной системе происходит перенос в-ва от мелких ч-ц дисперсной фазы к более крупным.
Следствием процесса является постепенное исчезновение мелких ч-ц, уменьшение средней дисперсности и свободной энергии, т.е. ИПДС – один из механизмов разрушения дисперсных сис-м.
Движущая сила этого процесса – стремление сис-мы уменьшить свободную энергию и перейти в равновесное состояние. Перераспределение в-ва от мелких ч-ц к более крупным для дисперсных сис-м оказывается наиболее выгодным энергетическим процессом, уменьшающим свободную энергию сис-мы и выравнивающим хим. потенциалы в-ва в отдельных ч-цах.
Выделяют 3 основные стадии изотермич. перегонки:
1. растворение или испарение мелких ч-ц
2. транспорт в-ва от мелких ч-ц к более крупным
Транспорт в-ва при ИПДС осущ-ся посредством диффузии, которую количественно можно описать с пом. з-на Фика : 

Растворимость ч-ц определяет концентрацию в-ва у пов-ти различных ч-ц. Разность м/у поверхностными концентрациями у малых и больших ч-ц влияет на величину градиента конц-ции (∆с), параметра, входящего в ур-ние Фика: ∆c=c(r1)-c(r2)
Если r2 значительно больше r1, то разность концентраций будет определяться главным образом конц-цией у пов-ти малой ч-цы, а значит – размером малой ч-цы. Поэтому принимая r2 постоянной, разложив экспонент в ряд, получим: 
Т.к. величина ∆с определяет градиент концентрации – параметр, входящий в ур-ние Фика, можно сделать вывод, что транспорт в-ва при изотермической перегонке зависит от величины коэффициента диффузии, от растворимости в-ва дисперсной фазы, размеров ч-ц, поверхностного натяжения и температуры.
Методыполучения свободнодисперсных систем (диспергирование, конденсация)
Для получения дисперсных систем используют диспергационный и конденсационный методы, являющиеся основными при получении свободнодисперсных систем: порошков, суспензий, золей и прочее.
Под диспергированием понимают дробление и измельчение, под конденсацией – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Диспергационный метод представляет собой измельчение более крупных частиц в мелкие. Суть метода заключается в преодолении межмолекулярных сил и накоплении свободной поверхностной энергии в процессе диспергирования за счет внешней механической работы.
При дроблении и измельчении материалы разрушаются, в первую очередь, в местах дефектов. Поэтому, по мере измельчения, прочность частиц растет. В то же время, увеличение прочности материалов по мере их измельчения ведет к большему расходу энергии на дальнейшее их диспергирование.
Для получения дисперсных систем методом диспергирования широко применяют: дробилки, мельницы, жернова и прочее.
[2], с. 70 (А. М. Сыркин – Поверхностные явления и дисперсные системы в нефтепромысловом деле)
Основными условиями получения гетерогенных дисперсных систем являются:
— низкая растворимость вещества дисперсной фазы в дисперсионной среде;
— присутствие третьего компонента – стабилизатора, вещества, понижающего поверхностное натяжение или сообщающего частицам электрический заряд. Стабилизаторами являются ПАВ или электролиты, которые создают вокруг частиц дисперсной фазы адсорбционный защитный слой, препятствующий слипанию раздробленных частиц и выпадению их в осадок.
Диспергирование сопровождается увеличением поверхности раздела фаз, следовательно, возрастанием поверхностной энергии, на что требуется затратить энергию извне.
Механическое диспергирование – измельчение крупных частиц в мелкие. Используются мельницы, жернова и прочее.
Химическое диспергирование – диспергирование осадков, образующихся при слиянии коллоидных частиц, можно достичь с помощью химических добавок – пептизаторов. Этот метод химического диспергирования называется пептизацией.
В их основе лежат химические и физические процессы, ведущие к образованию твердой фазы в гомогенных растворах путем перевода растворенных веществ в нерастворимое состояние. При этом необходимо создать такие условия, чтобы в процессе образования твердой фазы не было возможности выпадения осадка. Для этого необходимо задержать рост образующихся частичек дисперсной фазы на нужном пределе, чтобы они не переросли размеры, свойственные микро- или ультрамикрогетерогенным системам. Практически это достигается с использованием определенной концентрации реагирующих веществ, изменением физических параметров, и введением химических добавок.
В зависимости от протекающих процессов различают химические и физические методы конденсации. Общим для этих методов является создание сильно перенасыщенного состояния (раствора), из которого и происходит образование частичек вещества дисперсной фазы.
В основе методов химической конденсации лежат разнообразные химические реакции: обмена, гидролиза, окислительно-восстановительные и прочее.
Реакции обмена и гидролиза солей, происходящие при смешивании природной и закачиваемой в пласт вод, при смешивании минерализованных пластовых вод разных горизонтов приводят к самопроизвольному образованию гетерогенных дисперсных систем, затрудняющих эксплуатацию скважин.
Окислительные процессы, приводящие к образованию гетерогенных дисперсных систем происходят и в результате воздействия различного рода бактерий.
В этих методах пресыщение раствора и образование частичек дисперсной фазы достигается изменением физических условий среды (температуры, давления, заменой растворителя и прочее).
Так, с уменьшением давления и температуры растворимость большинства солей уменьшается, и поэтому, при выходе пластовых вод на поверхность, происходит самопроизвольное выделение солей первоначально в виде дисперсных частиц, а затем, при отсутствии стабилизатора, и выпадение их в осадок.
Диспергирование – измельчение крупных частиц в более мелкие.
Конденсация – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.