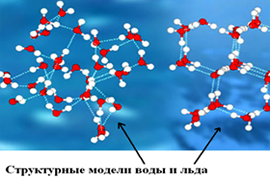
Чем отличаются молекулы льда и воды 7 класс
Чем отличаются молекулы воды и молекулы льда?
Понятие молекулы ( и производные от него представления о молекулярном строении вещества, структуры собственно молекулы) позволяет понимать свойства веществ создающих мир. Современные, как и ранние, физико-химические исследования опираются и базируются на грандиозном открытие об атомно-молекулярном строении вещества. Молекула – единая «деталь» всех веществ, существование которой предположил ещё Демокрит. Потому именно её структура и взаимосвязь с другими молекулами (образуя определенное строение и состав) и определяет/объясняет все различия между веществами, их видом и свойствами.
Сама молекула, будучи не самой мельчайшей составной частью вещества (коей является атом) имеет определенную структуру, свойства. Определяется структура молекулы числом вхожих в неё определенных атомов и характером связи (ковалентной) между ними. Состав этот неизменен, даже если вещество преобразуется в другое состояние(как примеру, происходит с водой – об этом пойдет речь дальше).
Характеристики воды, её состояния
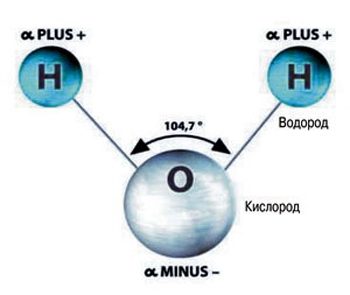
Состав такого вещества, как вода (равно как и её химическая формула) знаком каждому. Каждую её молекулу составляют три атома: атом кислорода, обозначающийся буквой «О», и атомы водорода – латинская «Н», в количестве 2-х. Форма молекулы воды не симметрична (схожа с равнобедренным треугольником).
Вода, как вещество, составляющие её молекулы, реагирует на внешнюю «обстановку», показатели окружающей среды — температуру, давление. Зависимо от последних вода способна изменять состояние, которых три:
Помимо данных различий, естественно, разнятся и способы «перехода» вещества из одного состояния (жидкого) в другие. Эти переходы и трансформируют вещество, и провоцируют передачу энергии (выделение/поглощение). Среди них есть процессы прямые – преобразование жидкой воды в пар (испарение), в лед (замерзание) и обратные – в жидкость из пара (конденсация), из льда (таяние). Также и состояния воды — парообразное и лед — могут трансформироваться друг в друга: возгонка – лед в пар, сублимация – обратный процесс.
Специфичность льда как состояния воды
Широко известно, что лед замерзает ( трансформируется из воды) при пересечении температурой в сторону уменьшения границы в ноль градусов. Хотя, в этом всем понятном явлении, есть свои нюансы. К примеру, состояние льда неоднозначно, различны его виды, модификации. Отличаются они первоочередно условиями, при которых возникают – температурой, давлением. Таких модификаций насчитывается аж пятнадцать.
Лед в разных своих видах имеет различное молекулярное строение (молекулы же неотличимы от молекул воды). Природный и естественный лед, в научной терминологии обозначающийся как лед Ih — вещество с кристаллической структурой. То есть, каждая молекула с четырьмя окружающими её «соседками» (расстояние между всеми равное) создают геометрическую фигуру тетраэдр. Другие фазы льда обладают более сложной структурой, к примеру высокоупорядоченная структура тригонального, кубического или моноклинного льда.
Основные отличия льда от воды на молекулярном уровне
Первое и напрямую не относящееся к молекулярному строению воды и льда различие между ними – показатель плотности вещества. Кристаллическая структура, присущая льду, образовываясь, способствует одновременному уменьшению плотности (с показателя почти в 1000 кг/м³ до 916,7 кг/м³). А это стимулирует увеличение объема на 10%. 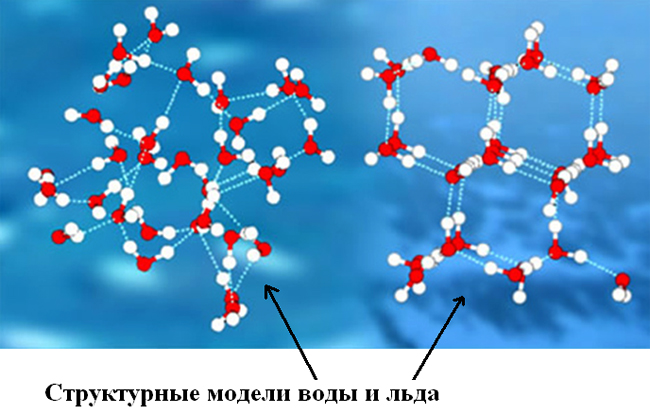
Основное же отличие в молекулярном строении этих агрегатных состояний воды (жидкого и твердого) в количестве, виде и силе водородных связей между молекулами. Во льду же (твердом состоянии) ими объединены пять молекул, а собственно связи водородные прочнее.
Отличает вещество воды в разных её состояниях (агрегатных) не только структура расположения молекул (молекулярное строение), но и движение их, сила взаимосвязи/притяжения между ними. Молекулы воды в жидком состоянии достаточно слабо притягиваются, обеспечивая текучесть воды. В твердом же льду наиболее сильно притяжение молекул, потому и мала их двигательная активность (она обеспечивает постоянство формы льда).
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
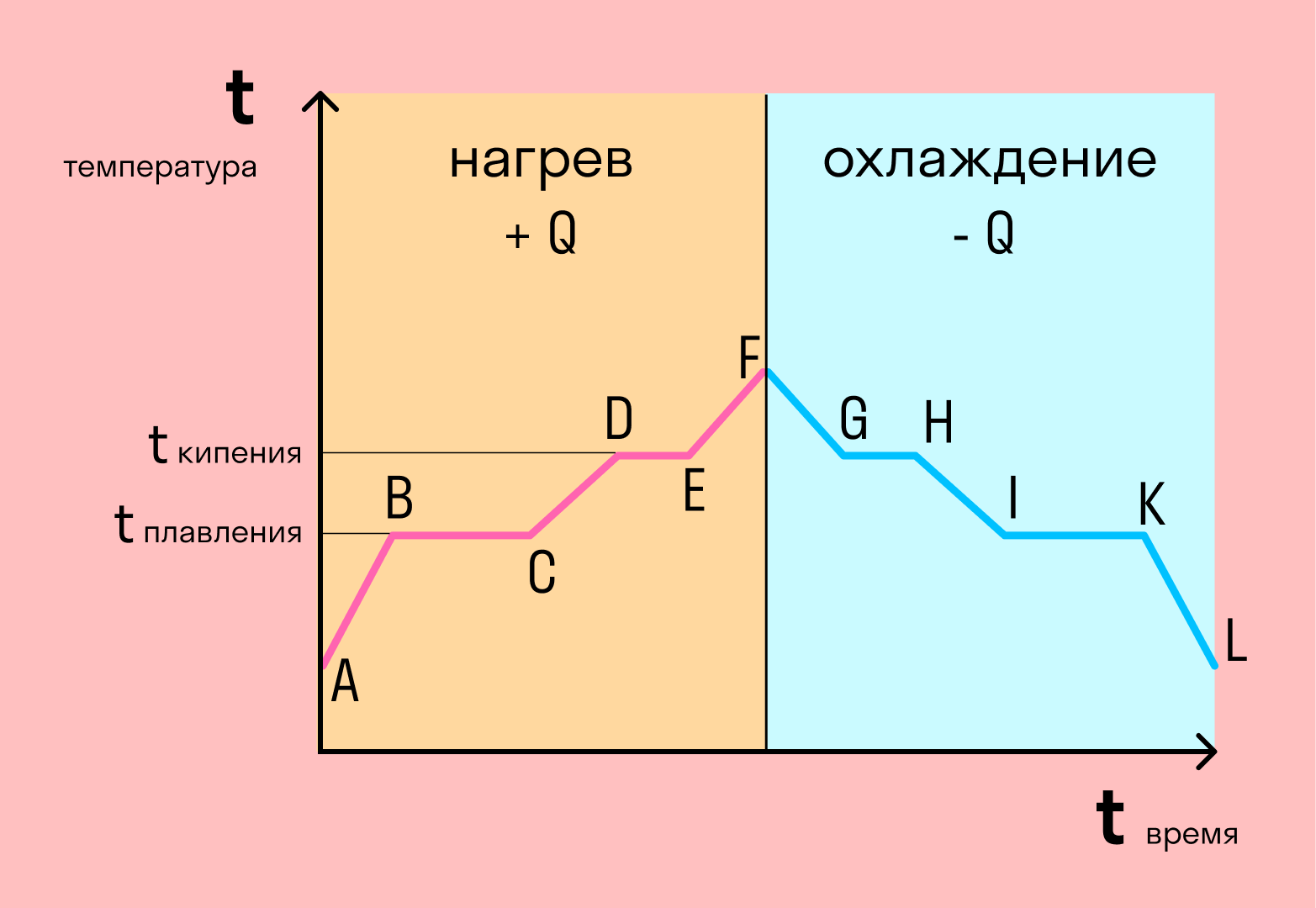
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Чем отличаются молекулы льда, воды и водяного пара? Заранее большое спасибо.
Молекула воды и водяного пара одинаковы между собой. При химическом разложении воды можно получить водород и кислород, которые отличаются друг от друга. Они же по своим свойствам не похожи на молекулы воды. Отсюда следует, что молекулы состоят из более мелких частиц — атомов, химически неделимых частиц.
Существует ограниченное число видов атомов. Атомы одного и того же вида одинаковы, но отличаются от атомов любого другого вида.
В настоящее время известно 105 видов атомов или, что то же, 105 химических элементов.
Атомы могут различным образом соединяться друг с другом •при химических реакциях, образуя новые вещества.
Как уже упоминалось, молекула воды состоит из водорода и кислорода. При этом в каждой молекуле воды в середине находится атом кислорода (О) и к нему с двух сторон присоединены два атома водорода (Н), Молекула самого легкого элемента — водорода состоит из двух атомов водорода.Может это)
Ответ:
Объяснение:
t=700000/220*4= 795 секунд (приблизительно)
1. d= 2.4 мм =0,0024 м, С=С1, ε= 81. Δd1-?
ε0S/d=εε0S/d1,
1/d=ε/d1,
d1=ε*d,
d1=81*0,0024,
d1=0,1944 м
Δd1= d1-d.
Δd1=0,1944-0,0024=0,192 м.
При перемешении из точки (7;2) в точку (-5;7)
Δ² = (x2-x1)²+(y2-y1)² = (-5-7)²+(7-2)² = 169 = 13²
Модуль перемещения |Δ| = 13
Q(плавления)= l(лямбда) *m (льда)
Q(изменения температуры)= c(удельная теплоемкость воды) * m(воды)
т.к масса льда = массе воды =>
Q(плавления )/Q(изменения температуры)= l(лямбда) *m (льда)/ c(удельная теплоемкость воды) * m(воды)= l(лямбда)/ c(удельная теплоемкость воды)
Ответ: 2 задача: 1 кг=9.8H
9.8*60= 588H
Ответ: вес ящика равен 588H
Молекула воды: строение в различных агрегатных состояниях
Модель строения воды
Молекула воды включает два атома водорода (Н) и один атом кислорода (О). Элементы, из которых состоит жидкость, определяют всю функциональность и особенности. Модель молекулы воды имеет форму треугольника. Вершину этой геометрической фигуры представляет крупный элемент кислорода, а внизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумя отрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишка электронной плотности у атомов кислорода, а положительные – из-за нехватки электронной плотности у водорода.
Неравномерное распределение электрических зарядов создает диполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностью растворять вещества, поскольку ее молекулы пытаются нейтрализовать электрическое поле. Диполя приводят к тому, что на поверхности погруженных в жидкость веществ становятся слабее межатомные и межмолекулярные связи.
Вода отличает большой устойчивостью при растворении прочих соединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протон переходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другими веществами и не влияет на структуру этих соединений. Такая жидкость считается инертным растворителем, что особо важно для живых организмов. Полезные вещества поступают к различным органам через водные растворы, поэтому важно, чтобы их состав и свойства оставались неизменными. Вода сохраняет в себе память о растворенных в ней веществах и может применяться многократно.
Каковы особенности пространственной организации молекулы воды:
Атомы водорода соединяются с атомами кислорода и образуют молекулу воды с ковалентной связью. Водородные соединения более сильные, поэтому, когда они разрываются, то молекулы присоединяются к другим веществам, способствуя их растворению.
Это свойство подтверждается и большой теплотой парообразования, что делает жидкость хорошим энергоносителем. Вода – отличный регулятор температуры, способен нормализировать резкие перепады этого показателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов. Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18. Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться с атомной массой кислорода и водорода, которая равна 16 и 1 соответственно. В химических задачах нередко встречается массовая доля воды. Этот показатель измеряется в проценте и зависит от формулы, которую требуется рассчитать.
Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля, дигидроля и тригидроля. Количество этих элементов зависит от агрегатного состояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂O обозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
При этом существуют переходные состояния жидкости, например, при испарении или замерзании. Для начала требуется разобраться, отличаются ли молекулы воды от молекул льда. Так замерзшая жидкость имеет кристаллическую структуру. Модель льда может иметь форму тетраэдр, тригональной и моноклинной сингонии, куба.
Обычная и замерзшая вода отличаются плотностью. Кристаллическая структура приводит к меньшей плотности и увеличению объема. Основное различие между жидким и твердым состоянием – это количество, сила и разновидность водородных связей.
Состав не меняется ни в одном агрегатном состоянии. Отличается строение и движение составных частей жидкости, сила связей водорода. Обычно молекулы воды слабо притягиваются друг к другу, размещаются хаотично, поэтому жидкость такая текучая. Лед отличается более сильным притяжением, так как создается плотная кристаллическая решетка.
Многих интересует, одинаковы ли объемы и состав молекул холодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни в одном из агрегатных состояний. Молекулы при нагревании или остывании жидкости отличаются расположением. В холодной и горячей воде разные объемы, так как в первом случае структура упорядоченная, а во втором – хаотичная.
Когда лед тает, то его температура не меняется. Только после того, как жидкость меняется свое агрегатное состояние, показатели начинают подниматься. Для таяния требуется определенное количество энергии, которое называется удельной теплотой плавления или лямбда воды. Для льда показатель равен 25000 Дж/кг.
Твердое состояние воды
Вода в твердом состоянии – это лёд и снег. Некоторые не понимают, к какому агрегатному состоянию воды относится иней. Конечно, к твёрдому! Это мелкая ледяная крошка, замерзшие капли росы.
Твердая – это замороженная вода. Когда она замерзает, ее молекулы отодвигаются подальше друг от друга, делая лед менее плотным, чем жидкость, т.е. вода в твердом состоянии занимает больший объем, чем в жидком.
Большинство веществ при снижении температуры сжимается, а вода – расширяется, и в этом ее уникальная особенность.
Замерзает – это значит, что при 0 градусов Цельсия вода кристаллизуется и переходит из жидкого состояния в твердое. Наличие в воде солей снижает температуру замерзания.
Несмотря на то, что самое распространенное на нашей планете — жидкое состояние воды, значительная ее часть (2/3 всех пресноводных запасов) находится в замороженном виде. Площадь ледников – около 11% всей суши Земли.
Жидкое состояние воды
Вода в жидком состоянии встречается на нашей планете не только в реках и океанах. Облака состоят из крошечных капелек воды и кристалликов льда, и дождь – это тоже жидкая вода.
Также вода в жидком состоянии просачивается через почву и образует подземные водные горизонты, из которых черпается основная масса питьевой воды.
Вода в жидком состоянии отличается высокой прилипчивостью к различным твердым материям. Сама по себе она не является «влажной», но легко делает влажными большинство твердых материалов.
Жидкая вода легко переходит в твердое и газообразное состояние. Главным образом, это зависит от температуры. Но свою роль играет и давление.
Физический переход воды из жидкого состояния в газообразное называется испарением, потому что газообразное состояние воды называется паром.
Как жидкое состояние воды превращается в газообразное? Когда мы кипятим воду, она превращается из жидкости в газ, или водяной пар. Когда его часть остывает, мы видим небольшое облако, которое и называют паром. Хотя, если мы его видим, то это уже жидкое состояние воды, т.е. скопление ее микроскопических капелек.
Пар — это вода в газообразном состоянии, которое образуется, когда вода кипит или испаряется. Настоящий пар невидим; однако слово «пар» часто ошибочно относят к влажному пару, видимому туману, как аэрозолю водяных капель, образующихся при конденсации водяного пара.
И тут всплывает такое понятие, как «точка росы». Это температура воздуха, которая меняется в зависимости от давления и влажности, ниже которой водный пар начинает конденсироваться в водяные капли и образуется роса. Т.е. агрегатное состояние воды из газообразного состояния меняется на жидкое.
Закипает жидкая пресная вода при 100°C (градусах Цельсия) или 212°F (градусах Фарингейта), в условиях нормального атмосферного давления. Чем ниже давление (например, в горах), тем выше температура кипения.
Состояние газа
Итак, вода в газообразном состоянии – это пар. Утверждение, что большая часть воды в гидросфере находится в газообразном состоянии – не верно.
Не все хорошо себе представляют, в каком состоянии вода способна испаряться. Оказывается, вода в твердом состоянии испаряется так же, как и жидкая, только медленнее! Скорость испарения зависит от температуры. Т.е. в газообразное состояние вода может переходить прямо из твердого, минуя жидкое.
Испаренная с поверхности Земли вода в газообразном состоянии образует облака и тучи
Агрегатные состояния воды — переходные процессы
Процессы перехода воды с одного агрегатного состояния в другое определяются следующим образом:
Граничные точки перехода воды в состояния лед/вода и вода/пар определили соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст. или 101 325 Па. Всем с детства хорошо известна простая примета, температура за окном опустилась ниже нуля, ждите снега 🙂
Вода всегда вокруг нас
Водный баланс – это основа жизни на нашей планете. Большая её часть на Земле – это океаны и моря. В них сосредоточено 97% данного вещества. Остальные 3 % – это реки, озёра, пруды, подземные воды и парообразная вода в атмосфере. Растения и животные для обеспечения своей жизнедеятельности ежедневно потребляют живительную влагу.
Вода – это составляющая часть организма человека. Каждая наша клетка больше чем наполовину состоит из этой жидкости. Кровь, текущая в наших венах, – это на 82% вода. Мышцы и кожа содержат её 76%. Удивительно, но даже кости в своём составе имеют до 30% воды. Её наименьшее содержание в зубной эмали – всего 0,3%.
Общая масса воды на планете Земля – более 2 000 000 000 миллионов тонн.
Какие существуют 3 состояния воды в природе?
На вопрос «Что такое вода?» почти все без раздумий отвечают: «Это жидкость!». Ведь чаще всего мы привыкли видеть жидкое состояние воды в природе. Но на самом деле она может иметь разные формы, кардинально отличающиеся одна от другой.
Вода бывает в трёх состояниях:
Лёд – вода в твёрдом виде
Н2О из жидкого переходит в твёрдое агрегатное состояние при снижении температуры ниже 0 градусов по Цельсию. Интересно то, что почти все предметы при охлаждении уменьшаются в объёмах, а вода, наоборот, замерзая, расширяется. Если так она прозрачная и бесцветная, то при замерзании может приобретать белый цвет из-за попадания частичек воздуха внутрь льда.
Необычно, что при одной и той же кристаллической структуре лёд может иметь множество разнообразных форм. Твёрдое состояние воды в природе — это гигантские айсберги, блестящая корка льда на реке, белые хлопья снега, сосульки, висящие на крышах.
Лёд имеет огромное значение для хозяйственной деятельности человека и оказывает большое влияние на поддержание жизнедеятельности многих организмов. Например, при замерзании реки он выполняет защитную функцию, сохраняя водоём от дальнейшего промерзания, этим самым оберегая подводный мир.
Но также лёд может стать причиной разрушительных стихийных бедствий. Например, град, обледенение зданий и летательных аппаратов, промерзание почвы, ледяные обвалы.
В быту мы используем замёрзшую воду как хладагент, бросая небольшие кубики льда в напитки для их охлаждения. Подобным образом могут охлаждаться пищевые продукты и медицинские препараты.
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от древнегерманского «мокрый, текучий». В химии могут встречаться разные названия этого соединения. Самые распространенные – гидроксид водорода и окись водорода. Также в химической литературе ее называют:
Происхождение воды на планете
Возникновение воды на нашей планете является предметом научных споров. Существует 2 основные гипотезы:
Образование воды
Многих интересует, какая вода находится в реках, морях, под землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах. Из океанов она испаряется и поднимается, где образуются облака. После долгого путешествия она возвращается на землю в виде осадков. Вода собирается и возвращается через реки обратно в море. Часть просачивается в почву и попадает в грунтовые воды. Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые очень медленно, стекают к более низким высотам, где и тают. В полярных регионах этот механизм скольжения настолько медленный, что в ледниках можно найти воду, попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в природе вода.
Наука о воде
Изучением природных вод, явлений и процессов занимается наука Гидрология.
Первые упоминания о гидрологии появились на заре истории человечества около 6000 лет назад.
Начало гидрологических наблюдений в России относится к XV–XVI вв.: в записях русских летописцев сохранились сведения о свойствах воды, наводнениях, паводках, замерзании.
Значение на Земле
Каждая клетка живого организма состоит из жидкости и нуждается в регулярном пополнении. Без воды не проживут ни люди, ни растения, ни животные.
Вода формирует климат, участвует в круговороте воды в природе, для многих живых организмов является средой обитания.
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Органолептические свойства воды
Сюда относятся показатели, которые возможно определить органами чувств. К ним относятся вкус, запах, цвет (цветность), мутность (прозрачность или непрозрачность). Часть параметров определяется не только с помощью носа, глаз, языка, но и на аналитическом оборудовании. Например, мутность и цветность определяют используя фотометр, а прозрачность — цилиндр и градировочную шкалу.
Характеризует вкусовые ощущения от попадания жидкости на рецепторы языка. Оценивается в баллах. иногда добавляют описание вкуса, помогающее оценить пригодность для питья, содержание специфических химических веществ.
Оценивают вкус только питьевой воды, к которой относится бутилированная и водопроводная. Некоторые лаборатории определяют вкус только бутилированной при условии предоставления запечатанной тары (бутылки). Это обусловлено заботой о безопасности сотрудников. Представьте себя на месте химика-аналитика, который вынужден пробовать жидкость из неизвестного источника. Курьезные случаи: список параметров анализа «сточки» содержал вкус. Разумеется, никто не пробовал канализационные стоки, это опасно.
Запах
Оценивает ощущения от вдыхания пара, образующегося над сосудом, содержащим исследуемую жидкость, через нос. Запах выражают баллами, которые характеризуют интенсивность запаха, а также указывают его характер, например:
Выделяют специфические запахи химических соединений, например, хлора, сероводорода, фенола. По этой причине определение запаха предшествует определению других компонентов, помогает рассчитать коэффициент разбавления, скорректировать подготовку проб. Определять запах могут только сотрудники, прошедшие специальное обучение. Среди требований к помещению числится обеспечение отсутствия мешающих воздействий, включая цвет стен, а также отсутствие посторонних запахов.
Погрешность определению запаха добавляет использование неправильной тары для отбора. К ней относятся бутылки из-под газированных, ароматизированных напитков. Даже если тщательно вымыть такую тару запах все равно сохранится.
Цветность воды
Определяет изменение длины волны светового луча при прохождении через толщу раствора. Проще говоря, сосуд прямоугольной формы (длина большей стороны 1 или 5 сантиметров) заполняют исследуемым раствором, пропускают через него свет, изучают изменение этого света. Исследование проводят на оптическом приборе — фотометре или спектрофотометре. При проведении экспресс-анализа используют сравнение с стандартной шкалой. Это быстро, но не точно.
Чистая вода не имеет цвета, по крайне мере, его не видно, если толщина слоя менее метра. Цветность появляется если раствор содержит соединения, изменяющие окраску. К ним относятся органические вещества (гуминовые, органические красители), минеральные компоненты или их комплексы (большинство металлов образуют окрашенные соединения при взаимодействии с гидроксидом или анионами минеральных кислот). По величине цветности судят об общем содержании «цветных» соединений, отдельные группы не выделяют. Как правило, обращают внимание на специфическую окраску, которая помогает при проведении анализа. Например, ржавая говорит о высоком содержании железа, коричневая — признак гуминовых соединений, синие оттенки — выраженное химическое загрязнение.
Мутность
Показывает содержание едва заметных взвешенных частиц, которые снижают способность раствора пропускать свет. Это происходит за счет того, что взвесь отражает, рассеивает часть света, проходящего через слой жидкости. Мутность определяют экспресс-методом используя цилиндр с прозрачным дном и бумагу с нанесенным стандартным шрифтом. При таком определении параметр могут называть прозрачностью по шрифту. Мутность не выявляет конкретный компонент, то есть определить характер взвеси определяя только этот параметр невозможно. Он выявляет присутствие посторонних частиц, служит показанием к проведению дополнительных анализов или установке механического фильтра.