Чем отличаются минералы с кристаллическим и аморфным строением
Кристаллические и аморфные тела
В зависимости от физических свойств и молекулярной структуры выделяют два основных класса твердых тел – кристаллические и аморфные.
Аморфные тела обладают такой чертой, как изотропность. Это понятие означает, что они относительно независимы от оптических, механических и других физических свойств и направления, в котором на них воздействуют внешние силы.
Основная черта афморных тел – хаотичное расположение атомов и молекул, которые собираются лишь в небольшие локальные группы, не более чем по несколько частиц в каждой.
Это свойство сближает аморфные тела с жидкостями. К таким твердым телам относятся янтарь и другие твердые смолы, различные виды пластика и стекло. Под воздействием высоких температур аморфные тела размягчаются, однако для их перевода в жидкость необходимы сильные воздействия тепла.
Структура кристаллических тел
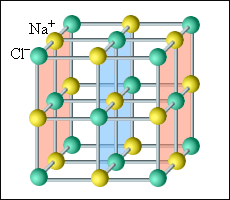
Все кристаллические тела имеют четкую внутреннюю структуру. Группы частиц в одном и том же порядке периодически повторяются во всем объеме такого тела. Чтобы наглядно представить такую структуру, обычно используют пространственные кристаллические решетки. Они состоят из определенного количества узлов, которые образуют центры молекул или атомов конкретного вещества. Обычно такая решетка построена из ионов, входящих в состав нужных молекул. Так, в поваренной соли внутренняя структура состоит из ионов натрия и хлора, попарно объединенных в молекулы. Подобные кристаллические тела называются ионными.
В структуре каждого вещества можно выделить одну минимальную составляющую – элементарную ячейку.
Вся решетка, из которой состоит кристаллическое тело, может быть составлена путем трансляции (параллельного переноса) такой ячейки в определенных направлениях.
Основные виды кристаллических решеток
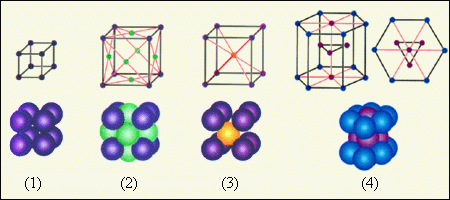
Число видов кристаллических решеток не бесконечно. Всего насчитывается 230 видов, большинство которых создано искусственным путем или найдено в природных материалах. Структурные решетки могут принимать формы объемно центрированных кубов (например, у железа), гранецентрированных кубов (у золота, меди), призмы с шестью гранями (магний, цинк).
В свою очередь кристаллические тела подразделяются на поликристаллы и монокристаллы. Большинство веществ относятся к поликристаллам, т.к. они состоят из так называемых кристаллитов. Это маленькие кристаллики, сросшиеся между собой и ориентированные хаотически. Монокристаллические вещества встречаются сравнительно редко, даже среди искусственных материалов.
Поликристаллы обладают свойством изотропности, то есть одинаковыми свойствами во всех направлениях.
Поликристаллическая структура тела хорошо видна под микроскопом, а у некоторых материалов, например, чугуна, и невооруженным взглядом.
Полиморфизм – это возможность вещества существовать в нескольких фазах, т.е. кристаллических модификациях, которые отличаются друг от друга физическими свойствами.
Процесс перехода в другую модификацию получил название полифморного перехода.
Примером такого явления может быть превращение графита в алмаз, который в промышленных условиях происходит при высоком давлении (до 100 000 атмосфер) и высоких температурах
(до 2000 К ).
Чтобы изучить структуру кристаллической решетки монокристалла или поликристаллического образца, используется дифракция рентгеновского излучения.
Простые кристаллические решетки показаны на рисунке ниже. Необходимо учитывать, что расстояние между частицами так мало, что сопоставимо с размерами самих этих частиц. Для наглядности на схемах показаны только положения центров.
Наиболее простой является кубическая решетка: такая структура состоит из кубов с частицами в вершинах. Гранецентрированная решетка имеет частицы не только в вершинах, но и на гранях. Например, кристаллическая решетка поваренной соли представляет собой две гранецентрированные решетки, вложенные друг в друга. Объемноцентрированная решетка имеет дополнительные частицы в центре каждого куба.
У решеток металлов есть одна важная черта. Ионы вещества удерживаются на своих местах благодаря взаимодействию с газом свободных электронов. Так называемый электронный газ образуется за счет одного или нескольких электронов, отдаваемых атомами. Такие свободные электроны могут перемещаться по всему объему кристалла.
Кристаллические и аморфные тела: строение и свойства
Существует несколько агрегатных состояний, в которых находятся все тела и вещества. Это:
Если рассматривать общую совокупность планеты и космоса, то большая часть веществ и тел все же находится в состоянии газа и плазмы. Однако на самой Земле существенно и содержание твердых частиц. Вот о них мы и поговорим, выяснив, чем являются кристаллические и аморфные твердые тела.
Кристаллические и аморфные тела: общее понятие
Все твердые вещества, тела, предметы условно подразделяются на:
Разница между ними огромная, ведь в основе подразделения лежат признаки строения и проявляемых свойств. Если говорить кратко, то твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (анизотропия).
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.
Свойства твердых тел
Кристаллические и аморфные тела тем не менее относятся к единой группе твердых, а значит, обладают всеми характеристиками данного агрегатного состояния. То есть общими свойствами для них будут следующие:
Таким образом, рассматриваемые нами состояния обладают всеми данными характеристиками. Только проявляться у аморфных тел они будут несколько иначе, нежели у кристаллических.
Строение кристаллов
Если описывать строение кристаллических и аморфных тел, то в первую очередь следует указать тип частиц, которые их слагают. В случае кристаллов это могут быть ионы, атомы, атом-ионы (в металлах), молекулы (редко).
Вообще данные структуры характеризуются наличием строго упорядоченной пространственной решетки, которая формируется в результате расположения образующих вещество частиц. Если представить строение кристалла образно, то получится примерно такая картина: атомы (или другие частицы) располагаются друг от друга на определенных расстояниях так, чтобы в результате получилась идеальная элементарная ячейка будущей кристаллической решетки. Затем данная ячейка многократно повторяется, и так складывается общая структура.
Главной особенностью является то, что физические свойства в подобных структурах изменяются в параллелях, но не во всех направлениях. Называется подобное явление анизотропией. То есть если воздействовать на одну часть кристалла, то вторая сторона может не реагировать на это. Так, можно измельчить половину кусочка поваренной соли, однако вторая останется целой.
Типы кристаллов
Если же монокристаллы повторяются многократно и соединяются в одно целое, тогда речь идет о поликристалле. Тогда речь об анизотропии не идет, так как ориентация элементарных ячеек нарушает общую упорядоченную структуру. В этом отношении поликристаллы и аморфные тела близки друг другу по проявляемым физическим свойствам.
Металлы и их сплавы
Кристаллические и аморфные тела очень близки друг другу. В этом легко убедиться, взяв в качестве примера металлы и их сплавы. Сами по себе они при обычных условиях твердые вещества. Однако при определенной температуре начинают плавиться и, пока не произойдет полная кристаллизация, будут оставаться в состоянии тянущейся, густой, вязкой массы. А это уже и есть аморфное состояние тела.
Поэтому, строго говоря, практически каждое кристаллическое вещество может при определенных условиях стать аморфным. Так же, как и последнее при кристаллизации становится твердым веществом с упорядоченной пространственной структурой.
Металлы могут иметь разные типы пространственных структур, самыми известными и изученными из которых являются следующие:
В основе структуры кристалла может лежать призма или пирамида, а ее главная часть представлена:
Идеальными свойствами изотропии обладает вещество, имеющее простую правильную кубическую решетку.
Понятие об аморфности
Кристаллические и аморфные тела внешне различить достаточно просто. Ведь последние часто можно перепутать с вязкими жидкостями. В основе структуры аморфного вещества также лежат ионы, атомы, молекулы. Однако они не образуют упорядоченной строгой структуры, а потому и свойства их изменяются во всех направлениях. То есть они изотропны.
Частицы располагаются хаотично, беспорядочно. Лишь иногда они могут образовывать небольшие локусы, что все равно не влияет на общие проявляемые свойства.
Свойства подобных тел
Они идентичны таковым у кристаллов. Различия лишь в показателях для каждого конкретного тела. Так, например, можно выделить такие характеристические параметры аморфных тел:
Часто можно встретить граничные состояния соединений. Кристаллические и аморфные тела могут переходить в состояние полуаморфности.
Также интересна та черта рассматриваемого состояния, которая проявляется при резком внешнем воздействии. Так, если аморфное тело подвергнуть резкому удару или деформации, то оно способно повести себя как поликристалл и расколоться на мелкие кусочки. Однако если дать этим частям время, то вскоре они снова соединятся вместе и перейдут в вязкое текучее состояние.
У данного состояния соединений нет определенной температуры, при которой происходит фазовый переход. Этот процесс сильно растянут, иногда даже на десятки лет (например, разложение полиэтилена низкого давления).
Примеры аморфных веществ
Можно привести много примеров подобных веществ. Обозначим несколько самых наглядных и часто встречаемых.
Аморфное тело образуется в результате очень медленной кристаллизации, то есть повышения вязкости раствора при понижении значения температуры. Часто сложно назвать подобные вещества твердыми, их относят скорее к вязким густым жидкостям.
Стеклообразные вещества
Свойства кристаллических и аморфных тел схожи, как мы выяснили, вследствие общего происхождения и единой внутренней природы. Но иногда от них отдельно рассматривают особое состояние веществ, именуемое стеклообразным. Это гомогенный минеральный раствор, который кристаллизуется и затвердевает без формирования пространственных решеток. То есть остается изотропным по изменению свойств всегда.
Так, например, обычное оконное стекло не имеет точного значения температуры плавления. Оно просто при повышении данного показателя медленно плавится, размягчается и переходит в жидкое состояние. Если же воздействие прекратить, то пойдет обратный процесс и начнется затвердевание, но без кристаллизации.
Кристаллические и аморфные тела

Всего получено оценок: 159.
Всего получено оценок: 159.
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.
Твердые тела
Все твердые тела обладают следующими общими свойствами:
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

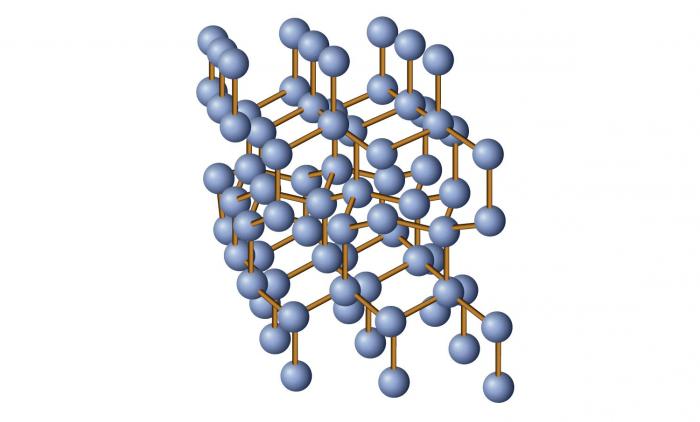
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Отличие кристаллических и аморфных тел: сравнение свойств
Каждый школьник знает, что любое вещество на планете может существовать в одном из четырех агрегатных состояний. Большой интерес в физике представляют собой твердые тела. По своей структуре их разделяют на два основных класса: кристаллические и аморфные. Отличием тел друг от друга занимается специальный раздел физики конденсированного состояния.
Твердое вещество
В термодинамике существует понятие об энергии Гиббса, минимум которой является достаточным критерием для существования определенной фазы в конкретно заданных условиях. Основные параметры окружающей среды, от которых зависит энергия Гиббса, это температура и давление.
По мере увеличения температуры и уменьшения давления можно наблюдать следующую последовательность переходов между агрегатными состояниями одного и того же с точки зрения химии вещества:
Таким образом, твердое вещество является энергетически стабильным при низких температурах и высоких давлениях, причем обе величины оказывают независимый вклад в функцию энергии Гиббса.
В отличие от других агрегатных состояний твердое характеризуется следующими особенностями, которые присущи только ему:
Примерами являются деревянная палка, кусок металла, стекло, золотое украшение, пластиковый корпус компьютера и так далее. Все эти предметы способны длительное время сохранять свою форму и не изменять объем.
Характеристика кристаллических и аморфных тел
Чтобы ясно понять, чем отличаются аморфные вещества от кристаллических, необходимо с каждым из этих классов познакомиться отдельно. Отличить один вид от другого часто только по внешним признакам не удается, поскольку оба имеют признаки твердого соединения. Многие люди иногда путают их между собой. Например, красивые стеклянные фрески ошибочно воспринимают кристаллами, а сосульки на крышах домов считают неверно аморфными соединениями.
Основное отличие между двумя классами веществ заключается в особенностях их внутреннего строения, в основе которого лежит пространственное расположение структурных единиц (атомов, молекул).
Упорядоченное строение
Кристаллы являются достаточно обширным классом веществ. Для них характерна строгая периодичность в пространстве составляющих их структурных единиц. Последние носят название элементарных ячеек.
Наука, которая занимается изучением этого подвида твердых тел, называется кристаллографией. В ней для описания геометрических свойств монокристаллов вводят координатные оси. В большинстве случаев используют декартову прямоугольную систему координат, с которой удобно работать на практике. Если взять определенную группу атомов или молекул и перемещать ее на элементарные векторы вдоль каждой из трех взаимно перпендикулярных осей, то получится весь объем кристалла. Используемая при этом группа атомов называется элементарной ячейкой.
Поскольку периодичность в кристаллах может отличаться величинами элементарных векторов трансляции и характером расположения атомов в выбранной для перемещения группе, то в кристаллографии вводят несколько сингоний (кристаллических систем имеющих определенную пространственную группу симметрии). Их 6, и следует их расположить в таком порядке:
Чем больше номер сингонии, тем более высокой симметрией обладают ее кристаллы. Так, кубическая — это самая симметричная система. Ей обладают большинство металлов. Например, медь, серебро, золото и алюминий имеют гексагональную гранецентрированную кубическую решетку (ГЦК). В свою очередь, железо, вольфрам, ниобий, молибден, ванадий — это представители объемноцентрированной кубической решетки (ОЦК). Некоторые металлы характеризуются гексагональной сингонией (ГПУ), например, кобальт, титан и цирконий.
Аллотропные модификации
Необходимо вспомнить о существовании так называемых аллотропных модификациях. Они представляют собой разное кристаллическое строение одного и того же по своему химическому составу вещества.
Здесь будет наглядным привести пример железа при атмосферном давлении. Когда температура окружающей среды меньше 911 градусов по Цельсию, то его стабильной является решетка ОЦК. Как только температура становится выше, происходит перестройка структуры в более выгодное энергетическое состояние. Выше 911 градусов железо имеет решетку ГЦК. В промежутке температур 1392−1539 градусов по Цельсию снова образуются кристаллы ОЦК.
Другим примером является олово. Оно бывает двух аллотропных модификаций: белое и серое. Первая из них представляет собой высокотемпературную (выше 13 градусов) и обладает высокой пластичностью, свойственной любому металлу. Серое же олово существует в стабильном состоянии при температурах ниже 13 градусов и характеризуется высокой хрупкостью. Именно поэтому не следует использовать оловянную посуду при низких температурах, поскольку она просто-напросто превратится в пыль.
Анизотропия свойств
В какой бы аллотропной форме ни находилось кристаллическое вещество, оно всегда характеризуется анизотропией физических свойств. Причина этого — все то же упорядоченное строение. Например, поваренная соль при попадании в воду растворяется строго по определенным плоскостям, которые являются наиболее плотноупакованными. Другой пример — кристалл турмалина, в зависимости от того, в каком направлении относительно него падает луч света, он может проявлять или не проявлять свойства двойного лучепреломления.
Уникальным свойством многих кристаллов, подтверждающим их анизотропный характер, является отнесение многих из них к классу пьезо- или пироэлектриков. Так, механическая деформация в определенном направлении или локальный нагрев приводят к появлению разности потенциалов между двумя точками кристалла.
Весьма наглядным примером является также графит. Для него характерно наличие плотноупакованных гексагонов, которые соединены друг с другом слабыми пи-связями. Даже небольшое механическое усилие, направленное перпендикулярно этим связям, приводит к расслоению графита.
Отсутствие дальнего порядка
Аморфные вещества — это твердые тела, которые не обладают характерным для кристаллов дальним порядком. Иными словами, в них нельзя выбрать элементарную ячейку и оси трансляции таким образом, чтобы с помощью ее переноса на определенные вектора получить весь объем.
Детальное изучение амфотерных соединений и их сравнение с кристаллами привело ученых к выводу, что они все же обладают так называемым ближним порядком (сходство с кристаллическим состоянием). Этот факт можно объяснить тем, что каждый атом или молекула обладает способностью образовать определенное количество связей (ковалентных, диполь-дипольных, ионных, водородных и другие) до их насыщения. Кроме того, само пространство вокруг частицы является ограниченным, и в случае плотной упаковки в нем может расположиться лишь определенное количество атомов или молекул.
Практически любое твердое тело можно получить в аморфном виде. Для этого необходимо его расплав или газовую фазу охладить с высокой скоростью. В случае металлов она должна достигать миллионов градусов в секунду. Полученные в таких условиях аморфные ленты обладают рядом уникальных характеристик. Если сравнить их с аналогичными свойствами для кристаллов, то можно выделить следующее:
Аморф — это хаос в расположении составляющих его частиц, поэтому не идет никакой речи об аллотропных модификациях или анизотропии свойств в таких веществах. Также для них нет четкой температуры плавления, поскольку это твердое тело напоминает собой застывшую жидкость. Если его нагревать, то оно плавно будет уменьшать свою вязкость. Примером может служить любой пластик. Его нагрев приводит к постепенному появлению мягкости и тягучести.
Причина отличия свойств
Из описания характеристик кристаллов и аморфных веществ следует, что они различаются практически во всем, кроме того факта, что оба относятся к твердому агрегатному состоянию. Тем не менее у всех этих физических различий имеется лишь одна-единственная причина — пространственная структура на микроскопическом уровне.
Если наблюдается дальний порядок и периодичность в расположении элементарных структурных единиц, то вещество является кристаллом и для него характерны анизотропия, полиморфизм, четкий переход в жидкое состояние. Если же дальнего порядка в расположении частиц нет, а существует только их ближнее упорядочивание, то можно говорить, что его свойства по всем направлениям одинаковы, отсутствует полиморфизм и температурная точка плавления.
Различие характеристик кристаллов и аморфных веществ позволяет человеку значительно изменять свойства твердых тел с использованием только физических методов воздействия, что открывает широкие возможности для применения их для нужд жизнедеятельности. Изменение химического состава вещества может создавать условия для его кристаллизации или аморфизации.
Чем отличаются аморфные вещества от кристаллических
В физике и химии существует такое понятие как твердые тела. Основными свойствами твердых тел являются возможности сохранения объема и формы. По типу внутреннего строения они делятся на кристаллические и аморфные. К первым относятся поваренная соль, металлы, сахар, графит, минералы и т.д., ко вторым – стекло, смолы, пластмассы, воск и т.д. Чем же отличаются аморфные вещества от кристаллических?
Кристаллическое строение отличается упорядоченностью и значительным расстоянием между частицами. Вещества, атомы и молекулы которых расположены более хаотично и на близком расстоянии, называются аморфными. По своему строению они близки к жидкостям.
Существует способ визуального определения кристаллических и аморфных тел: на изломе кристаллы имеют плоские грани и ступенчатую поверхность, в то время как аморфные тела образуют поверхность неправильной формы.
Аморфное состояние веществ считается неустойчивым. Многие такие тела со временем могут стать кристаллами. К примеру, расплавленный сахар при застывании приобретает твердое состояние. И наоборот, некоторые тела с кристаллическим строением при нагревании пребывают в аморфном состоянии.
а) кристаллическое вещество б) аморфное вещество
Вещества с аморфным строением имеют одинаковые свойства по различным направлениям межмолекулярных связей. Это свойство называется изотропией. То есть при повышении температуры такие тела получают «текучесть». Однако, в отличие от кристаллических тел, аморфные вещества не имеют фиксированной температуры плавления.
Атомы и молекулы, образующие кристаллическое тело, располагаются в виде разнообразных пространственных решеток, напоминающих геометрические формы. К примеру, монокристалл поваренной соли выглядит как куб, а алмаза – как правильный шестигранник. В естественных природных условиях монокристаллы встречаются редко. Как правило, большинство кристаллических тел состоит из малых, беспорядочно сросшихся между собой, монокристаллов. Такое тело получило название поликристалл.
Монокристаллы зависят от направления ориентации кристаллических граней. Данное свойство называется анизотропией. Поликристаллы же изотропны по своим свойствам, что обусловлено хаотичностью ориентации монокристаллов, из которых они состоят.
Выводы:
Ресурсы:
Габриелян О.С., Лысова Г.Г. «Химия 11 класс»