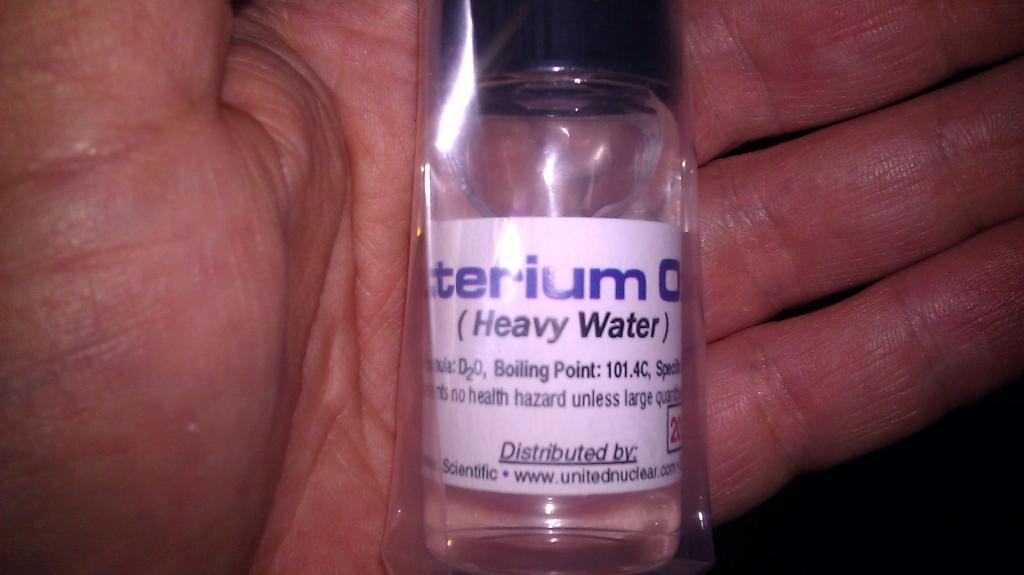
Чем отличаются изотопы водорода
Изотопы водорода
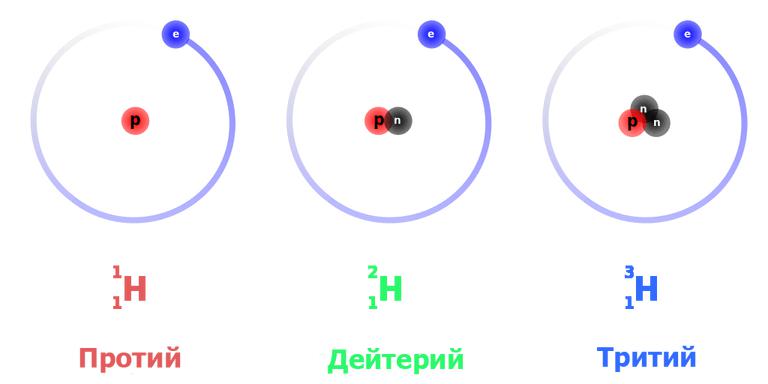
Известно несколько изотопов водорода: дейтерий ( 2 H) с одним протоном и одним нейтроном в ядре, тритий ( 3 H) с одним протоном и двумя нейтронами в ядре и очень неустойчивые тяжелые изотопы 4 H, 5 H, 6 H и 7 H. Ядра протия и дейтерия стабильны, а ядра трития подвергаются бета-распаду:
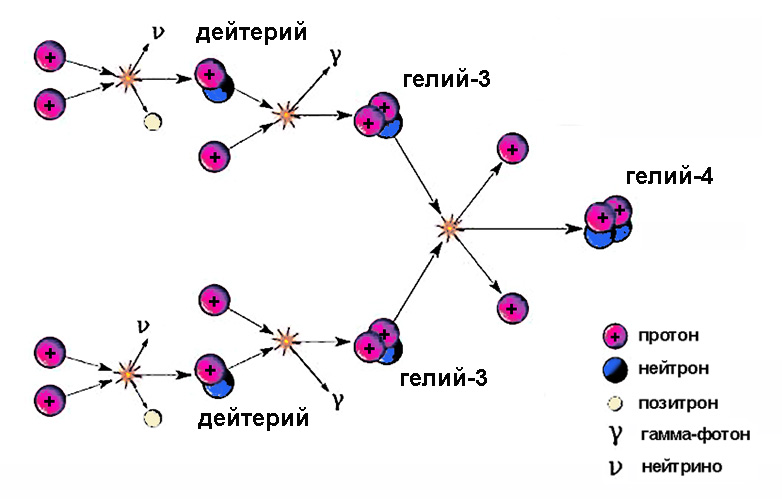
Предполагают, что эта реакция является главным источником изотопа гелия-3 в атмосфере.
Время жизни атомов остальных изотопов составляет ничтожные доли секунды.
Таблица изотопов водорода:
Содержание изотопов водорода в природе:
Массовая доля (в %) в природной смеси:
1 H – 99,9849 2 H – 0,0139 3 H – 0,0012
Нормальный изотопный состав природных соединений водорода соответствует отношению D : H=1 : 6800
3·10-18 % (мольные доли). Очевидно, он образуется в результате ядерных реакций, вызванных действием космических лучей.
Получение изотопов водорода
В настоящее время дейтерий получают ректификацией жидкого водорода и пот так называемому двухтемпературному сероводородному методу, в основе которого лежит реакция изотопного обмена:
Константа равновесия которой при 30 и 120 °C равна соответственно 2,31 и 1,86.
Тритий синтезируют, действуя на 6 Li3 нейтронами, получаемыми в ядерном реакторе:
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, несмотря на одинаковую электронную структуру, все изотопы заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому можно считать, что свойства природного водорода соответствуют свойствам чистого протия.
Небольшие различия свойств, называемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний атомов в молекулах и твердых телах. Так, колебательная энергия молекул T2 и D2 меньше, чем H2. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D2 по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность, а, следовательно, неравноценность активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза HBr и DBr равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в периодической системе. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
| Eдис(H2) = 436 кДж/моль | dH-H = 0,07414 нм |
| Eдис(D2) = 439,56 кДж/моль | dD-D = 0,07417 нм |
| t°пл(D2O) = 3,82 °C | t°кип(D2O) = 101,42 °C | ρ = 1,1050 г/см 3 (20 °C) |
Заметно с H2O различаются также энтальпия растворения солей, константы диссоциации кислот и другие характеристики растворов. Реакции в D2O идут медленнее, поэтому она является биологическим ядом.
Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×10 29 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1 H1 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.
В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2 H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.
Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3 H1. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.
Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
Водород и всё-всё-всё – ч. H-2: нуклиды (изотопы и изодиаферы)
Это вторая статья из цикла «Водород и всё-всё-всё».
В ней мы рассмотрим понятие «нуклид» и связанные с ним термины.
Краткий план статьи:
1. Нуклид – ядро или атом?
8. Таблицы нуклидов.
9. Таблицы изотопов.
По ходу статьи я буду сильно углубляться в детали. Начнём с простого вопроса: «Что такое нуклид?» Как вообще узнать определение научного термина? Википедия – хороший вариант, но в данном случае мы можем обратиться к первоисточнику: IUPAC Gold Book.
IUPAC (читается /aɪjuːpæk/, ай-ю-пэк), он же International Union of Pure and Applied Chemistry, он же Международный союз теоретической и прикладной химии, он же ИЮПАК – международная федерация химиков, образована в 1919 году, штаб-квартира расположена в Цюрихе, административный офис – в парке «Исследовательского треугольника» (Research Triangle Park) в Северной Каролине, официальный язык – английский(!). Последний пункт важен, т.к. вся документация ИЮПАК ведётся только на английском и на другие языки самой организацией не переводится. Это приводит к некоторым последствиям. В частности, элемент теннессин (₁₁₇Ts) имеет только одно официально утверждённое название: Tennessine – и каждый национальный комитет волен выбрать свой вариант, соответствующий традициям языка. Так, испанцы выбрали teneso, французы – tennesse, немцы – tenness, русские оставили теннессин, а общепринятого латинского названия у элемента просто нет.
Далее, ИЮПАК публикует «цветные книги», содержащие определения из различных областей химии. Gold Book (названная так в честь инициатора – Виктора Гоулда – и имеющая золотистую обложку) является основным справочником по химической терминологии.
Нуклид определяется в Gold Book как
«а species of atom, characterized by its
(1) mass number,
(2) atomic number and
(3) nuclear energy state,
provided that the mean life in that state is long enough to be observable«
«вид атомов, характеризующийся определённым
(1) массовым числом,
(2) атомным номером и
(3) энергетическим состоянием ядер
и имеющий время жизни, достаточное для наблюдения«
Иногда в определении нуклида выражение «а species of atom» неформально читают как «atomic species» – и здесь роль языка становится важной, т.к. слово «species» не имеет точного аналога в русском языке, и указанные выражения можно понимать и как «определённый вид атомов», и как «атомоподобные частицы» (т.е. и атомы, и ионы, и ядра). Первый вариант буквально соответствует определению ИЮПАК, второй применяется на практике в различных контекстах.
Термин «нуклид» предложил в 1947 году Трумэн Коман.
Само слово nuclide образовано от лат. nucleus (сердцевина, ядро) и греч. είδος (сорт, вид) и по задумке Комана было призвано навести порядок в терминологии и заменить такие выражения как «вид атомов», «вид ядер», «изотоп» (с которым до сих пор смешивается) и др. Из оригинальной статьи Комана следует, что он, по-видимому, имел в виду любые частицы, имеющие одинаковый состав и структуру ядра – то есть расширенное определение нуклида.
Здесь можно взять небольшую паузу и обсудить в комментариях первые два пункта, а в продолжении статьи мы рассмотрим:
Чем нуклид отличается от изотопа и почему их до сих пор путают.
Кто, для чего и как придумал слово изотон (и при чём здесь Канье Уэст).
Что общего у изобара, бариона, бария, барометра и барокамеры.
Изотопическое число и изодиаферы – привет из далёкого прошлого.
Зеркальные ядра – выживет только самый лёгкий.
Изомеры – это не только органика.
Как в уме быстро посчитать атомную массу элемента (лайфхак).
Почему массовое число обозначается буквой A, а атомный номер – буквой Z.
Ссылки для тех, кто хочет во всём убедиться сам:
Наука | Научпоп
6.1K постов 69.1K подписчиков
Правила сообщества
ВНИМАНИЕ! В связи с новой волной пандемии и шумом вокруг вакцинации агрессивные антивакцинаторы банятся без предупреждения, а их особенно мракобесные комментарии — скрываются.
Основные условия публикации
— Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и содержать ссылки на авторитетный источник.
— Посты должны по возможности избегать кликбейта и броских фраз, вводящих в заблуждение.
— Научные статьи должны сопровождаться описанием исследования, доступным на популярном уровне. Слишком профессиональный материал может быть отклонён.
— Видеоматериалы должны иметь описание.
— Названия должны отражать суть исследования.
— Если пост содержит материал, оригинал которого написан или снят на иностранном языке, русская версия должна содержать все основные положения.
Не принимаются к публикации
— Точные или урезанные копии журнальных и газетных статей. Посты о последних достижениях науки должны содержать ваш разъясняющий комментарий или представлять обзоры нескольких статей.
— Юмористические посты, представляющие также точные и урезанные копии из популярных источников, цитаты сборников. Научный юмор приветствуется, но должен публиковаться большими порциями, а не набивать рейтинг единичными цитатами огромного сборника.
— Посты с вопросами околонаучного, но базового уровня, просьбы о помощи в решении задач и проведении исследований отправляются в общую ленту. По возможности модерация сообщества даст свой ответ.
— Оскорбления, выраженные лично пользователю или категории пользователей.
— Попытки использовать сообщество для рекламы.
— Многократные попытки публикации материалов, не удовлетворяющих правилам.
— Нарушение правил сайта в целом.
Окончательное решение по соответствию поста или комментария правилам принимается модерацией сообщества. Просьбы о разбане и жалобы на модерацию принимает администратор сообщества. Жалобы на администратора принимает @SupportComunity и общество пикабу.
Я одного понять не могу. Ты готовишь тут площадку для продвижения своей «теории»? Или как?
Один сказал сначала, что чёрная дыра не имеет волос! Не имеет, понимаешь.. А другой вообще сказал, что если мы сядем в космический корабль и будем свободно падать, то мы попадём в сингулярность и не почувствуем никакого горизонта событий! Представляешь? Вот наркоманы-то где!
многа умных букоф. ничё не понял, но интересно до жути!
Цвет газов под импульсным полем мини-катушки Тесла
Слева направо. Водород, Гелий, Неон, Аргон, Криптон, Ксенон и Азот.
Эмиссионный спектр газов. Газы подвергаются высокочастотному импульсному полю мини-катушки Тесла. Цвет каждого газа обусловлен смешением цветов, испускаемых при электронных энергетических переходах, специфичных для каждого элемента. (Перевод Гугл)
Почему гелий меняет наш голос, а также что такое инертные газы
На уроках химии мы слышали об инертных газах. Их еще называют благородными, такое красивое название было дано не с проста, ведь все инертные газы, а именно гелий, неон, аргон, криптон, ксенон, а также радиоактивные радон и оганесон обладают очень низкой химической активностью, их соединения с другими веществами существуют лишь в специальных, экстремальных условиях, а значит, эти газы не горят и не поддерживают горение, более того, не имея цвета, запаха и вкуса они не токсичны для человека, их вообще как будто нет, настоящее благородство!)
Но это не совсем так, инертные газы хоть и не отравляют человека, но наркотически действуют на него, однако это не относится к гелию и неону, поскольку их наркотический эффект проявляется при очень повышенном давлении, впрочем, поэтому наркоманы и не дышат шариками с гелием.
Интересным фактом является то, что инертные газы переходят в жидкое состояние при экстремально низких температурах, при этом почти сразу после переходя в твердое состояние. Таким образом разница между температурой кипения и плавления у веществ состовляющих инертные газы 2-5, максимум 10 градусов.
Вообще гелий удивителен. Во Вселенной он второй по распространенности после водорода, но на Земле существует в совсем малых количествах, однако не беспокойтесь, на надувание шариков всем хватит). Из за практически самого малого размера атомов гелия, они почти не сталкиваются друг с другом, когда гелий находится в газообразном состоянии, что делает гелий идеальным газом (идеальный газ это такая теоретическая модель, можете посмотреть о ней в Википедии подробнее).
Еще одна занимательная вещь, что гелий, как и все инертные газы светится при пропускании через него электрического тока. Причем при изменении давления внутри газа, можно менять его цвет. Это связанно с тем, что с увеличением давления, электроны начинают чаще сталкиваться с атомами гелия и общая энергия вещества увеличивается, приводя к изменению цвета. Так гелий может светиться желтым, розовым, оранжевым и зеленым цветами.
Но мы то все знает гелий как веселый газ, смешно изменяющий наш голос. Почему так происходит? Тут нужно разобраться, что вообще такое звук, издаваемый нами при выдохе.
По простому звук есть колебание молекул или других мельчайших частиц среды, улавливаемое нашим ухом. Такой средой является воздух. Когда мы издаем какие либо звуки, наши голосовые связки вибрируют, создавая колебания среды, то есть воздуха. Чем чаще колеблятся связки, тем выше высота звука. Если мы вдохнем вместо воздуха гелий, он станет средой для распространения звука. Но из за гораздо меньшей плотности гелия, он создает меньшее давление на голосовые связки, чем воздух, позволяя им вибрировать быстрее и издавать более тонкий звук.
Так, для понижения голоса можно вдохнуть плотный газ, например фторид серы, он в 5 раз тяжелее воздуха и сильно понижает частоту колебаний голосовых связок, позволяя Вам говорить как Халк:).
О ЯДОВИТОЙ ЛАПШЕ НА УШИ
Пришла пора опубликовать здесь свою заметку, писанную в 2010 году или раньше. Потому что актуальности она не утратила.
Илья Ильф при полной поддержке Евгения Петрова не церемонился со скудоумными соотечественниками. Достаточно вспомнить Эллочку Щукину, которую он сравнивал по уровню развития с людоедами племени мумбо-юмбо, или её подругу Фиму Собак, знавшую богатое слово гомосексуализм. Была в записных книжках Ильфа и шутка про человека такого некультурного, что бактерия ему снилась в виде большой собаки.
Это я к тому, что на днях многочисленные интернет-леди сделали перепост одного и того же текста с проникновенным заголовком «Для всех, кто дорожит здоровьем близких. ».
Привожу его полностью, с авторской орфографией и пунктуацией.
1. Никакой пластиковой посуды в микроволновых печках.
2. Никаких пластиковых бутылок с водой в морозильных камерах.
3. Никаких пластиковых упаковок в микроволновых печах.
Эта информация была опубликована в газете, выпускаемой больницей им. Джона Хопкинса (Johns Hopkins Hospital), а также распространена Медицинским центром Walter Reed Army.
Диоксин вызывает раковые заболевания, особенно рак груди.
Диоксин является высоко ядовитым веществом для клеток человеческого организма.
Не замораживайте пластиковые бутылки с водой, так как это приводит к освобождению дииоксина, входящего в состав пластика.
Особое внимание следует уделить недопустимости использования пластиковой посуды для нагревания пищи в микроволновках. Особо это касается жирной пищи. Сочетание жира, высокой температуры и пластика вызывает освобождение диоксина и его проникновения в пищу, а, соответственно, в конечном счете, в клетки человеческого организма.
Вместо пластика, медики рекомендуют для подогрева пищи использовать стеклянную или керамическую посуду. Результат будет тот же, но без диоксина в пище!
Поэтому продукты быстрого приготовления, такие как растворимые супы, каши и т.д. вначале необходимо переложить из пластиковой упаковки в стеклянную посуду, а затем лишь ставить в микроволновку или любую другую печь.
Также недопустимо использование пластиковых крышек, покрытий во время приготовления пищи в микроволновой печи. Это также опасно, как и использовать пластиковую посуду. Высокая температура приводит к тому, что диоксин практически «растаивает и стекает» с такой крышки в пищу. Намного безопаснее использовать бумажные салфетки.
Конец пространной цитаты…
…которая представляет собой классический образец белиберды, рассчитанной на впечатлительного идиота – или идиотку, да простят меня дамы. Потому что образ диоксина, «освободившегося» из пищевой посуды благодаря «сочетанию жира, высокой температуры и пластика», или диоксина, который «растаивает и стекает» в пищу – это штука посильнее «Фауста» Гёте, как сказал бы один Отец Народов. И очень напоминает ту самую бактерию в виде большой собаки.
Фрэнк Заппа язвил: современная журналистика – это когда тот, кто не умеет писать, берёт интервью у того, кто не умеет говорить, для того, кто не умеет читать. Я бы добавил, что зачастую разговор идёт на тему, в которой ни бельмеса не смыслят все трое.
Пожалуй, в процитированной статейке верно лишь одно: диоксины (их много разных) действительно представляют смертельную опасность. Кроме рака, они вызывают многие болезни, а ядовиты примерно в тысячу раз сильнее, чем боевые отравляющие вещества.
Но вот незадача: в состав любого диоксина входит хлор. Которого нет и быть не может в полиэтилене, состоящем только из углерода с водородом – это проходят в средней школе.
Хлор есть в ПВХ – поливинилхлориде, из которого не посуду делают, а лепят, например, дешёвую напольную плитку. Если такую плитку сжигать (не нагревать в микроволновке, а именно сжигать!), в самом деле можно получить диоксин. И если отбеливать хлором целлюлозную пульпу – тоже. И если производить гербициды хлорфенольного ряда… Но какое, интересно, отношение это имеет к кулинарии?
Есть соблазн поглумиться над каждой строчкой безграмотных авторов, у которых одинаково плохо и с русским языком, и с физикой-химией. Им для начала не худо бы усвоить, что термическая деформация – это физический процесс, а горение – химический. При окислении появляются новые вещества, а при плавлении – нет.
Есть соблазн, и всё же я не стану тратить время. Ограничусь предложением «для всех, кто дорожит здоровьем близких»: если выуживаете в сети заметки на жизненно важную тему – не почтите за труд освежить в памяти школьную программу, наведите пару справок, ведь интернет как раз под рукой!
И не спешите верить всему, что публикуют доброхоты-двоечники. Особенно если они пугают вас подслушанным где-то непонятным словечком диоксин и ссылаются на американскую клинику имени Хопкинса. Очень может быть, что это как раз пациенты клиники резвятся в отсутствие санитаров.