Чем отличаются атомы изотопов одного элемента а числом протонов
Разница между изотопами одного элемента
Установлено, что каждый химический элемент, находящийся в природе – это смесь изотопов (отсюда у них дробные атомные массы). Чтобы понять, чем отличаются изотопы один от другого, необходимо детально рассмотреть строение атома. Атом образует ядро и электронное облако. На массу атома влияют электроны, движущиеся с ошеломительной скоростью по орбиталям в электронном облаке, нейтроны и протоны, входящие в состав ядра.
Определение
Изотопы – это разновидность атомов какого-либо химического элемента. Электронов и протонов в любом атоме всегда равное количество. Поскольку они обладают противоположными зарядами (электроны – отрицательным, а протоны – положительным), атом всегда нейтрален (эта элементарная частица не несет заряда, он равен у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо отрицательным, либо положительным ионом.
Нейтроны не имеют заряда, зато их количество в атомном ядре одного и того же элемента может быть разным. Это никак не сказывается на нейтральности атома, однако влияет на его массу и свойства. Например, в любом изотопе атома водорода есть по одному электрону и протону. А количество нейтронов разное. В протии имеется всего лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа заметно отличаются друг от друга по свойствам.
Сравнение
В них разное количество нейтронов, неодинаковая масса и различные свойства. Изотопы обладают идентичным строением электронных оболочек. Это значит, что они довольно близки по химическим свойствам. Поэтому им отведено в периодической системе одно место.
В природе обнаружены изотопы стабильные и радиоактивные (нестабильные). Ядра атомов радиоактивных изотопов способны самопроизвольно превращаться в другие ядра. В процессе радиоактивного распада они испускают различные частицы.
Большинство элементов имеет свыше двух десятков радиоактивных изотопов. К тому же радиоактивные изотопы искусственно синтезированы абсолютно для всех элементов. В естественной смеси изотопов их содержание незначительно колеблется.
Существование изотопов позволило понять, почему в отдельных случаях элементы с меньшей атомной массой обладают большим порядковым номером, чем элементы с большей атомной массой. Например, в паре аргон-калий аргон включает тяжелые изотопы, а калий – легкие изотопы. Поэтому масса аргона больше, чем калия.
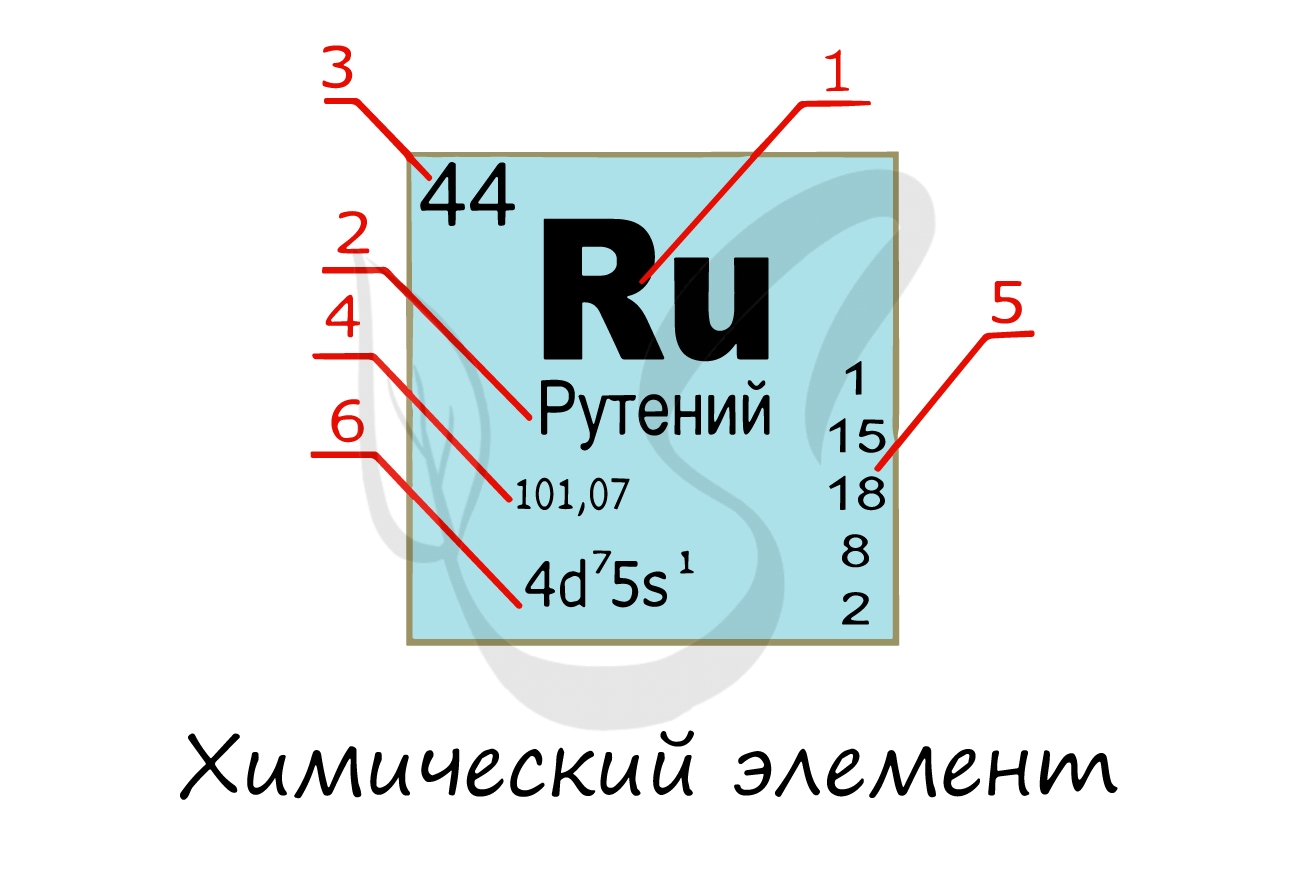
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
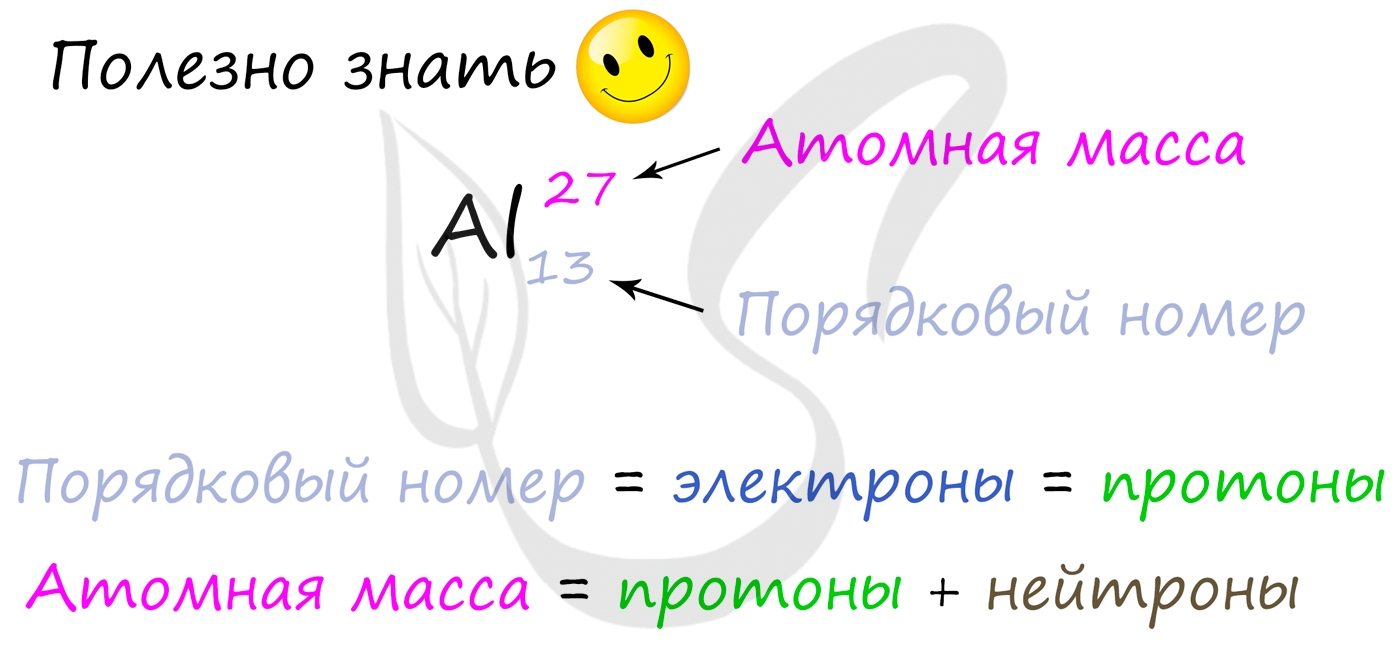
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
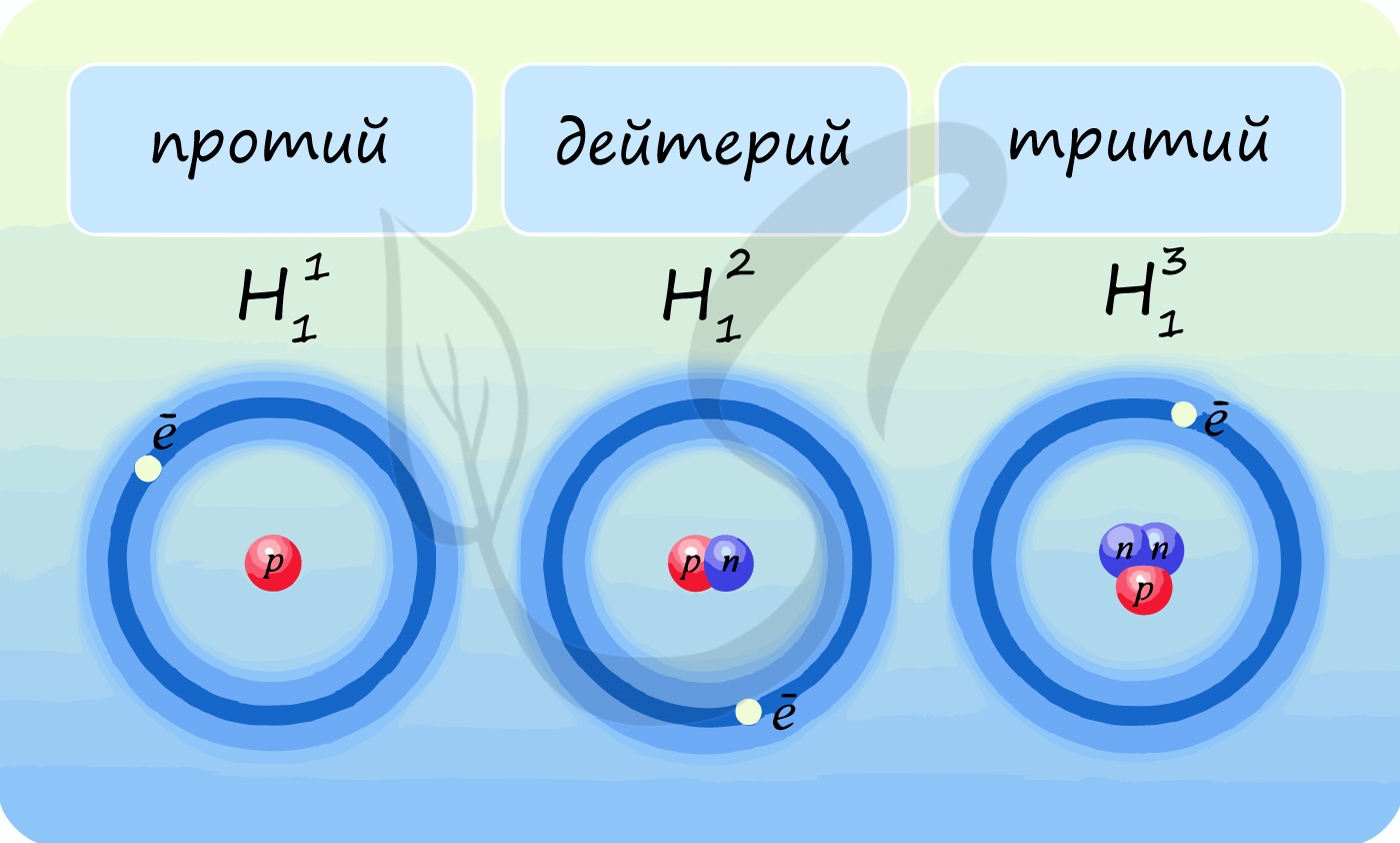
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
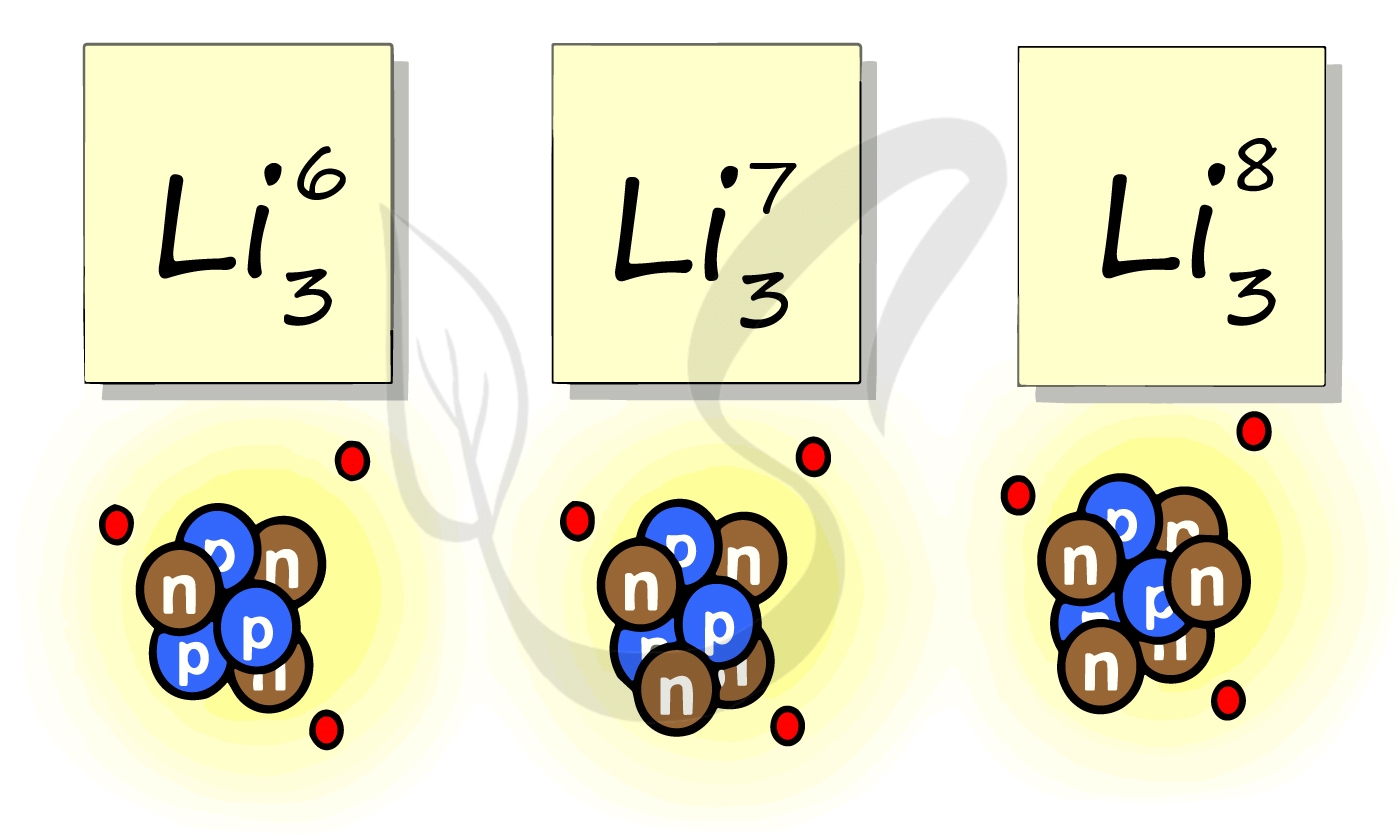
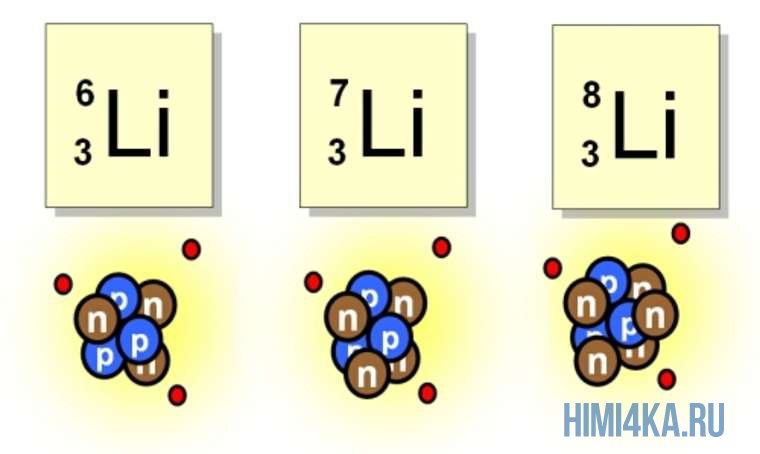
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Чем отличаются изотопы одного элемента друг от друга
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Методы разделения изотопов
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Определение
Изотопы – это разновидность атомов какого-либо химического элемента. Электронов и протонов в любом атоме всегда равное количество. Поскольку они обладают противоположными зарядами (электроны – отрицательным, а протоны – положительным), атом всегда нейтрален (эта элементарная частица не несет заряда, он равен у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо отрицательным, либо положительным ионом.
Нейтроны не имеют заряда, зато их количество в атомном ядре одного и того же элемента может быть разным. Это никак не сказывается на нейтральности атома, однако влияет на его массу и свойства. Например, в любом изотопе атома водорода есть по одному электрону и протону. А количество нейтронов разное. В протии имеется всего лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа заметно отличаются друг от друга по свойствам.
Особенности изотопов
Различные изотопы элементов отличаются количеством нейтронов в ядре.
Сейчас известно, что некоторые элементы (водород, бор, кадмий и т.д.) имеют свойство захватывать нейтроны и образовывать изотопы. Например, легкий водород (11Н), захватывая один нейтрон, образует тяжелый водород – дейтерий (21D), а когда захватывает еще один нейтрон – тритий (31Т).
Изотопы водорода и гелия имеют важное значение в физических исследованиях ядра. В оболочке атома водорода только один электрон, атома гелия – два электрона. Поэтому их можно сравнительно легко «сорвать», получив ядра этих элементов. Тяжелые изотопы водорода играют существенную роль в осуществлении ядерных реакций синтеза и деления. Следует отметить, что хотя молекулярные свойства вещества определяются вообще не ядром, а строением электронной оболочки, все же физические свойства тяжелых изотопов и обычного водорода заметно различаются. Например:
Важные свойства имеет тяжелая вода, то есть вода, в молекулах которой вместо атомов легкого водорода содержится дейтерий.
Однако заметные изменения свойств изотопов наблюдаются только у легких элементов. Объясняется это тем, что у тяжелых элементов отношение массы ядра к массе нейтрона гораздо больше.
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
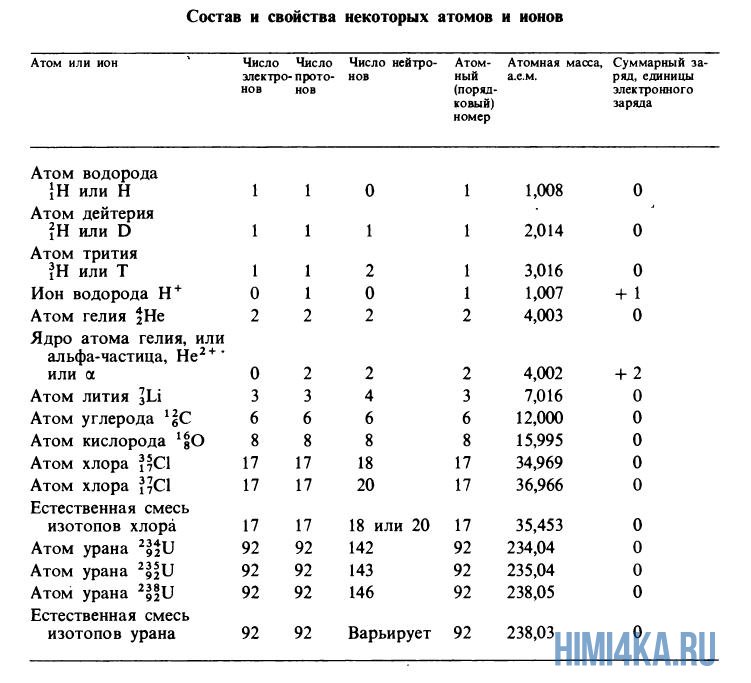
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Лекция 8. Изменения в составе ядер. Изотопы. Химический элемент
Малюгина 8. Изменения в составе ядер. Изотопы. Химический элемент.
Положение химического элемента в периодической системе зависит от величины заряда атомного ядра, т. е. от числа протонов в нем.

Процессы, протекающие с изменением состава ядер, называют ядерными реакциями. Ядерные реакции сопровождаются образованием новых химических элементов. Такие реакции происходят, например, на Солнце или в ядерном реакторе атомной электростанции.
Рис 1. Ядерные реакции на Солнце
Что будет, если изменить количество нейтронов в атоме, не изменяя количество протонов? Заряд ядра, а значит положение элемента в периодической системе, не изменится. Значит, новый элемент не образуется. Это будет все тот же химический элемент, но атомы его будут отличаться от исходного своей массой.
Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов называют изотопами.
Рис2. Изотопы углерода
12С – углерод-12 13С – углерод-12 14С – углерод-14
Изотопы обозначаются символами соответствующих элементов, слева вверху от которых записывают массовое число изотопа, а внизу – порядковый номер (заряд ядра атома) элемента, например,
126С – изотоп углерода с массовым числом 12
188О – изотоп кислорода с массовым числом 18
В природе различные химические элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Изотопы элемента с меньшим массовым числом называют легкими, изотопы с большим массовым числом называют тяжелыми.
Изотопы так же делятся на стабильные и нестабильные (радиоактивные). Некоторые нестабильные изотопы используют как «меченые атомы» в научных исследованиях.
Изотопы одного химического элемента не отличаются химическими свойствами. Исключение составляет водород. Из-за кратного увеличения его массы при изменении в составе ядра числа протонов, свойства изотопов значительно разнятся.
Элемент водород имеет три изотопа, каждому из которых присвоено свое название и обозначение:
1 протон, нейтронов нет
1 протон, 1 нейтрон
1 протон, 2 нейтрона
Чему равно число нейтронов в атомах следующих изотопов: 15N, 119Sn, 235U
Число протонов = порядковому номеру.
Для решения задачи найдем в ПСХЭ порядковые номера элементов и вычислим количество нейтронов, как разность между массовым числом и количеством протонов:
157N : N =15-7 =8; 8 нейтронов
11950Sn: N =119-50 =69; 69 нейтронов
23592U: N =235-92 =143; 143 нейтрона
Вопросы для самоконтроля:
1. От чего зависит положение химического элемента в периодической системе?
2. Почему атом магния занимает клетку ПСХЭ под номером 12?
3. Что произойдет с атомом, если в его ядре изменить (увеличить или уменьшить) количество протонов?
4. Как называются процессы, протекающие с изменением состава ядер?
5. Что произойдет с атомом, если в его ядре изменить количество нейтронов?
6. Что называют изотопами?
7. Чем отличаются атомы изотопов одного элемента?
8. Сколько изотопов может иметь атом?
9. Как называются изотопы водорода? Каков состав ядер этих изотопов?
10. Как обозначают и как называют изотопы элементов?
11. Почему изотопы хлора имеют одинаковые свойства, а изотопы водорода – разные?
12. Как классифицируют изотопы?
13. Почему проявляют разные химические свойства частицы 4019К и 4018Ar?
1. От величины заряда атомного ядра.
2. Заряд ядра атома магния равен 12, в ядре содержится 12 протонов.
3. Изменится заряд ядра, значит получится другой химический элемент.
4. Ядерными реакциями.
5. Изменится масса атома, химический элемент останется тем же.
6. Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов называют изотопами.
7. Числом нейтронов.
8. В природе элементы имеют разное число изотопов с разным процентным содержанием каждого из них.
9. У водорода три изотопа:
1 протон, нейтронов нет
1 протон, 1 нейтрон
1 протон, 2 нейтрона
10. Изотопы обозначаются символами соответствующих элементов, слева вверху от которых записывают массовое число изотопа 12С и указывают его в названии: углерод-12.
11. Изотопы химических элементов имеют, как правило, одинаковые свойства. Однако, у водорода при изменении числа нейтронов кратно увеличивается масса. Поэтому свойства изотопов водорода существенно отличаются. В связи с этим изотопы водорода получили индивидуальные названия: протий, дейтерий, тритий.
12. На легкие и тяжелые, на стабильные и нестабильные (радиоактивные).
13. Потому, что это разные химические элементы, они отличаются зарядом атомного ядра.
Задачи для самостоятельного решения
2. Определите относительную молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода – дейтерий.
3. Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16
1. Изотопы – атомы с одинаковым зарядом атомного ядра, но разным массовым числом. Заряд ядра атома = порядковому номеру. Находим в ПСХЭ порядковый номер химического элемента олова (равен 50), вычисляем массовое число (столбец 3).