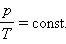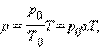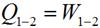Чем отличается изохорный и изобарный процессы
Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа
Знание определений в физике является ключевым фактором для успешного решения разных физических проблем. В статье рассмотрим, что понимают под процессами изобарным, изохорным, изотермическим и адиабатным для идеальной газовой системы.
Идеальный газ и его уравнение
Прежде чем переходить к описанию изобарного, изохорного и изотермического процессов, рассмотрим, что такое идеальный газ. Под этим определением в физике полагают систему, состоящую из огромного количества безразмерных и невзаимодействующих частиц, которые движутся с большими скоростями во всех направлениях. По сути, речь идет о газовом агрегатном состоянии вещества, в котором расстояния между атомами и молекулами намного превышают их размеры и в котором потенциальной энергией взаимодействия частиц пренебрегают ввиду ее малости, по сравнению с энергией кинетической.

Состоянием идеального газа называется совокупность его термодинамических параметров. Главными из них являются температура, объем и давление. Обозначим их буквами T, V и P, соответственно. В 30-е годы XIX века Клапейрон (французский ученый) впервые записал уравнение, которое объединяет указанные термодинамические параметры в рамках единого равенства. Оно имеет вид:
Что такое изопроцессы в газах?
Как многие заметили, изобарный, изохорный и изотермический процессы в своем названии используют одну и ту же приставку «изо». Она означает равенство одного термодинамического параметра во время прохождения всего процесса, при этом остальные параметры изменяются. Например, изотермический процесс говорит о том, что в его результате абсолютная температура системы поддерживается постоянной, а изохорный процесс свидетельствует о постоянстве объема.
Изопроцессы удобно изучать, поскольку фиксация одного из термодинамических параметров приводит к упрощению общего уравнения состояния газа. Важно отметить, что газовые законы для всех названных изопроцессов были открыты экспериментально. Их анализ позволил Клапейрону получить приведенное универсальное уравнение.
Изобарный, изохорный и изотермический процессы
Первым был открыт закон для изотермического процесса в идеальном газе. Сейчас он называется законом Бойля-Мариотта. Поскольку T не изменяется, то из уравнения состояния следует равенство:
Иными словами, любое изменение давления в системе приводит к обратно пропорциональному изменению ее объема, если поддерживать постоянной температуру газа. Графиком функции P(V) является гипербола.
Это равенство носит фамилию французского физика Жака Шарля, который получил его в конце XVIII века. Изобара (графическое изображение функции V(T)) выглядит как прямая линия. Чем больше давление в системе, тем быстрее возрастает эта линия.
Изобарный процесс легко осуществить, если под поршнем нагревать газ. Молекулы последнего увеличивают свою скорость (кинетическую энергию), создают более высокое давление на поршень, что приводит к расширению газа и поддержанию постоянной величины P.
Оно среди физиков известно как закон Гей-Люссака. Прямая пропорциональность между давлением и абсолютной температурой говорит о том, что график изохорного процесса, как и график изобарного, представляет собой прямую линию с положительным коэффициентом наклона.
Важно понимать, что все изопроцессы протекают в закрытых системах, то есть в их ходе величина n сохраняется.
Адиабатный процесс
Этот процесс не относится к категории «изо», поскольку при его прохождении изменяются все три термодинамических параметра. Адиабатным называют переход между двумя состояниями системы, при котором она не обменивается теплотой с окружающей средой. Так, расширение системы осуществляется за счет ее внутренних запасов энергии, что приводит к значительному падению давления и абсолютной температуры в ней.
Адиабатный процесс для идеального газа описывают уравнениями Пуассона. Одно из них приводится ниже:
График адиабаты отличается от графика изохорного процесса и от графика изобарного, однако он похож на гиперболу (изотерму). Адиабата в осях P-V ведет себя более резко, чем изотерма.
Изопроцессы
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
График изотермического процесса называется изотермой.
Рис. 2. Чем выше температура, тем выше изотерма
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3 ):
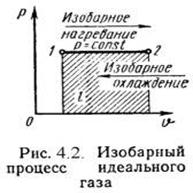
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
где — атмосферное давление.
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Рис. 5. Чем ниже изобара, тем больше давление
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6 ):
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Рис. 8. Чем ниже изохора, тем больше объём
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9 ):
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Изохорный, изобарный, изотермический, адиабатный процессы, их особенности



Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p
|
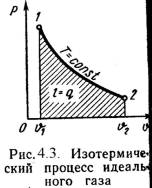
Уравнение состояния процесса:
Так как V 2 = V 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
Количество теплоты, подведенное в изохорном процессе, равно изменению внутренней энергии. Для произвольной массы вещества:
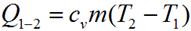
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 1.2).
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
|
Уравнение состояния процесса:
Работа этого процесса:
Уравнение 1-го закона т/д имеет вид:
Выражение для определения количества теплоты для 1 кг газа примет вид:
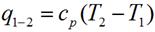
для произвольной массы газа:
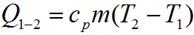
Таким образом, в изобарном процессе теплота расходуется на совершение работы и на изменение внутренней энергии рабочего тела.
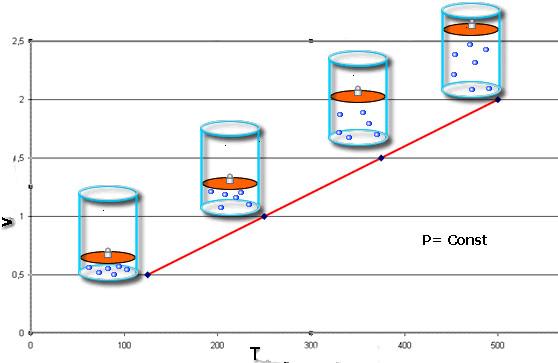
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 2.3), которые называются изобарами.
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид:
где R = Rh/ i – газовая постоянная [Дж/(кг·К)].
Теплота, участвующая в изотермическом процессе, определится соотношением:
Это означает что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
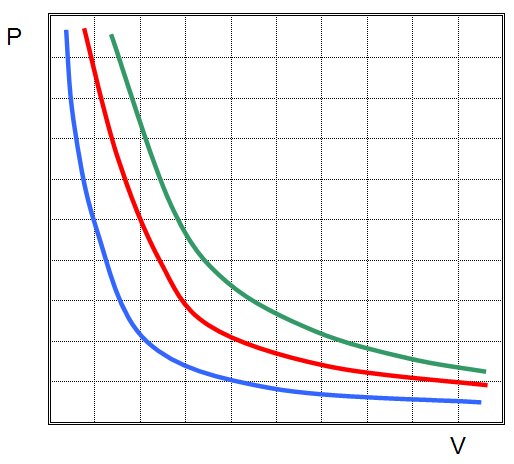
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p
1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.2). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
4) Адиабатный процесс (рис.4).
В данном процессе не подводится и не отводится тепло, т.е. процесс происходит без теплообмена с окружающей средой q =0.
где k = cp / cv – показатель адиабаты.
Cвязь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Разница между изобарическим и изохорическим процессом
Ключевое различие между изобарным и изохорным процессами состоит в том, что изобарный процесс происходит при постоянном давлении, тогда как изохорный процесс происходит при постоянном объеме.
Термодинамический процесс — это химический или физический процесс, который происходит в термодинамической системе, которая переводит систему из исходного состояния в конечное состояние. Существуют разные формы термодинамических процессов. Изобарные и изохорные процессы являются двумя такими процессами.
Содержание
Что такое изобарический процесс?
Изобарический процесс — это химический процесс, который происходит в термодинамической системе при постоянном давлении. Следовательно, изменение давления или ∆P равно нулю. Обычно система поддерживает постоянное давление, позволяя изменять объем системы; это может быть расширение или сжатие. Это изменение объема может нейтрализовать изменения давления, которые могут произойти из-за теплообмена между системой и окружающей средой.
Как правило, в изобарическом процессе внутренняя энергия (U) изменяется. Поэтому работа (W) выполняется системой во время теплообмена. Мы можем рассчитать работу при постоянном давлении, используя следующее уравнение.
Здесь W — работа, P — давление, а ∆V — изменение объема. Таким образом, если теплообмен вызывает увеличение объема системы, то система выполняет положительную работу, в то время как если теплообмен приводит к сокращению объема системы, то система выполняет отрицательную работу.
Что такое изохорический процесс?
Изохорический процесс — это химический процесс, который происходит в термодинамической системе при постоянном объеме. Таким образом, нет никаких изменений в объеме; ΔV — ноль. Поскольку объем остается постоянным, работа, выполняемая системой, равна нулю, при этом система не работает. В большинстве случаев это самая простая термодинамическая переменная для контроля. Процесс происходит в герметичном сосуде, который не расширяется и не сжимается.
Внутренняя энергия термодинамической системы изменяется в соответствии с теплопередачей. Однако все передаваемое тепло либо увеличивает, либо уменьшает внутреннюю энергию. Поскольку ∆V равен нулю, работа, выполненная системой (или работа, выполненная в системе) также равна нулю. Если U — внутренняя энергия, а Q — тепло, переданное;
В чем разница между изобарическим и изохорическим процессом?
Изобарический процесс — это химический процесс, который происходит в термодинамической системе при постоянном давлении, в то время как изохорический процесс — это химический процесс, который происходит в термодинамической системе при постоянном объеме. Это ключевое различие между изобарическим и изохорическим процессом. Это означает, что давление термодинамической системы остается неизменным во время изобарического процесса, тогда как давление изменяется соответственно в изохорическом процессе. Кроме того, объем термодинамической системы изменяется во время изобарического процесса, в то время как объем остается постоянным во время изохорического процесса. Однако в обоих процессах внутренняя энергия системы изменяется. Но в отличие от изобарического процесса, в изохорическом процессе, все тепло, которое передается, либо превращается во внутреннюю энергию, либо исходит от внутренней энергии.
Заключение — Изобарический и Изохорический Процесс
Как изобарические, так и изохорические процессы являются термодинамическими процессами, которые происходят в термодинамических системах при сохранении постоянным соответствующего параметра. Следовательно, различие между изобарическим и изохорическим процессом состоит в том, что изобарический процесс происходит при постоянном давлении, тогда как изохорический процесс происходит при постоянном объеме.