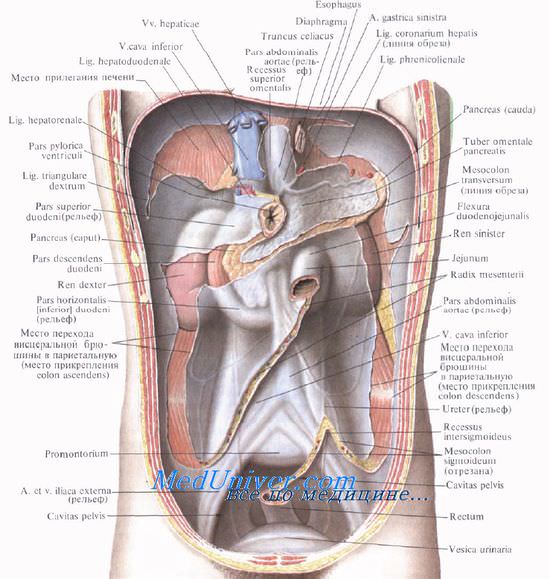
Чем отграничены брюшинные синусы каково их клиническое значение
Чем отграничены брюшинные синусы каково их клиническое значение
Два брыжеечных синуса образуются по обеим сторонам брыжейки тонкой кишки.
Правый брыжеечный синус, sinus mesentericus dexter, ограничен сверху брыжейкой поперечной ободочной кишки, справа — восходящей ободочной кишкой, слева и снизу — брыжейкой тонкой кишки и терминальным отделом подвздошной кишки.
Спереди правый брыжеечный синус нередко прикрыт большим сальником. Сзади синус ограничивает париетальная брюшина, отделяющая его от забрюшинного пространства. Синус обычно заполнен петлями тонкой кишки. В пределах правого синуса под париетальной брюшиной располагаются нижняя полая вена, правый мочеточник, яичковые (яичниковые) сосуды, нервы.
Снизу правый брыжеечный синус замкнут терминальным отделом подвздошной кишки и ее брыжейкой.
Таким образом, правый брыжеечный синус изолирован от малого таза. Правый брыжеечный синус связан только с левым брыжеечным синусом над двенадцатиперстно-тощекишечным изгибом.
Образующиеся в правом синусе скопления патологических жидкостей сначала ограничиваются пределами этого синуса. При горизонтальном положении туловища наиболее глубоким оказывается правый верхний угол синуса. Здесь может скапливаться экссудат при воспалительных процессах в брюшной полости.
Левый брыжеечный синус
Левый брыжеечный синус, sinus mesentericus sinister, располагается слева и книзу от корня брыжейки тонкой кишки. Сверху его ограничивает брыжейка поперечной ободочной кишки, слева — нисходящая ободочная кишка и брыжейка сигмовидной кишки, справа — брыжейка тонкой кишки. Задней стенкой, как и справа, является париетальная брюшина. Под ней видны аорта, нижняя брыжеечная артерия, левый мочеточник.
Левый брыжеечный синус больше правого. Левый брыжеечный синус также заполнен петлями тонкой кишки и прикрыт поперечной ободочной кишкой и большим сальником. Наиболее глубоким местом является верхний левый угол синуса.
Левый брыжеечный синус в отличие от правого широко сообщается с полостью малого таза.
Кнаружи от восходящей и нисходящей ободочных кишок брюшина, переходя со стенок брюшной полости на кишку, образует околоободочно-кишечные борозды (каналы), sulci paracolici.
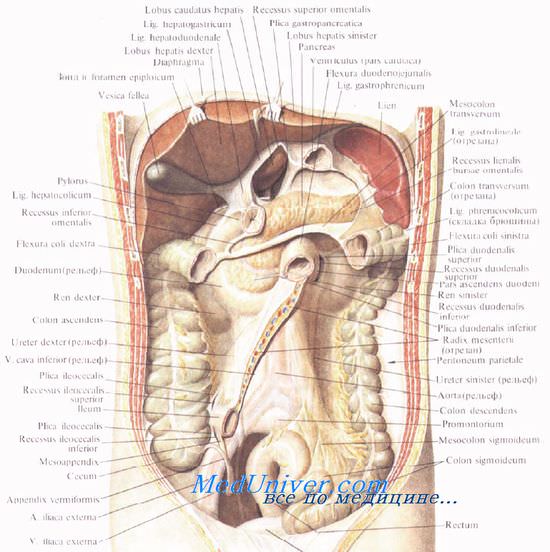
Каналы и синусы брюшной полости, их клиническое значение.



Сальниковая и печеночная серозные сумки (положение, стенки, клиническое значение).
Сальниковая сумка – расположено позади желудка и печеночно-желудочной связки.
Стенки. спереди желудок и малый сальник, сзади – брюшина, поджелудочная железа, аорта, нижняя полая вена, снизу- левая часть брыжейки поперечно-ободочной кишки, сверху — диафрагма, слева — селезенка и ее связки.. Вход в сальниковую сумку под печеночно-12-перстной связкой – Винслово отверстие. Печеночная сумка – стенками являются диафрагма, венечная и серповидная связки, передняя брюшная стенка. Окружает правую долю печени Книзу переходит впереди поперечноободочной кишки в предсальниковый промежуток.. Печеночная сумка сообщается с правым боковым каналом брюшной полости. Клиническое значение: 1) сальниковая – скапливается гной, содержимое желудка при прободной язве задней стенки или ее ранении, через нее можно получить доступ к поджелудочной железе; 2) печеночная – место образования поддиафрагмальных абсцессов при остром аппендиците, прободной язве, абсцессах печени;
Чем отграничены брюшинные синусы каково их клиническое значение
Нижний этаж полости живота отделен от верхнего брыжейкой поперечной ободочной кишки, mesocolon transversum. Внизу он доходит до полости малого таза. В нижнем этаже находятся тонкая кишка (начиная с flexura duodenojejunalis), переходящая в правой подвздошной ямке в толстую кишку.
Отделы толстой кишки — восходящая, поперечная, нисходящая и сигмовидная ободочные кишки — как ободом (отсюда название) окружают петли тонкой кишки по бокам и сверху.
Вся тонкая кишка покрыта брюшиной со всех сторон (интраперитонеальное положение) и имеет общую брыжейку, mesenterium. Полностью покрыты брюшиной слепая, поперечная и сигмовидная ободочные кишки. С трех сторон брюшина покрывает восходящую и нисходящую ободочные кишки (мезоперитонеальное положение).
Как и в верхнем этаже, к органам нижнего этажа брюшной полости (тонкому и толстому кишечнику) из забрюшинного пространства непосредственно или через дупликатуры брюшины (брыжейки) подходят артерии и нервы, выходят вены и лимфатические сосуды.
Корень брыжейки тонкой кишки, radix mesenterii, фиксирующий ее к задней стенке живота, начинается у левого края тела II поясничного позвонка и идет в косом направлении сверху вниз, слева направо, к правому крестцово-подвздошному сочленению, где расположено место перехода тонкой кишки в толстую — илеоце-кальный угол.
Начальный отдел брыжейки фиксирован у flexura duodenojejunalis. Дальше высота (расстояние от задней стенки полости живота до стенки кишки) брыжейки постепенно нарастает, достигая максимума (20—25 см) примерно у места перехода тощей кишки в подвздошную, а у илеоцекального угла становится минимальной. В среднем высота брыжейки составляет 14—15 см.
Проекционная линия корня брыжейки на передней стенке живота строится таким образом: верхняя точка располагается на 8—10 см выше пупка левее срединной линии тела на 2,5—3 см, нижняя — на 8—10 см выше середины проекции правой паховой связки. Длина корня брыжейки по линии прикрепления его к задней стенке живота колеблется от 15 до 23 см.
Позади корня брыжейки в забрюшинном пространстве располагаются горизонтальная часть duodenum, брюшная аорта, нижняя полая вена, правый мочеточник и m. psoas.
Между листками брюшины в клетчатке mesenterium проходят а. mesenterica superior со своими ветвями, одноименные вены, нервы и лимфатические узлы и сосуды.
Возможности ультразвуковой диагностики в мониторинге лечения поддиафрагмального абсцесса
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
Первое описание поддиафрагмального абсцесса (ПДА) в литературе на основании аутопсийных данных было опубликовано в 1824 г. [1], а впервые прижизненно диагноз ПДА был установлен английским врачом Barlow в 1845 г. [2]. В последующие годы описанием клинической картины ПДА и диагностикой заболевания занимались Bouchard (1862), Leyden (1882) [3]. Первое успешное хирургическое лечение было проведено Von Volkman в 1879 г. [4]. В 1907 г. Barnard на заседании Королевского общества медицины представил доклад о хирургических аспектах ПДА [5].
Под ПДА до 20–30-х годов XX века понимали «ограниченное скопление гноя, которое на большем или меньшем протяжении прилегает к нижней поверхности диафрагмы» [6]. По предложению Lockwood с 1921 г. данное состояние определяют как отграниченное скопление гноя в поддиафрагмальном пространстве, расположенном в верхнем этаже брюшной полости и ограниченном сверху, сзади диафрагмой, спереди и с боков – диафрагмой и передней брюшной стенкой, снизу – верхней и задней поверхностью печени и поддерживающими ее связками [7].
В поддиафрагмальном пространстве различают внутрибрюшинную и забрюшинную части. Внутрибрюшинная часть серповидной связкой печени и позвоночником делится на правый и левый отделы. В правом отделе различают передневерхнюю и задневерхнюю области. Передневерхняя область ограничена медиально серповидной связкой печени, сзади – верхним листком венечной связки, сверху – диафрагмой, снизу – диафрагмальной поверхностью правой доли печени, спереди – реберной частью диафрагмы и передней брюшной стенкой. Задневерхняя область ограничена спереди задней поверхностью печени, сзади – пристеночной брюшиной, покрывающей заднюю брюшную стенку, сверху – нижним листком венечной и правой треугольной связками печени [8]. Обе указанные выше области сообщаются с подпеченочным пространством, с брюшной полостью. Левостороннее поддиафрагмальное пространство имеет щелевидную форму и располагается между левым куполом диафрагмы сверху и левой долей печени слева от серповидной связки печени, селезенкой и ее связками и передненаружной поверхностью желудка.
Забрюшинная часть поддиафрагмального пространства имеет ромбовидную форму и ограничена сверху и снизу листками венечной и треугольной связок печени, спереди – задней поверхностью внебрюшинной части левой и правой долей печени, сзади – задней поверхностью диафрагмы, задней брюшной стенкой и переходит в забрюшинную клетчатку.
Различают внутри- и внебрюшинные ПДА, которые делятся на лево-, правосторонние и срединные. Эти абсцессы, в свою очередь, различаются по месту нахождения по отношению к своду диафрагмы. Правосторонние: передневерхние, верхнезадние, центральные, задненижние. Левосторонние: верхние, нижнепередние, задненижние, околоселезеночные. Кроме того, различают нижние внебрюшинные право- и левосторонние абсцессы.
Чаще всего ПДА возникает во внутрибрюшинной части поддиафрагмального пространства [8].
Этиология ПДА обусловлена попаданием инфекции в поддиафрагмальное пространство из местных и отдаленных очагов. К наиболее частым причинам относят:
Лишь 10% больных ПДА не имели в анамнезе предшествующих операций и травм [9].
Микробная флора ПДА разнообразна. По данным большинства авторов, чаще всего в гное обнаруживаются стрептококк, стафилококк, кишечная палочка, нередко в культурах отмечается рост неклостридиальной анаэробной флоры [10].
Клиническая картина ПДА многообразна, зависит от наличия или отсутствия в нем газа и нередко обусловлена симптомами основного заболевания или осложнения, на фоне которого развился ПДА. В клинической картине преобладают симптомы острого или подострого гнойно септического состояния.
Большинство пациентов предъявляют жалобы на боли (острые, «резкие», «жгучие»), чаще умеренные в начале болезни, на тянущие боли в правой половине грудной клетки, меняющиеся по интенсивности при движении, кашле, дыхании, напряжении; иррадиирующие в шею, в надплечье, лопатку, ключицу с одноименной ПДА стороны.
Общая слабость, повышение температуры до 37–39° C и другие симптомы интоксикации (озноб, миалгия, слабость, потливость, тахикардия, тошнота, анорексия) характерны для данного заболевания. При осмотре больных отмечаются вынужденное полусидячее положение, бледность кожных покровов, иногда субиктеричность склер. Можно наблюдать, особенно при больших абсцессах, сглаженность межреберий в нижней половине грудной клетки, утолщение кожной складки, пастозность, редко гиперемию на стороне поражения [8].
В начале заболевания при осмотре живота не удается обнаружить никаких симптомов. Позже появляются характерные симптомы: вздутие подреберной области при правостороннем ПДА и парадоксальное дыхание, при котором подложечная область втягивается при вдохе и выпячивается при выдохе. В некоторых случаях определяются изменения кожи и подкожной жировой клетчатки. В поздних стадиях кожа становится слегка желтоватой и сухой на ощупь. Иногда наблюдается полоса припухлости и отечности на боковой поверхности нижней половины грудной клетки; этот симптом связан с нарушением кровообращения в этой области.
Пальпация грудной клетки и живота около диафрагмы обнаруживает мышечное напряжение, соответствующее локализации ПДА (более ясное со стороны брюшной стенки). Иногда можно прощупать край ПДА, когда он опускается из-под диафрагмы по задней поверхности передней брюшной стенки. Наиболее важный симптом, получаемый при пальпации, – чувствительность и особенно болезненность в области его расположения. Для топической диагностики необходимо выявить зону болезненности, соответствующую ПДА [11].
Лабораторные показатели малоспецифичны и отражают наличие активного воспалительного процесса. В общем анализе крови отмечаются анемия, лейкоцитоз со сдвигом влево, ускорение СОЭ. При биохимическом исследовании повышен уровень С-реактивного белка, диспротеинемия. Некоторую информацию о генезе ПДА можно получить при исследовании пунктатов (обнаружение тирозина, гематоидина, желчных пигментов) [8, 10].
К методам диагностики относятся рентгенологическое исследование, КТ органов грудной клетки и УЗИ органов брюшной полости [10,13–15]. Рентгенологическое исследование дает возможность установить наличие и локализацию ПДА, сопутствующие осложнения в плевре и легочной ткани [10,12,13]. КТ органов брюшной полости позволяет четко определить анатомические особенности расположения ПДА, в том числе разграничение внутрибрюшинных и внебрюшинных, располагающихся между листками венечной связки или над верхним полюсом почки.
В литературе имеются весьма скудные единичные описания характерных ультразвуковых признаков поддиафрагмального абсцесса [10]:
Наиболее информативным ультразвуковым признаком ПДА является наличие скопления жидкости (83,3%) и участков затемнения (66,5%) в поддиафрагмальном пространстве. Возможна визуализация гипоэхогенного образования серповидной формы с гиперэхогенными включениями (секвестры, очаги некроза с четко выраженной капсулой).
Чрезвычайно важно отметить, что выявляемое при УЗИ минимальное скопление жидкости в реберно-диафрагмальном синусе (до 10 мл) не может быть диагностировано рентгенологически, так как этим методом можно выявить скопление жидкости или гноя объемом более 200 мл.
Основным методом лечения ПДА является хирургическое лечение (вскрытие и дренирование), дополненное консервативной терапией (дезинтоксикационная, антибактериальная, симптоматическая). В каждом отдельном случае подход к методу оперативного лечения при ПДА определяется локализацией и топографо-анатомическими отношениями в зоне абсцесса [9,10,16–18].
Для иллюстрации возможностей УЗИ в диагностике и контроле результатов оперативного лечения представляем наше клиническое наблюдение.
Клиническое наблюдение
Пациент Л., 1936 г.р., пенсионер. Обратился к онкологу с жалобами на появление болей в правой половине грудной клетки, слабость, одышку при обычной физической нагрузке. Наблюдался у онколога по поводу первично-множественного рака: предстательной железы II ст. (брахитерапия в 2012 г.), рака крайней плоти I ст. (хирургическое лечение в 2013 г.), рака желудка I ст. (хирургическое лечение в 2016 г.).
На момент обращения состояние удовлетворительное. Температура тела 37,2° С. Отмечается легкая бледность кожных покровов. Подкожно-жировая клетчатка развита. Отеков нет. Периферические лимфатические узлы не пальпируются. В легких дыхание ослабленное, не проводится в нижние отделы справа, перкуторный звук притуплен. Тоны сердца ритмичные, ясные. АД 140/90 мм рт. ст. Пульс 69 ударов в минуту.
Живот участвует в акте дыхания, болезненный, мягкий в правом подреберье, глубокая пальпация болезненна. Нижний край печени перкуторно у края реберной дуги. При пальпации печень мягко-эластической консистенции, безболезненная. Симптомы Ортнера и Мерфи отрицательные. Френикус-симптом отрицательный с обеих сторон. Стул одно-двухкратный, неоформленный, без патологических примесей. Мочеиспускание свободное, безболезненное.
Для уточнения диагноза пациенту было выполнено УЗИ органов гепатобилиарной зоны с УЗ-ангиографией: печень в размерах не увеличена: переднезадний размер правой доли 12,2 см (N до 12,5 см), переднезадний размер левой доли 7,0 см (N до 7,0 см). Диафрагмальный край ровный. Структура паренхимы умеренно диффузно неоднородная. Эхогенность умеренно повышена. Внутри- и внепеченочные желчные протоки не расширены. Диаметр воротной вены 1,0 см. Желчный пузырь типично расположен, размерами 9,5 х 2,5 см, с выраженным перегибом в теле. Контуры четкие, ровные. Стенка толщиной 0,3 см, несколько неоднородной структуры, повышенной эхогенности. Содержимое пузыря гомогенное. Диаметр проксимальной части холедоха 0,4 см. Визуализация поджелудочной железы неудовлетворительная (на фоне метеоризма), в осмотренных фрагментах в размерах не увеличена: головка 2,6 см, тело 1,4 см, хвост 2,5 см. Контуры нечеткие. Структура паренхимы умеренно диффузно неоднородная. Эхогенность повышена. Вирсунгов проток не визуализируется. Селезенка в размерах не увеличена – 9,1 х 3,4 см, площадь 25,0 см². Контуры ровные, четкие. Структура паренхимы несколько неоднородная. Эхогенность средняя. Селезеночная вена диаметром до 0,8 см. В правой плевральной полости определяется не менее 1400 мл свободной жидкости.
В левой плевральной полости жидкость не визуализируется. В правом поддиафрагмальном пространстве лоцируется жидкостное образование с утолщенными до 0,3 см стенками повышенной эхогенности размерами 10,9 х 6,6 х 8,1см, объемом 307 мл, выраженно неоднородной структуры с наличием гиперэхогенных включений (рис. 1а ), подвижных при УЗИ, аваскулярное (рис. 1б). Образование дифференцируется от правой доли печени.
а) В-режим. В правом поддиафрагмальном пространстве определяется гипоэхогенное жидкостное образование с утолщенными до 0,3 см стенками повышенной эхогенности размерами 10,9 х 6,6 х 8,1см объемом 307 мл, выраженно неоднородной структуры с наличием гиперэхогенных включений.
Протокол лечения пациентов с острым панкреатитом
Протокол разработан на основе рекомендаций Российского общества хирургов и приказа Департамента здравоохранения города Москвы № 320 (2011г.)
Классификация острого панкреатита, формулировка диагноза.
1. Острый алкогольно-алиментарный панкреатит.
2. Острый билиарный панкреатит (холелитиаз, парафатериальный дивертикул дивертикул, папиллит, описторхоз ).
3. Острый травматический панкреатит (вследствие травмы поджелудочной железы, в том числе операционной или после ЭРХПГ).
4. Другие этиологические формы (аутоиммунные процессы, сосудистая недостаточность, васкулиты, лекарственные, инфекционные заболевания), аллергические, дисгормональные процессы при беременности и менопаузе, заболевания близлежащих органов.
1. Острый панкреатит лёгкой степени. Панкреонекроз при данной форме острого панкреатита не образуется (отёчный панкреатит) и органная недостаточность не развивается.
2. Острый панкреатит тяжёлой степени. Характеризуется наличием органной и полиорганной недостаточности, перипанкреатического инфильтрата, формированием псевдокист, развитием инфицированного панкреонекроза (гнойно-некротического парапанкреатита).
Диагностика острого панкреатита.
Диагностическая программа включает в себя: клиническую, лабораторную и инструментальную верификацию диагноза острого панкреатита; стратификацию пациентов на группы в зависимости от тяжести заболевания; построение развернутого клинического диагноза.
Верификация диагноза острого панкреатита включает в себя: физикальное исследование – оценка клинико-анамнестической картины острого панкреатита; лабораторные исследования – общеклинический анализ крови, биохимический анализ крови (в т.ч. а-амилаза, липаза, билирубин, АлАТ, АсАТ, ЩФ, мочевина, креатинин, электролиты, глюкоза), общеклинический анализ мочи, коагулограмма, группа крови, резус-фактор; обзорная рентгенограмма брюшной полости (увеличение диаметра петель тонкой кишки, уровни жидкости), рентгенография грудной клетки (гидроторакс, дисковидные ателектазы, высокое стояние купола диафрагмы, гипергидратация паренхимы, картина ОРДС), ЭКГ; УЗИ брюшной полости – оценка наличия свободной жидкости, оценка состояния поджелудочной железы (размеры, структура, секвестры, жидкостные включения), оценка состояния билиарного тракта (гипертензия, конкременты), оценка перистальтики кишечника.
Пациентам с предположительным клиническим диагнозом острого панкреатита показано выполнение ЭГДС (дифференциальный диагноз с язвенным поражением гастродуоденальной зоны, осмотр БДС).
Стратификация пациентов по степени тяжести острого панкреатита по следующим критериям:
1. Тяжелый панкреатит (более одного из критериев):
Пациенты с тяжелым панкреатитом госпитализируются в отделение хирургической реанимации.
Пациенты с панкреатитом легкого течения госпитализируются в хирургическое отделение.
Лечение пациентов с острым панкреатитом легкого течения.
Базисный лечебный комплекс:
В динамике ежедневно оцениваются: критерии ССВР, а-амилаза. Требования к результатам лечения: купирование болевого синдрома, клинико-лабораторное подтверждение разрешения активного воспалительного процесса.
Отсутствие эффекта от проводимой анальгетической и спазмолитической терапии в течение 12-48 часов, быстро прогрессирующая желтуха, отсутствие желчи в ДПК при ЭГДС, признаки билиарной гипертензии по данным УЗИ свидетельствуют о стеноза терминального отдела холедоха (вклиненный конкремент БДС, папиллит). В этом случае показано проведение ЭПСТ. При остром панкреатите ЭПСТ производится без ЭРХПГ!
Мониторинг общесоматического и локального статуса пациентов с тяжелым острым панкреатитом:
Лечебная тактика у пациентов с острым панкреатитом тяжелого течения в фазу панкреатогенной токсемии.
Основным видом лечения острого панкреатита в фазе токсемии является комплексная интенсивная консервативная терапия.
Базисная терапия острого панкреатита дополняется следующими компонентами:
— интенсивное ингибирование секреции поджелудочной железы (октреотид 300 мкг x 3 раза в сутки подкожно или 1000 мкг в сутки непрерывной инфузией) до нормализации показателей а-амилазы и липазы;
— продленная эпидуральная анестезия;
— доза инфузионных растворов должна быть не менее 40-60 мл/кг массы тела больного в сутки; высокообъемная инфузионная терапия включает в себя сбалансированные кристаллоидные растворы и коллоидные растворы (в сочетании кристаллоидов и коллоидов 2:1);
— реологически активная терапия: коллоиды в сочетании с антиагрегантами, НФГ (15-20 тыс. ед. в сутки) или НМГ; введение антиоксидантов;
— экстракорпоральная детоксикация: продленная вено-венозная гемодиафильтрация и серийный плазмаферез;
— установка ниппельного зонда энтерального питания за дуодено-еюнальный переход с одновременной установкой назо-гастрального зонда для желудочной декомпрессии; введение в первые 24-48 часов в тонкую кишку электролитных растворов (1 – 2 литра/сут); последующее энтеральное питание олигомерными и полимерными питательными смесями;
— обеспечение смешанной парентерально-энтеральной нутритивной поддержки с калоражем не менее 2000 ккал в сутки.
Хирургическая тактика:
Оперативные вмешательства лапаротомным доступом в фазу ферментной токсемии противопоказаны. По показаниям применяются малоинвазивные вмешательства – чрезкожные пункции и дренирования, лапароскопия, ЭПСТ.
Чрескожная пункция и дренирование острых жидкостных скоплений под контролем УЗИ позволяет снизить уровень эндогенной интоксикации.
Пункции подлежат очаги острых жидкостных скоплений, располагающиеся в сальниковой сумке, забрюшинной клетчатке, и в случаях, когда лапароскопическое дренирование острых жидкостных скоплений в брюшной полости невозможно (тяжесть состояния больного, больной перенес раннее несколько операций на брюшной полости, гигантская вентральная грыжа).
Экстренная декомпрессия желчевыводящих путей у больных острым билиарным панкреатитом показана при: отсутствии эффекта от проводимой консервативной терапии в течение 6-12 часов; вклиненном конкременте БДС; нарастании явлений механической желтухи; прогрессировании явлений острого холецистита и/или холангита.
При диагностированном резидуальном или рецидивном холедохолитиазе, холедохолитиазе на фоне хронического калькулезного холецистита, остром обтурационном холангите, папиллите или папиллостенозе показано проведение ЭПСТ без ЭРХПГ! При невозможности проведения ЭПСТ показана чрескожная чреспеченочная микрохолецистостомия под контролем УЗИ. При невозможности добиться адекватной декомпрессии из вышеописанных доступов показана чрескожная чреспеченочная холангиостомия. В случае вклинения конкремента в области большого дуоденального сосочка предпочтение отдается эндоскопической папиллогомии.
Показания к лапароскопии:
— клиническая картина перитонита с наличием УЗ-признаков свободной жидкости в брюшной полости;
— необходимость проведения дифференциальной диагностики с другими острыми заболеваниями органов брюшной полости.
Лечебная тактика у пациентов с тяжелым панкреатитом в фазу асептической секвестрации.
Клинико-морфологической формой острого панкреатита в фазе асептической секвестрации является постнекротическая псевдокиста поджелудочной железы, срок формирования которой составляет от 4 недель и в среднем до 6 месяцев.
Исходы острого панкреатита в фазу асептической секвестрации:
4) Инфицирование зон панкреатогенной деструкции (развитие гнойных осложнений).
Диагностические критерии фазы асептической секвестрации:
— уменьшение степени выраженности ССВР, отсутствие признаков инфекционного процесса;
— УЗ-признаки и КТ-признаки асептической деструкции в очаге поражения (сохраняющееся увеличение размеров поджелудочной железы, нечеткость ее контуров и появление жидкости в парапанкреатической и забрюшинной клетчатке c последующим формированием псевдокист, визуализация секвестров в ткани поджелудочной железы и в парапанкреатической клетчатке).
Лечение в фазу асептической секвестрации.
Хирургическая тактика у пациентов с острым панкреатитом в период асептических деструктивных осложнений.
Показание к оперативным вмешательствам – наличие отграниченных парапанкреатических жидкостных скоплений (с секвестрами или без таковых).
Приоритетным является выполнение малоинвазывных чрезкожных вмешательств под УЗ-контролем или КТ-контролем.
Чрезкожные пунции под УЗ-контролем показаны при наличии жидкостных образований объемом не более 100 мл. Систематические пункции могут послужить окончательным методом хирургической помощи или позволить отложить выполнение радикальной операции.
Чрезкожное дренирование под УЗ-контролем проводится при наличии жидкостных скоплений объемом более 100 мл. Дренирование кисты предусматривает аспирационно-промывную санацию полости кисты и оценку адекватности дренирования с помощью динамической фистулографии.
Оперативные вмешательства лапаротомическим и (или) люмботомическим доступом проводятся при наличии технических ограничений к безопасному выполнению пункционных вмешательств (расположение на предполагаемой траектории вмешательства ободочной кишки, селезенки, крупных сосудов, плеврального синуса); при преобладании в жидкостном скоплении или острой псевдокисте тканевого компонента (секвестров).
При очаговом процессе следует использовать мини-лапаротомию (параректальную, трансректальную, косую в подреберье) или мини-люмботомию. При распространенном процессе следует использовать широкую срединную лапаротомию, широкую люмботомию или их сочетание.
В условиях завершенной секвестрации и полной некросеквестрэктомии операция должна завершатся «закрытым» дренированием образовавшейся полости 2-х просветными дренажами, по числу отрогов полости, которые выводятся на брюшную стенку вне операционной раны. Рана ушивается наглухо. В послеоперационном периоде проводится аспирационно-промывное лечение до облитерации полости.
При незавершенной секвестрации и неполной некрсеквестрэктомии операция должна завершатся «открытым» дренированием 2-х просветными дренажами по числу отрогов полости, выводимыми вне раны через контрапертуры и введением тампонов в образовавшуюся полость через операционную рану. Рана частично ушивается и формируется бурсооментостома или люмбостома для доступа к очагу деструкции при последующих программных санациях. По дренажам проводится аспирационно-промывное лечение, перевязки с дополнительной некрсеквестрэктомией и сменой тампонов до очищения полости с последующим наложением вторичных швов на рану и переходом на закрытое дренирование.
Лечебная тактика у пациентов с тяжелым панкреатитом в фазу гнойно-септических осложнений.
Клинико-морфологическими проявлениями острого панкреатита в фазу гнойно-септических осложнений являются:
Диагностические критерии фазы гнойно-септических осложнений:
1. Клинико-лабораторные проявления инфекционного процесса: прогрессирование клинико-лабораторных показателей ССВР на 3 неделе заболевания; высокие показатели маркеров острого воспаления (С-реактивного белка – более 120 г/л и прокальцитонина – более 2 нг/мл); лимфопения, увеличение СОЭ, повышение концентрации фибриногена; ухудшение состояния больного по интегральным оценочным системам.
2. Инструментальные критерии нагноения: КТ-признаки (нарастание в процессе наблюдения жидкостных образований, в очаге панкреатогенной деструкции и/или наличие пузырьков газа) и/или положительные результаты бактериоскопии, полученные при тонкоигольной пункции.
Хирургическая тактика у пациентов с острым панкреатитом в фазу гнойно-септических осложнений.
При развитии гнойных осложнений показано срочное хирургическое вмешательство.
Малоинвазивные пункционные вмешательства (пункция и дренирование) показаны при наличии четко отграниченных гнойных скоплений (жидкостные скопления, панкреатический абсцесс, инфицированная псевдокиста) без выраженного тканевого компонента (секвестров). Оптимальным следует считать установку в полость гнойника двух дренажей с последующей установкой промывной системы.
Оперативные вмешательства лапаротомным и люмботомическим доступом показаны в случаях значительной распространенности процесса в забрюшинной клетчатке или при отграниченном процессе с наличием в полости гнойника крупных некротических фрагментов. Основным методом санации гнойно-некротических очагов является некрсеквестрэктомия, которая может быть как одномоментной, так и многоэтапной.
Оптимальным доступом является внебрюшинный, в виде люмботомии с продлением разреза на брюшную стенку по направлению к прямой мышце живота, что позволяет при необходимости, дополнить этот доступ лапаротомией.
Способ завершения операции зависит от адекватности некрсеквестрэктомии. При полном удалении некротических тканей возможно «закрытое» дренирование двухпросветными дренажами по числу отрогов полости с выведением дренажей через контрапертуры на брюшной стенке. Через дренажи в послеоперационном периоде проводится аспирационно-промывная санация.
При неполном удалении некротических тканей следует применять «открытое» дренирование двухпросветными дренажами по числу отрогов полости, в сочетании с тампонированием полости через операционную рану и оставлением доступа для последующих программных ревизий и некрэктомий в виде оментобурсостомы и (или) люмбостомы. Через дренажи в послеоперационном периоде проводится аспирационно-промывная санация.
Контроль за адекватностью дренирования и состоянием (размерами) дренированных полостей должен проводиться с помощью фистулографии, УЗИ и КТ каждые 7 суток. Неэффективность дренирования (по клинико-инструменальным данным) или появление новых гнойных очагов служит показанием к повторной операции с дополнительной некрэктомией и дренированием.
При развитии аррозивного кровотечения в очаге гнойной деструкции следует произвести ревизию зоны кровотечения, удалить секвестры, прошить место кровотечения (временный гемостаз) и выполнить перевязку сосудов на протяжении вне гнойного очага (окончательный гемостаз). Накладывать швы на стенку сосуда в зоне дефекта в гнойной запрещено. При невозможности лигирования сосудов вне гнойного очага показана дистальная резекция поджелудочной железы и спленэктомия.
Антибактериальная терапия при остром панкреатите.
• Антибиотикопрофилактика не показана у пациентов с тяжелым острым панкреатитом в фазе ферментной токсемии.
• У пациентов в фазе гнойно-септических осложнений эмпирической терапией считается:
Пиперациллин-тазобактам 4.5 г в/в каждые 6 часов
Цефепим 1 г в/в каждые 8 часов ПЛЮС метронидазол 500 мг в/в каждые 8 часов
Ципрофлоксацин 400 мг в/в каждые 12 часов ПЛЮС метронидазол 500 мг в/в каждые 8 часов
Проникновение селективных антибиотиков в поджелудочную железу.
Хорошее (>40%): фторхинолоны, карбапенемы, цефтазидим, цефепим, метронидазол, пиперациллин-тазобактам