Чем остановить рост метастаз
Что такое метастазы опухоли? Причины возникновения, диагностику и методы лечения разберем в статье доктора Пылева А. Л., онколога со стажем в 21 год.
Определение болезни. Причины заболевания
В настоящее время известно, что метастазирование — это сложный, динамический процесс. В нем играет роль мутационная нагрузка опухоли (количество мутаций в генетическом коде раковых клеток), взаимодействие между раковыми и нормальными клетками, сигнальные молекулы, которые находятся в межклеточном веществе (они взаимодействуют с клетками и контролируют их рост и размножение).
Вероятность развития метастазов
Возникнут метастазы или нет, зависит от нескольких факторов:
Что влияет на скорость распространения метастазов
Скорость распространения метастазов также зависит от вида рака, степени злокачественности опухоли и её молекулярно-генетических особенностей. Например, высокий уровень белка бета TGF может повышать скорость распространения метастазов.
Однако чаще в клинической практике скорость распространения метастазов по организму ассоциируют с видом рака и его локализацией. Например, низкодифференцированные опухоли метастазируют раньше, чем высокодифференцированные, а рак лёгкого, благодаря хорошему кровоснабжению, распространяется гораздо быстрее, чем рак простаты.
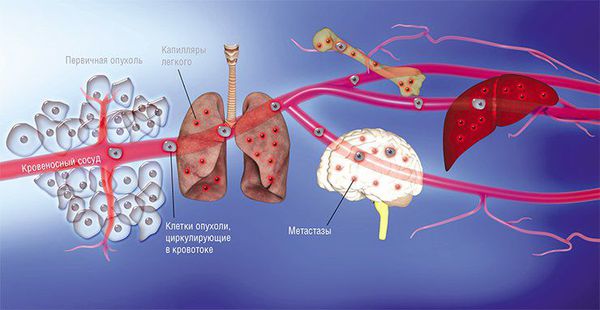
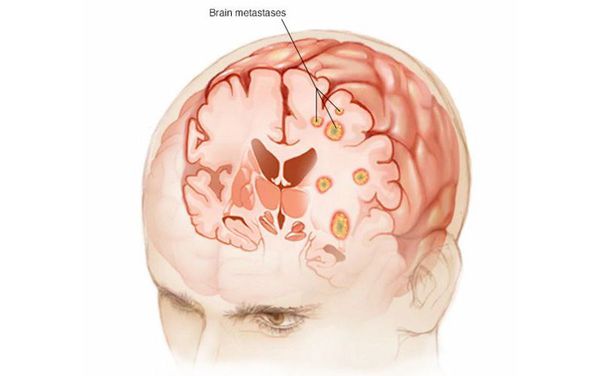
Чаще всего злокачественные опухоли метастазируют в кости, лёгкие, печень и головной мозг. При некоторых типах рака опухолевые клетки распространяются по поверхности брюшины.
Одна из них гласит о том, что из-за накопившихся мутаций происходит эпителиально-мезенхимальный переход: опухолевые клетки начинают напоминать те, что находятся в теле эмбриона и участвуют в заживлении ран. Они имеют неправильную форму, не удерживаются на определенном месте и могут мигрировать в организме.
Согласно другой теории, метастазы происходят из стволовых клеток, которые в норме должны замещать погибшие в результате повреждений или естественным образом клетки. В пользу этой теории свидетельствует тот факт, что опухолевые и стволовые клетки имеют ряд общих черт в строении и биохимических процессах.
Есть мнение, что злокачественной опухоли помогают распространять метастазы макрофаги («клетки-пожиратели»), которые в норме должны устранять чужеродные частицы. При раке они поддерживают воспаление и ангиогенез (процесс образования новых кровеносных сосудов). Это способствует миграции опухолевых клеток.
У онкологических больных ежедневно выходят в кровоток миллионы раковых клеток. Но лишь немногие из них могут дать начало метастазам. Это зависит от гистологического типа опухоли (из каких тканей она произошла), степени агрессивности опухоли (стадии рака), дифференцировки клеток (насколько сильно они утратили черты нормальных).
Симптомы метастазов опухоли
Наличие метастазов предполагает наличие первичной опухоли. Соответственно именно на симптомы первичной опухоли накладываются симптомы метастазов. При этом далеко не всегда метастазы рака вызывают симптомы сами по себе. Это зависит от размеров, количества и локализации опухолевых очагов.
Особенности метастазирования опухолей
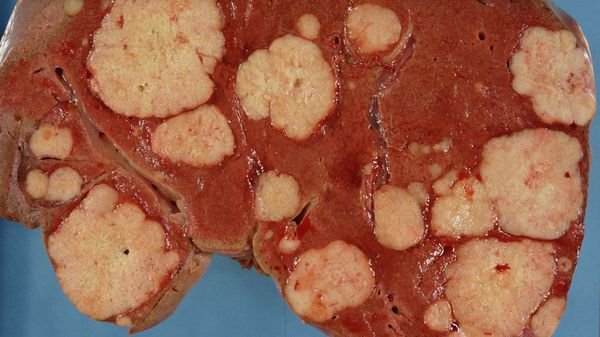
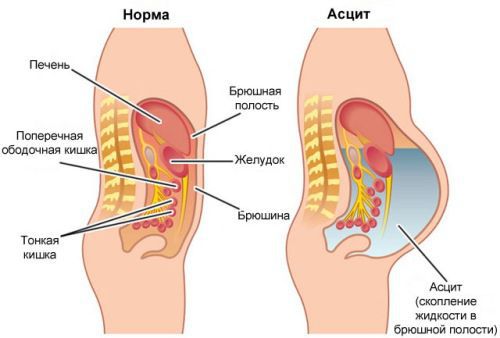
Метастазы в печени зачастую долго не вызывают симптомов — орган довольно большой и какое-то время может функционировать, несмотря на поражение опухолью. Время возникновения и выраженность симптомов зависят от количества, расположения и размеров опухолевых очагов. Отмечается потеря аппетита и снижение веса, тошнота, повышенная утомляемость, слабость, чувство дискомфорта, боли в животе. При нарушении оттока желчи развивается механическая желтуха. Возникает асцит – состояние, при котором в брюшной полости скапливается жидкость. [9]
Патогенез метастазов опухоли
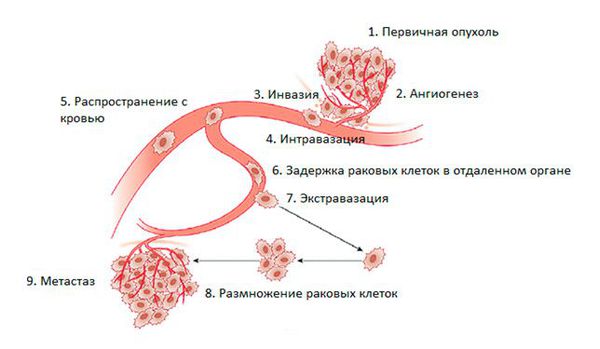
Метастазирование — сложный процесс. В нём выделяют пять основных этапов.
На этапе I происходит инвазивный рост. Это общая особенность всех злокачественных опухолей — они могут прорастать в окружающие ткани и распространяться на соседние органы [1] [10]
Пути метастазирования
В зависимости от путей распространения выделяют следующие виды метастазов:
Также выделяют следующие пути распространения метастазов:
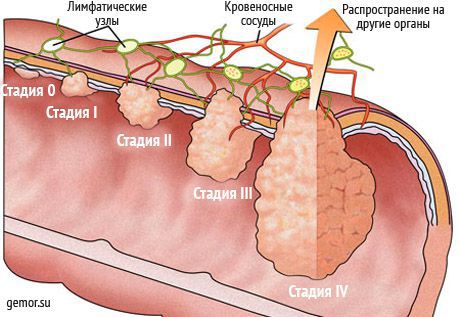
Классификация и стадии развития метастазов опухоли
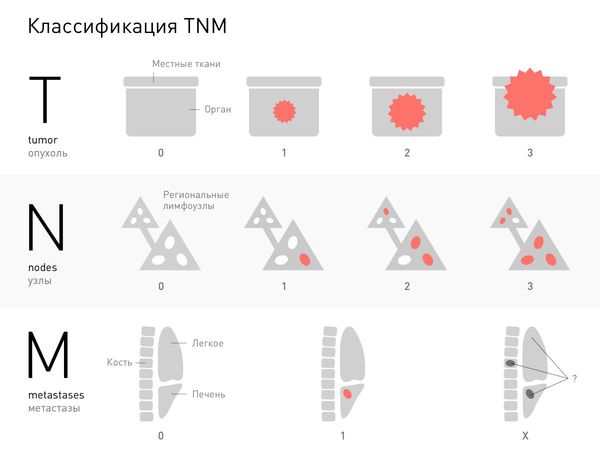
Практически для всех злокачественных опухолей стадию определяют в соответствии с общепринятой международной системой TNM. Буква T обозначает характеристики первичной опухоли. Указывают цифры от 1 до 4, они обозначают степень прорастания злокачественной опухоли вглубь органа, в окружающие ткани. Буква N обозначает распространение рака в регионарные лимфатические узлы. Если очагов в лимфоузлах нет, указывают N0, цифры 1 и 2 обозначают разные степени их вовлеченности.
В соответствии с другой классификацией, выделяют четыре стадии распространения злокачественных опухолей в организме:
Осложнения метастазов опухоли
Именно осложнения становятся причиной гибели большинства онкологических больных.
Гиперкальциемия развивается при костных метастазах. Уровень кальция в крови повышается из-за разрушения костной ткани и выработки опухолевой тканью биологически активных веществ. Больного беспокоит жажда, сухость во рту, тошнота и рвота, запоры, увеличивается количество мочи. В тяжелых случаях развиваются тяжёлые нарушения функции почек, помрачение сознания. Возникает угроза для жизни пациента.
Диагностика метастазов опухоли
Диагностика онкологических заболеваний состоит из нескольких этапов. На первом этапе проводят относительно простые, недорогие и широко доступные методы диагностики: они позволяют обнаружить в том или ином органе новообразование. Но пока нельзя точно сказать, является ли оно злокачественной опухолью. Диагноз нужно уточнить, обычно для этого прибегают к биопсии. Врач получает фрагмент подозрительной ткани и отправляет в лабораторию для цитологического и гистологического исследования. Если в образце обнаружены раковые клетки, диагностируют злокачественную опухоль.
Далее нужно уточнить стадию рака и выяснить, есть ли вторичные очаги в других органах. Для этого применяют:
Лечение метастазов опухоли
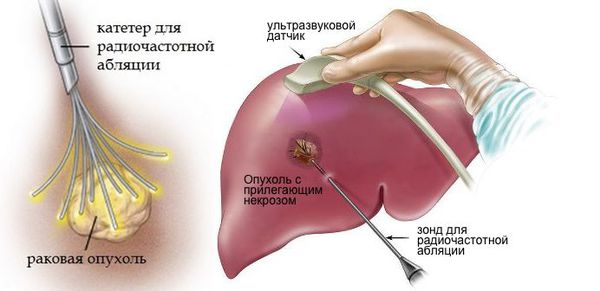
Лечение рака с метастазами — сложная задача. В редких случаях, когда имеются единичные очаги, их можно удалить, как и первичную опухоль. Помимо хирургических вмешательств, применяются некоторые специальные методы лечения. Например, некоторые метастазы в головном мозге можно уничтожить с помощью стереотаксической радиохирургии — аппарата «гамма-нож».
К сожалению, в большинстве случаев во время обследования оказывается, что метастазов уже много, они находятся в разных органах, и многие из них имеют очень мелкие размеры. В этом случае их уже нельзя удалить. Больному назначается системная терапия:
Также применяют лучевую терапию. Все эти методы лечения врач может комбинировать.
Многих пациентов при злокачественных опухолях с метастазами беспокоят мучительные боли и другие симптомы, противоопухолевые препараты могут вызывать серьезные побочные эффекты. Поэтому важно проводить симптоматическую, поддерживающую терапию.
Прогноз. Профилактика
Эти средние показатели рассчитаны на основе статистики пациентов, у которых диагноз злокачественной опухоли был установлен минимум 5 лет назад. Они не отражают точного прогноза для конкретного больного. В настоящее время появляются новые препараты, подходы, и при некоторых типах рака пятилетняя выживаемость увеличивается.
Можно ли вылечить рак с метастазами
Рак с метастазами чаще всего неизлечим, но правильная терапия помогает продлевать жизнь пациентов и избавлять их от мучительных симптомов. Некоторые больные могут прожить еще довольно долго, не испытывая симптомов и ведя активную жизнь, несмотря на то, что в их теле есть злокачественная опухоль.
Важная мера профилактики метастатического рака — ранняя диагностика онкологических заболеваний. Для этого применяют скрининговые исследования. Важно обращать внимание на любые необычные, длительно сохраняющиеся симптомы, и своевременно обратиться к врачу.
Если рак диагностирован на ранней стадии, и его можно устранить хирургически, во время операции врач должен полностью удалить злокачественную опухоль с окружающими тканями. Нужно достичь отрицательного края резекции: когда по результатам биопсии вблизи разреза нет опухолевых клеток. При повышенном риске рецидива хирургическое вмешательство дополняют химиотерапией, лучевой терапией.
Метастазы при раке: возможности лечения
Что такое местастазы? Как они возникают? Прогноз заболевания при метастазах в печени? Сколько живут с метастазами? Возможное лечение метастазов в легких, в костях и других органах.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Что такое метастазы при раке?
Раковые метастазы всегда близки по структуре к клеткам первичной опухоли. По мере увеличения количества клеток в метастатических очагах, они начинают выделять вещества, которые стимулируют активное «питание» опухоли. Так как опухолевые клетки характеризуются быстрым ростом, то они забирают питательные вещества, предназначенные здоровым клеткам. Именно это вызывает раковую интоксикацию и истощение онкологического пациента.
Образование метастазов является одним из главных и принципиальных отличий злокачественных опухолей от доброкачественных.
Наш многолетний опыт подтверждает, что правильно назначенное лечение метастазов при раке позволяет существенно облегчить симптомы, увеличить продолжительность жизни пациента с онкологическим диагнозом и улучшить ее качество.
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Как проявляются метастазы?
Метастазирование начинается с проникновения клеток первичной опухоли в окружающую соединительную ткань. Высвобождение их из первичного очага происходит в результате ослабления связи между отдельными опухолевыми клетками, под действием механического давления или вследствие продукции специфических белков, нарушающих соединительнотканный каркас опухоли.
Затем эти клетки мигрируют в кровеносные и лимфатические сосуды и образуют метастазы в органах – мишенях благодаря повышенной способности прикрепляться к чужеродному субстрату. Усиленное прорастание в опухоль кровеносных сосудов способствует процессу метастазирования.
Появление метастазов при раке существенно нарушает функционирование органов и систем в организме.
Как происходит процесс метастазирования, можно посмотреть на видео:
Выражаем благодарность авторам ролика за предоставленную возможность использовать видеоматериал.
Локализация метастазов
Около 6% злокачественных образований составляют метастазы без первичного очага. В таком случае диагноз устанавливают с помощью биопсии из метастатического очага. Морфологические данные могут предположительно указать на характер первичной опухоли (например, аденокарцинома), степень дифференцировки опухолевых клеток (низкодифференцированная или высокодифференцированная) и локализацию.
На какой стадии рака появляются метастазы?
В настоящее время не существует никакой методики, с помощью которой можно было бы установить наличие в организме скрытых метастазов в виде микроскопических комплексов опухолевых клеток.
Именно поэтому назначается адъювантная (послеоперационная) системная терапия (химио, гормональная или таргетная) при некоторых онкологических заболеваниях даже на ранних стадиях после радикальных хирургических вмешательств (например, при раке молочной железы).
Симптомы метастазов
Как метастазы влияют на прогноз заболевания?
Метастазы, как и первичная опухоль, сильно нарушают работу организма — они провоцируют раковую интоксикацию, выделяя токсины и биологически активные вещества, разрушая здоровую ткань вокруг них, распадаясь и отравляя организм.
Поэтому наличие отдалённых метастазов значительно ухудшает прогноз, однако есть опухоли, которые остаются потенциально излечимыми и в стадии диссеминации (например, опухоли яичка, некоторые лимфомы, опухоли у детей).
Лечение рака с метастазами с помощью современной противоопухолевой терапии (цитостатической, гормональной, таргетной) может существенно продлить жизнь пациента от нескольких месяцев до нескольких лет при многих онкологических заболеваниях, даже в случае выявления отдалённых вторичных очагов.
Диагностика метастазов
Для диагностики метастазов может использоваться компьютерная и магнитно-резонансная томография, рентгенография, ультразвуковое, радиоизотопное исследование. Информативность разных методов зависит от исследуемой области, типа опухоли. Конкретный диагностический метод назначает только лечащий врач-онколог. Иногда для уточнения диагноза необходимо выполнить биопсию метастатического образования с последующим гистологическим и иммуногистохимическим исследованием.
Каждый пациент, получающий лечение в нашем центре, находится в одних руках – под наблюдением своего лечащего врача, который своевременно назначает необходимое диагностическое исследование для оценки эффекта лечения.
Лечение метастазов
В большинстве случаев при выявлении метастазов (за исключением их локализации в регионарных лимфоузлах) проводится паллиативная системная терапия не с целью полного излечения, а для продления жизни и улучшения её качества. В зависимости от особенностей заболевания применяется химиотерапия или гормонотерапия, таргетные, иммунные и радиофармацевтические препараты.
Иногда при лечении метастатических опухолей требуется другой подход. В некоторых ситуациях может быть рекомендовано хирургическое удаление одиночных метастазов (например, при колоректальном раке, при опухоли почки, при меланоме). Выполняются также циторедуктивные операции, позволяющие уменьшить объём опухоли и улучшить результат системной терапии.
Таким образом, в настоящее время существует много возможностей для того, чтобы помочь пациентам с распространённой стадией онкологического заболевания.
Опыт наших онкологов по лечению метастатического рака подтверждает, что правильно назначенная системная терапия позволяет существенно улучшить качество жизни пациента и ее длительность.
Отзывы
Со словами огромной благодарности в адрес Андрея Сергеевича от всей нашей семьи! Спасибо за Профессионализм, неравнодушие и понимание! Нашли клинику случайно, но ни разу не пожалели, лечим папу, надеемся и верим. Андрей Сергеевич тот врач, которому веришь, а это большая редкость даже в платной медицине. Девушкам-администраторам отдельное спасибо, с первых шагов по центру атмосфера участия, внимательности! Всем здоровья! …
Читать полностью
Маргарита 16.01.2017 09:41:00
Со словами огромной благодарности в адрес Андрея Сергеевича от всей нашей семьи! Спасибо за Профессионализм, неравнодушие и понимание! Нашли клинику случайно, но ни разу не пожалели, лечим папу, надеемся и верим. Андрей Сергеевич тот врач, которому веришь, а это большая редкость даже в платной медицине. Девушкам-администраторам отдельное спасибо, с первых шагов по центру атмосфера участия, внимательности! Всем здоровья!
Мы обратились в клинику Де Вита 6 месяцев назад, лечим здесь отца. За это время ему стало намного лучше, отступила боль, вернулись жизненные силы и хорошее настроение.
Огромное спасибо Светлане Николаевне за грамотно подобранное лечение и особый подход к пациентам, а также всему персоналу клиники. Мы очень рады, что попали именно сюда. …
Читать полностью
Мы обратились в клинику Де Вита 6 месяцев назад, лечим здесь отца. За это время ему стало намного лучше, отступила боль, вернулись жизненные силы и хорошее настроение.
Огромное спасибо Светлане Николаевне за грамотно подобранное лечение и особый подход к пациентам, а также всему персоналу клиники. Мы очень рады, что попали именно сюда.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Во власти опухоли: почему метастазы так сложно остановить?
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда в организме случилось несчастье, и из 100 триллионов нормальных клеток хоть одна переродилась в раковую и не была уничтожена, срабатывает спусковой крючок, и запускается рост опухоли. Постепенно она приспосабливает к себе окружающие клетки, а также оказывает значительное влияние на весь организм. С развитием заболевания некоторые раковые клетки покидают опухоль и формируют метастазы — вторичные очаги опухолевого роста. Зачастую своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, что первичная опухоль способна «обучать» микроокружение в очагах развития будущих метастазов уже на ранних этапах своего роста. Кроме того, метастазные раковые клетки перепрограммируют экспрессию своих генов так, чтобы лучше прижиться в новом месте обитания. Знание того, как предотвратить эти процессы, а не только рост первичной опухоли, поможет спасти до 90% людей, умирающих от основных видов рака.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Революция в понимании природы метастазирования
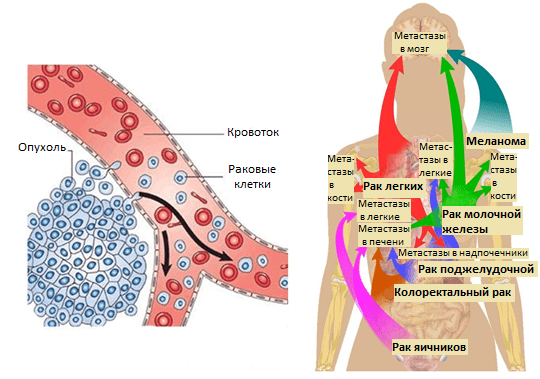
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
Процесс рассеивания раковых клеток по организму, названный метастазированием (от древнегреч. «менять, переносить»: meta — «через» + histanai — «устанавливать»), впервые описал еще в 1889 году Стивен Педжет [4], но механизм его развития оставался загадкой для ученого сообщества долгое время (рис. 2).
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Педжет провел аналогию такого распространения раковых клеток с прорастанием семян. Они тоже выживают и делятся на плодотворной «почве» — в подходящем микроокружении. В те времена невозможно было найти этому экспериментального подтверждения, и долго преобладала совсем иная теория — Джеймса Юинга (рис. 2). Он утверждал, что основную роль в распределении метастазов по организму играет динамика кровотока и устройство сосудистой системы.
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
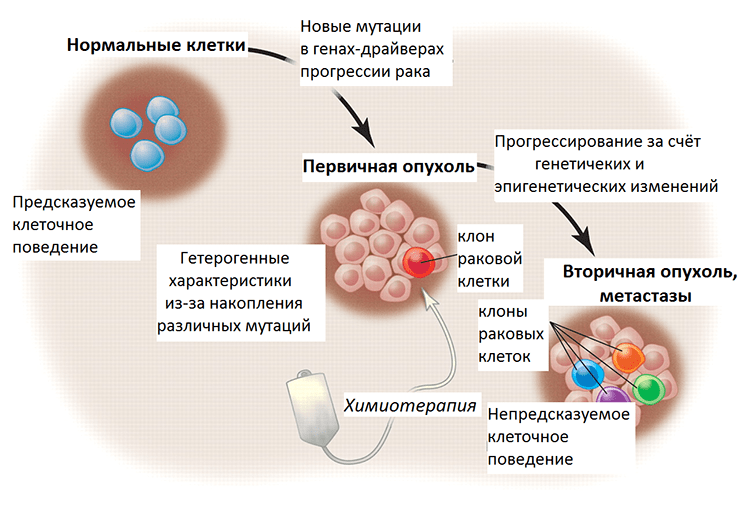
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
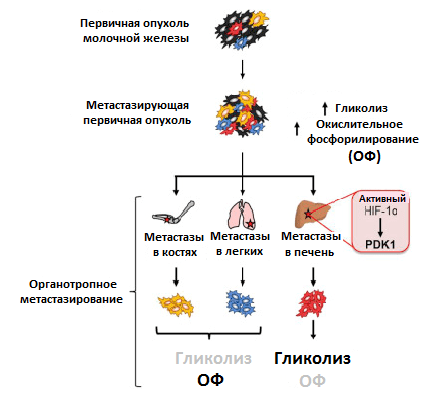
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
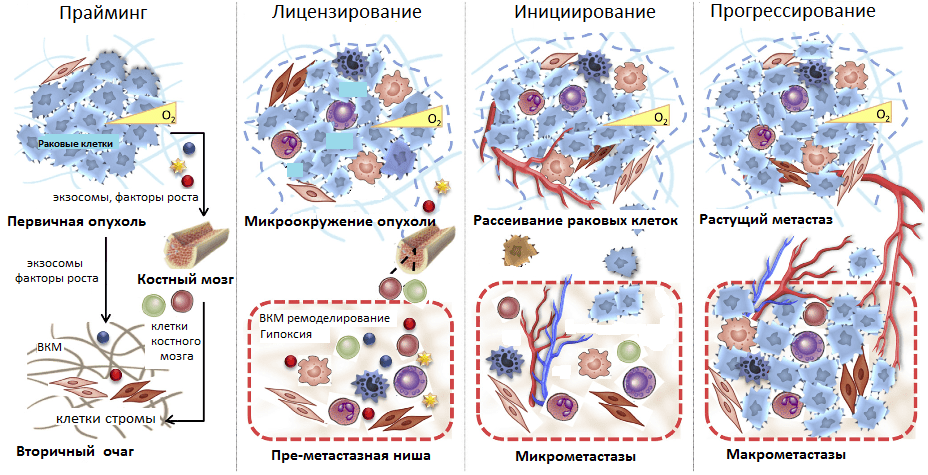
И все же метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей — освоением совершенно незнакомого места обитания. Эксперименты группы Дэвида Лидена в 2005 году впервые показали, что первичная опухоль за счет продуцируемых факторов стимулирует формирование так называемых преметастазных ниш в различных органах. Ученые показали, что раковые клетки первичной опухоли за счет стимулирования рецептора фактора роста сосудов (VEGFR-1) на миелоидных клетках-предшественниках активируют их распространение из костного мозга в известные очаги развития метастазов [13]. Кроме того, в этих очагах запускается избыточная экспрессия фибробластами одного из компонентов внеклеточного матрикса (ВКМ) — фибронектина. Миелоидные клетки-предшественники, имея рецепторы клеточной адгезии (интегрины) к этому белку, активно «ловятся на удочку» и заселяют преметастазные ниши. Они секретируют воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Это способствует ремоделированию стромы и колонизации ее метастазами (рис. 5) [13].
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
Хотя для большинства органов характерна эта общая схема, существуют некоторые особенности в зависимости от места (органа) формирования ниши. Например, преметастазная ниша в печени и легких также формируется за счет привлечения нейтрофилов. Известно, что они могут помогать метастазирующим клеткам при интеграции в новую нишу за счет секретирования протеаз, цитокинов и непосредственного контакта с раковыми клетками при выходе из капилляров. Другой пример — клетки рака поджелудочной железы. Они выделяют экзосомы — липидные везикулы, которые переносят макрофаг-ингибирующий фактор (MIF). Их поглощают клетки Купфера в печени, и это запускает цепочку обучения ниши. Клетки Купфера синтезируют трансформирующий фактор роста β (TGF-β), клетки Ито активируются им и запускают перестраивание ВКМ, затем привлекая к нему макрофагов [15]. Их роль в микроокружении опухоли подробнее рассмотрена в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [16].
Метастазы в костях — одни из самых коварных, и их преметастазная ниша по-своему особенна. Например, оказалось, что при раке молочной железы только раковые клетки без рецепторов к эстрогену метастазируют в кости. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях он вызывает образование взрослых остеокластов и за счет этого стимулирует резорбцию кости. [17]. Именно эти «емкости» внутри кости метастазы занимают позднее. Другая и, пожалуй, основная функция лизилоксидазы — формирование поперечных связей между коллагеновыми волокнами ВКМ — также связана с образованием преметастазных ниш, но в легких. Преобразование коллагеновых волокон привлекает миелоидные клетки, а те позднее разрушают коллагеновые сети и дают путь раковым клеткам при заселении ткани легкого [18].
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
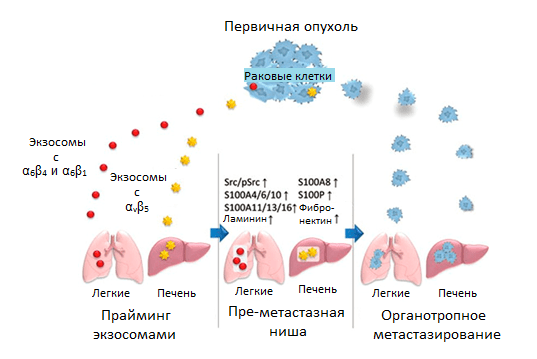
Ключевой механизм, известный на данный момент, основан на обучении будущих очагов рассеивания метастазов с помощью специфичных к ним экзосом. Эти везикулы, ранее описанные в статье «Экзосома — механизм координации и взаимопомощи клеток организма» [20], представляют собой структуры с рецепторами на своей поверхности и генетическим и секретируемым материалом внутри. Ученые провели интересный эксперимент — выделили экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и пр.) и, внедрив их в кровоток мышей с отличным типом опухоли, показали, что с их помощью возможно перепрограммировать распределение метастазов по органам. Это обусловлено тем, что экзосомы разных типов рака преимущественно содержат на своей поверхности основные рецепторы адгезии, интегрины, специфичные к определенному белку ВКМ (к ламинину — α6β4 и α6β1; к фибронектину — αvβ5 и т.д.).
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
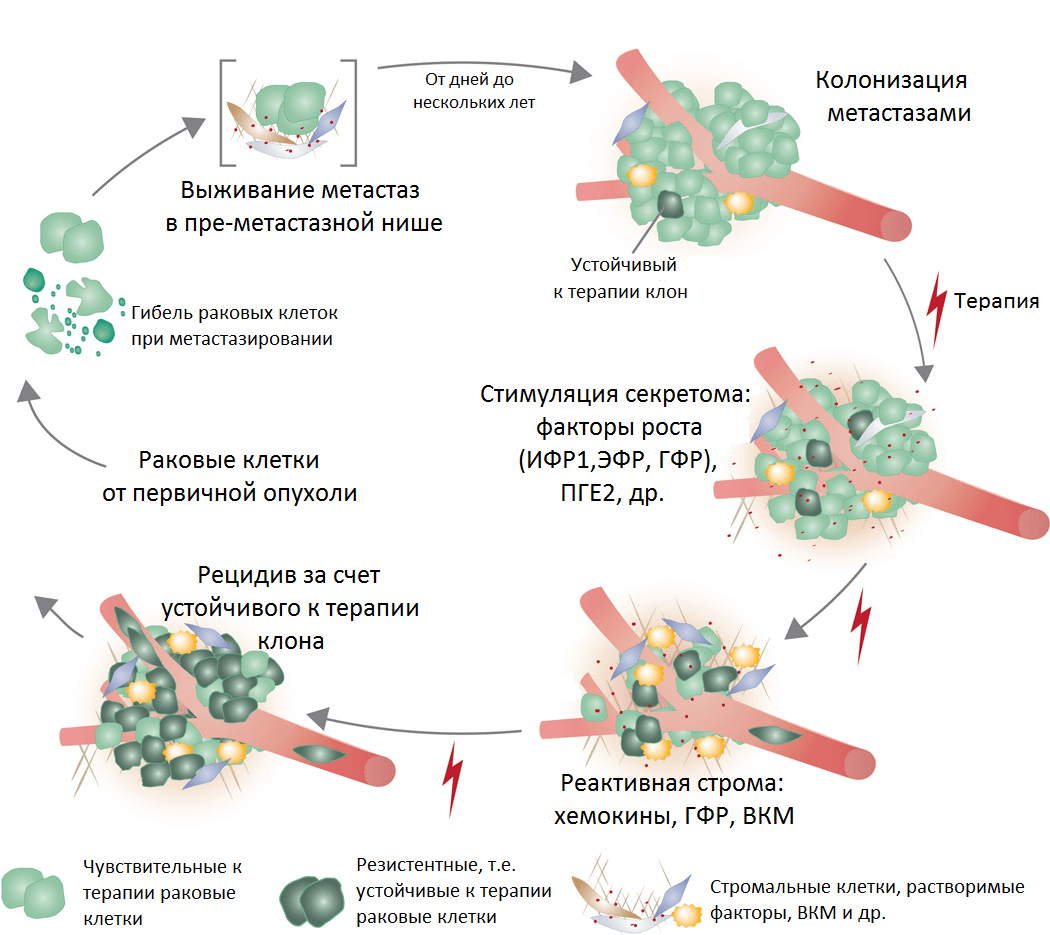
Мы также знаем, что после химиотерапии зачастую выживают субклоны раковых клеток с полезными в новой среде мутациями. Под стрессом воздействия цитостатиков субклоны раковых клеток активируют секрецию факторов роста и запускают клеточную сигнализацию, препятствующую гибели (рис. 7). Кроме того, их выживанию помогает поддержка клеток стромы, заодно изменяющих свое поведение на «оборонительное» под эффектом терапии.
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.