Чем определяются общие свойства оснований в химии
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Основания — классификация, получение и свойства
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
Получение оснований
Взаимодействие активных металлов с водой (только щелочи)
Взаимодействие основных оксидов с водой (только щелочи)
Взаимодействие солей со щелочами (малорастворимые основания)
Электролиз водных растворов солей (промышленный способ)
Химические свойства оснований

В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
Многоосновные основания диссоциируют ступенчато:
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
4) Взаимодействие с солями
2Fe 3+ + 6OH — = 2Fe(OH)3.
5) Термическое разложение
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
6)Взаимодействие с неметаллами
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
Основания (гидроксиды). Свойства, получение, применение

Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Классификация оснований
Основания можно классифицировать по следующим признакам:
Изменение цвета индикаторов:
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
Чем определяются общие свойства оснований в химии
Общие свойства оснований
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Амфотерный гидроксид (основная и кислотная форма)
Кислотный остаток и его валентность
Химические свойства оснований
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням:
Fe(OH)2 
FeOH + 
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН – (щелочь) 
4 ) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn ):
В растворе: 2 Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
5 ) Взаимодействие щелочей с неметаллами:
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
7) Взаимодействие оснований с кислотами:
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
9 ) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание :
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
1) Взаимодействием оксида металла с водой:
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
3 ) Электролизом растворов солей:
2NaCl + 2H2O 
Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
Теория к заданию 31 из ЕГЭ по химии
Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма | —-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ | $Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа | —-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ | $Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа | —-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ | $Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
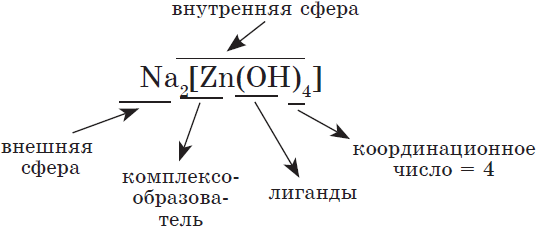
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
Разделение кислот на группы по различным признакам представлено в таблице.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные | $H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные | $HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые | $H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие | $H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые | $H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные | $H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| $<\text"Простые вещества">/<\text"Кислоты">$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная | $Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ | $Al(NO_3)_3$ $NH_4NO_3$ $N_2$ | $Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ | $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная | $Mg(NO_3)_2$ $N_2O$ | пассивирует | $Zn(NO_3)_2$ $N_2O$ | пассивирует |
| $H_2SO_4$ разбавленная | $MgSO_4$ $H_2$ | $Al_2(SO_4)_3$ $H_2$ | $ZnSO_4$ $H_2$ | $FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая | $MgSO_4$ $H_2S$ | $Al_2(SO_4)_3$ $H_2S$ | $ZnSO_4$ $H_2S$ $S$ | $Fe_2(SO_4)_3$ $SO_2$ $S$ |
| $<\text"Простые вещества">/<\text"Кислоты">$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ | $Cr(NO_3)_3$ $NO$ | $Cu(NO_3)_2$ $NO$ | $H_3PO_4$ $NO$ | $H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ | $H_3PO_4$ $N_2O$ | $H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ | $CrSO_4$ $H_2$ | — | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ | $Fe_2(SO_4)_3$ $SO_2$ | $CuSO_4$ $SO_2$ | $H_3PO_4$ $SO_2$ | $SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Последние диссоциируют так:
Свойства солей
Типичные реакции солей.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
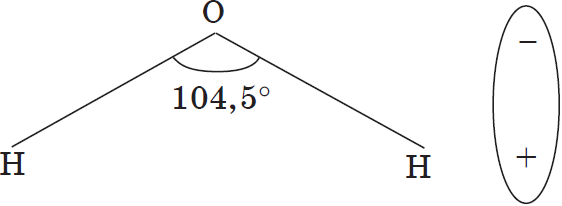
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
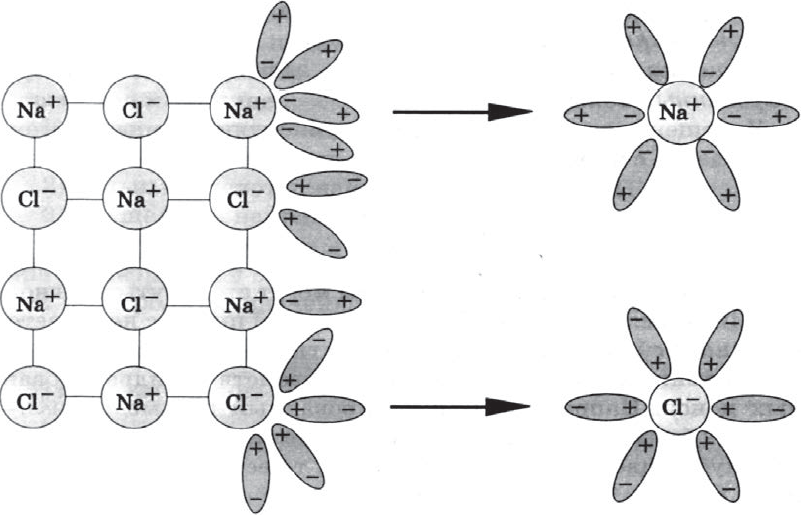
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
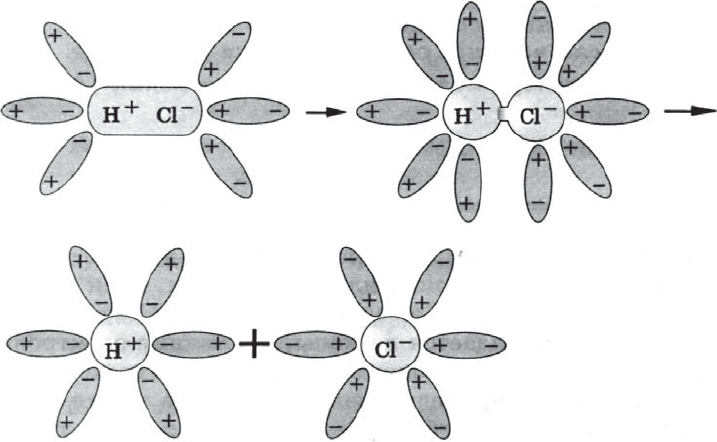
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
Степень электролитической диссоциации
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^<+>, Na^<+>, NH_4^<+>, Cu^<2+>$) равна сумме зарядов анионов ($Cl^<–>, OH^<–>, SO_4^<2−>$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
— с основными оксидами:
— с нерастворимыми основаниями:
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
б) малодиссоциирующие (слабые электролиты);
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.