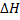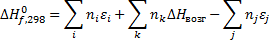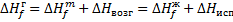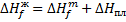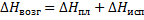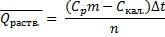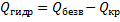Чем определяется знак теплоты растворения химического соединения
Большая Энциклопедия Нефти и Газа
Знак теплоты растворения определяется тем процессом, который энергетически сильнее выражен. Так, при растворении газов выделение теплоты в процессе сольватации количественно превышает затраты энергии на разъединение молекул растворителя, на равномерное распределение молекул газа по объему раствора и на их возможную ионизацию. Поэтому в целом газ растворяется в жидкости с выделением теплоты. Для многих кристаллических солей при сольватации выделяется меньше теплоты, чем поглощается в процессе разрушения решетки, и поэтому теплота растворения положительна. При обратном соотношении теплот растворение происходит экзотермически. [1]
Знак теплоты растворения определяется тем процессом, который энергетически сильнее выражен. Так, при растворении газов выделение теплоты в процессе сольватации количественно превышает затраты энергии на разъединение молекул растворителя, на равномерное распределение люлекул газа по объему раствора и на их возможную ионизацию. Поэтому в целом газ растворяется в жидкости с выделением теплоты. Для многих кристаллических солей при сольватации выделяется меньше теплоты, чем поглощается в процессе. При обратном соотношении теплот растворение происходит экзотермически. [2]
Было найдено что величина и знак теплоты растворения металлов в ртути зависит от расположения их в периодической системе элементов по отношению к ртути. Растворение некоторых элементов, образующих с ртутью интерметаллические соединения, сопровождается большими тепловыми эффектами. [4]
Было найдено41, что величина и знак теплоты растворения металлов в ртути зависит от расположения их в периодической системе элементов по отношению к ртути. Растворение некоторых элементов, образующих с ртутью интерметаллические соединения, сопровождается большими тепловыми эффектами. [5]
Таким образом, знак производной зависит от знака теплоты растворения и разности между теплотой гидратации катиона и известной частью энергии решетки. [6]
Важно отметить, что И. Ф. Шредер, продолжая исследования в области растворов, начатые в Горном институте В. Ф. Алексеевым, указывал на приоритет последнего в открытии соотношений между переменой знака теплоты растворения и прохождения кривой через минимум, выражающий зависимость величины растворимости от температуры. [7]
Точность вычислений температуры кипения с учетом уравнения (8.7) удовлетворительна только для разбавленных растворов. Расчетное значение температуры кипения концентрированных растворов необходимо корректировать в зависимости от знака теплоты растворения неорганического компонента в воде. При экзотермическом или эндотермическом растворении вычисленное значение 7 кип необходимо увеличивать или уменьшать соответственно на поправку Стабникова, составляющую от 0 9 до 3 6 К в зависимости от активности воды и давления пара в системе над кипящим раствором при разрежении. [10]
Теплота растворения твердого соединения с ионной кристаллической решеткой определяется в основном суммой двух величин: теплоты Разрушения кристаллической решетки и теплоты сольватации ионов молекулами растворителя. В связи с тем, что на разрушение кристалла теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрицательным в зависимости от того, какое из двух слагаемых больше по абсолютной величине. [12]
Термохимия. Закон Гесса
Раздел физической химии, изучающий тепловые изменения при химических реакциях, называется термохимией.
Тепловым эффектом химической реакцииназывается количество теплоты, которое выделяется или поглощается в процессе, протекающем необратимо при условии, что объем или давление в системе постоянны, не совершается никакой работы, кроме работы расширения, а температура исходных веществ и продуктов реакции одинакова.
Тепловые эффекты, отнесенные к стандартным условиям (25 °С (298,15 К). 101325 Па) называют стандартными тепловыми эффектами. В качестве стандартного состояния для простых веществ принимают устойчивое фазовое и химическое состояние элемента при данной температуре.
Для расчета тепловых эффектов химических реакций используют термохимические уравнения, в которых указываются агрегатные состояния участвующих в реакции веществ, полиморфная модификация (для твердых веществ), тепловой эффект или изменение энтальпии реакции, рассчитанные для стандартных условий.
В термохимии, в отличие от термодинамики принята следующая система знаков: теплота считается положительной, если она выделяется в окружающую среду, т.е. если энтальпия системы уменьшается (

Расчеты в термохимии основаны на законе Гесса (1836): тепловой эффект химической реакции не зависит от пути её протекания, а определяется лишь начальным и конечным состоянием системы при р = const или V= const.
Обычно для расчетов используется не сам закон Гесса, а следствия из него.
Следствие 1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ с учетом их стехиометрических коэффициентов.
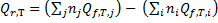
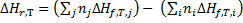
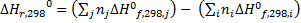
Стандартной энтальпией образования вещества ( 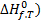
Согласно этому определению, энтальпии образования наиболее устойчивых простых веществ в стандартном состоянии равны нулю при любой температуре. Стандартные энтальпии образования веществ при температуре 298 К приведены в справочниках.
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
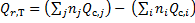
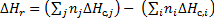
Энергией связи А-В называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечно большое расстояние. Энергия связи всегда положительна.
Приближенно энтальпии образования газообразных соединений по энергиям связей можно рассчитать по уравнению:
Метод расчета теплот (энтальпий) образования по энергиям связи целесообразно применять для алифатических органических соединений.
Зная энтальпию образования химического соединения в одном агрегатном состоянии, можно на основе закона Гесса вычислить энтальпию его образования в другом агрегатном состоянии:
Где 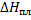
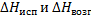
При термохимических расчетах для реакций, протекающих в растворах, надо учитывать тепловые эффекты (энтальпии) процессов растворения химических соединений в данном растворителе. Тепловой эффект (энтальпия) образования химического соединения в растворе, диссоциирующего в нем на ионы, определяется по теплотам (энтальпиям) образования ионов в растворе.
Теплота растворения твердого соединения с ионной кристаллической решеткой определяется в основном суммой двух величин: теплоты разрушения кристаллической решетки и теплоты сольватации ионов молекулами растворителя. В связи с тем, что на разрушение кристалла теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрицательным в зависимости от того, какое из двух слагаемых больше по абсолютной величине.
Под интегральной теплотой растворения понимают теплоту растворения 1 моля вещества в бесконечно большом количестве растворителя. Если растворитель химически взаимодействует с растворяемым веществом или вещество, растворяясь, подвергается ионизации, то теплоты растворения таких веществ, указанные в справочниках, включают в себя теплоту сольватации (гидратации) или теплоту ионизации.
При измерении теплоты растворения растворяют g г исследуемого вещества в G г растворителя и определяют при помощи термометра Бекмана изменение температуры.
Расчет ведут по формуле:
Для вычисления теплоты растворения 1 моля минеральной кислоты в п молях воды пользуются эмпирическими формулами:
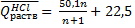
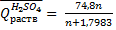
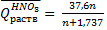
При растворении кристаллогидратов наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Разность между теплотой растворения безводной соли 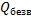
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Теплота растворения солей таблица
Количество тепла, которое выделяется или поглощается при растворении 1 моля вещества в таком количестве растворителя, дальнейшее прибавление которого уже не вызывает изменения теплового эффекта, называется теплотой растворения.
При растворении солей в воде знак и величина теплового эффекта растворения ∆Н определяется двумя величинами: энергией, затрачиваемой на разрушение кристаллической решетки вещества (∆H1) – эндотермический процесс, и энергией, выделяемой при физико-химическом взаимодействии частиц растворяемого вещества с молекулами воды (процесс гидратации) (∆Н2) – экзотермический процесс. Тепловой эффект процесса растворения определяется алгебраической суммой тепловых эффектов этих двух процессов:
Тепловой эффект процесса растворения может быть как положительным, так и отрицательным.
Для практического определения теплот растворения обычно определяют количество тепла, поглощаемого или выделяемого при растворении произвольного количества соли. Затем эту величину пересчитывают на 1 моль, так как количество тепла прямо пропорционально количеству растворенного вещества.
Для термохимических измерений используют прибор, называемый калориметром.
Определение теплоты растворения ведут по изменению температуры раствора, поэтому точность определения зависит от цены деления (точности) используемого термометра. Обычно диапазон измеряемых температур лежит в интервале 2-3°С, а цена деления термометра не более чем 0,05°С.
ХОД РАБОТЫ
Для выполнения работы используйте калориметр, состоящий из теплоизоляционного корпуса, крышки со встроенными электрической мешалкой и термометром, а также отверстием с пробкой.
Получите у преподавателя задание: тип растворяемого вещества.
Откройте пробку на крышке калориметра и залейте в него 200 мл воды, закройте пробку и выдержите 10-15 минут для установления постоянной температуры (tнач). За это время на весах, используя кальку или часовое стекло, получите навеску вашего вещества (1,5 – 2,0 г) предварительно тщательно растертого в ступке. Полученную навеску, по возможности быстро, через отверстие в крышке поместите в калориметр при включенной мешалке. Следите за изменением температуры. После установления теплового равновесия (температура стабилизируется) запишите максимальную температуру раствора (tmaх)и рассчитайте ∆t = tmax – tнач. По полученным данным рассчитайте теплоту растворения соли, используя уравнение:
где q – теплота, выделившаяся (или поглотившаяся) в калориметре (кДж); m – навеска соли (г); М – молярная масса растворяемого вещества (г/моль);
Теплота q определяется на основании экспериментальных данных из соотношения:
где mст – масса стакана (г); mр-ра – масса раствора, равная сумме масс воды и соли в стакане (г); Сст– удельная теплоемкость стекла 0,753 Дж/г∙К;
Ср-ра – удельная теплоемкость раствора (воды) 4,184 Дж/г∙К.
Теплота гидратации соли и её определение
Физико-химический процесс взаимодействия частиц растворенного вещества с молекулами воды (растворителя) называется гидратацией. В процессе гидратации образуются сложные пространственные структуры, называемые гидратами, и при этом в окружающую среду выделяется энергия в виде тепла.
Тепловой эффект реакции образования 1 моль гидратированной соли из безводной соли называется теплотой гидратации.
При растворении в воде безводной соли, способной образовывать гидраты, последовательно протекают два процесса: гидратация и растворение образовавшегося кристаллогидрата. Например:
Растворение электролитов сопровождается процессом электролитической диссоциации. Теплота гидратации молекулы равна сумме теплот гидратации образовавшихся при этом ионов с учетом теплоты диссоциации. Процесс гидратации-экзотермический.
Приближенно теплота гидратации вещества может быть определена как разность между теплотами растворения безводной соли и ее кристаллогидрата:
где ∆Hгидр – теплота гидратации молекул;
∆Hбезв – теплота растворения безводной соли;
∆Hкрист – теплота растворения кристаллогидрата.
Таким образом, для определения теплоты гидратации молекул необходимо предварительно определить теплоту растворения безводной соли и теплоту растворения кристаллогидрата этой соли.
ХОД РАБОТЫ
Теплоту растворения безводного сульфата меди CuS04 и кристаллогидрата CuS04×5H20 необходимо определить, используя лабораторный калориметр и методику проведения работы 1.
Для более точного определения теплоты гидратации необходимо получить навески по 10-15 г кристаллогидрата и безводной соли сульфата меди. Необходимо знать, что безводная соль меди легко поглощает воду из воздуха и переходит в гидратированное состояние, поэтому безводную соль необходимо взвешивать непосредственно перед опытом. По полученным данным необходимо рассчитать теплоты растворения безводной соли и кристаллогидрата, а затем из соотношения (3) определить теплоту гидратации. Рассчитайте относительную ошибку опыта в процентах, используя полученные данные и данные табл.2.
Взвешивают 5 г KNO3 и растворяют его в 75 мл воды. Записывают температуру раствора. Фиксируют изменение температуры только за счет проводимого процесса, поэтому опыт делят на три периода (для введения поправки на теплообмен):
а) начальный, продолжающийся не менее 5 мин;
б) главный – время протекания исследуемого процесса;
в) заключительный, сопровождающийся линейным изменением температуры.
Зафиксированную температуру записывают в тетрадь.
Зависимость изменения температуры раствора от времени
| Время от начала опыта, мин. | температура t, ˚С |
| 0,5 |
По экспериментальным данным строят зависимость изменения температуры во времени (рис. 2). Все построения выполняют на миллиметровой бумаге.
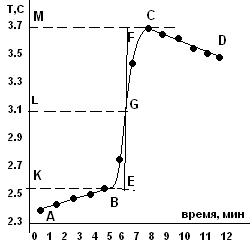
Рис. 2. Изменение температуры во времени.
Начальный период (участок АВ на рис. 2) служит для установления постоянной скорости теплообмена калориметра с окружающей средой в исходных условиях. Температура системы со временем может снижаться либо расти в зависимости от начальной разности температур воды в калориметрическом сосуде и окружающей среды. После установления равномерного изменения температуры следует провести, как минимум, десять измерений с интервалом 30 с.
После установления постоянной скорости теплообмена в калометрическом сосуде проводят химическую реакцию, в результате которой происходит выделение или поглощение тепла. Этот процесс – главный период (участок ВС на рис. 2 для экзотермической реакции). Продолжительность этого периода зависит от скорости процесса.
По окончании процесса происходит теплообмен калориметрической системы с окружающей средой, и время после установления постоянной скорости теплообмена называется конечным периодом (отрезок CD на рис. 2).
Истинное изменение температуры в ходе калориметрического опыта определяют графически. Для этого строят зависимость температуры от времени как на рис. 2. Точки С и В проектируются на ось ординат. Участок МК делится пополам и через точку L проводится прямая, параллельная оси абсцисс до пересечения с экспериментальной кривой в точке G, через которую проводится прямая, параллельная оси ординат. Отрезки АВ и CD, соответствующие начальному и конечному периодам, экстраполируют до пересечения с этой вертикальной прямой.
Отрезок EF показывает изменение температуры опыта с учетом поправки на теплообмен. Полученное с помощью графика изменение температуры ΔТ = EF соответствует изменению температуры при растворении соли или в ходе реакции, которое имело бы место, если бы удалось исключить теплообмен системы с окружающей средой во время процесса растворения или реакции.
Поскольку процесс в калориметре протекает при постоянном давлении, тепловой эффект изучаемого процесса равен изменению энтальпии системы:
n – число молей реагирующего вещества.
Постоянную калориметра вычисляют по формуле:
Ск = 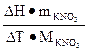
где ΔΗ – теплота растворения KNO3 в воде, значение которой есть в справочниках, mKNO3 – навеска KNO3, МKNO3 – молярная масса KNO3.
ΔΗ (KNO3)= – 35,65 кДж/моль (-8,52 Ккал/моль)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9634 – 

91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Кафедра «Процессы и аппараты химической технологии» МГУИЭ
105066, г. Москва, улица Старая Басманная, дом 21/4
Заведующий кафедрой – доктор технических наук, профессор
Баранов Дмитрий Анатольевич
Телефон: +7-095-267-0767, факс: +7-095-261-6027
Копирование материалов с сайта кафедры ПАХТ без предварительной договорённости запрещено.
Теплота растворения
Калориметрическими методами экспериментально определяется и такая важная величина, как теплота растворения. Она имеет особое значение для фармации, так как приготовление жидких лекарственных форм связано с растворением, главным образом, твёрдых (порошкообразных) лекарственных веществ, а, следовательно, и с тепловым эффектом, возникающим при этом и достигающим иногда значительных величин.
Различают интегральную и дифференциальную теплоту растворения. Теплота растворения 1 моля вещества с образованием т. н. бесконечно разбавленного раствора называется интегральной теплотой растворения. Интегральная теплота растворения зависит от соотношения количеств растворяемого вещества и растворителя и, следовательно, от концентрации образующегося раствора. Тепловой эффект при растворении 1 моля вещества в очень большом количестве уже имеющегося раствора этого же вещества некоторой концентрации (приводящем к бесконечно малому увеличению концентрации) называется дифференциальной теплотой растворения:
Поэтому знак суммарного теплового эффекта при растворении зависит от того, какое из его слагаемых больше по абсолютной величине.
Если известна энтальпия разрушения кристаллической решетки соли, то, измеряя теплоту растворения, можно вычислять энтальпию её сольватации. С другой стороны, измеряя теплоту растворения кристаллогидрата (т. е. гидратированной соли), можно с достаточной точностью вычислить энтальпию разрушения (прочность) кристаллической решётки.
Теплота растворения хлорида калия, равная +17,577 кДж/моль при концентрации 0,278 моль/л и 25 о С, предложена в качестве термохимического стандарта для проверки работы калориметров.
Температурная зависимость теплот растворения, как и тепловых эффектов химических реакций, подчиняется уравнению Кирхгоффа.
Когда растворяемое вещество и растворитель химически подобны и при растворении не возникает осложнений, связанных с ионизацией или сольватацией, теплоту растворения можно считать приблизительно равной теплоте плавления растворяемого вещества. В основном это относится к растворению органических веществ в неполярных растворителях.
Теоретическая часть



Тепловым эффектом химической реакции или какого-либо процесса называется количество теплоты, выделенной или поглощенной системой при отсутствии полезной работы и при одинаковой температуре исходных и конечных веществ. Тепловой эффект реакции зависит от агрегатного состояния и кристаллической модификации реагирующих веществ.
Химические реакции обычно протекают при постоянном давлении (открытая колба) или при постоянном давлении (в автоклаве), то есть являются соответственно изобарными (V=const) или изохорными (Р=const) процессами.
Процессы, сопровождающиеся выделением теплоты, называются экзотермическими а процессы, при которых теплота поглощается, называются эндотермическими.
В термохимических расчетах используют термохимические уравнения. В них указывают тепловой эффект реакции, фазовое состояние и полиморфную модификацию реагирующих и образующихся веществ. (г-газовое; ж-жидкое; к-кристаллическое, т-твердое; р-растворенное и др.). Например:
Термохимические расчеты проводят, используя энтальпии (теплоты) образования веществ. Под энтальпией образования понимают тепловой эффект реакции образования 1 моль вещества их простых. Обычно используют стандартные энтальпии образования (ΔΗ°обр. 298 или ΔΗ°f, 298). Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, приняты равными нулю.
В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от ее промежуточных состояний.
Следствия закона Гесса:
· Тепловой эффект разложения какого-либо соединения равен, но противоположен по знаку тепловому эффекту его образования.
· Если две реакции из различных начальных состояний приходят к одному конечному, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начального состояния в другое.
· Если две реакции имеют одинаковые начальные состояния и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое.
Закон Гесса позволяет рассчитывать теплоты образования нестабильных соединений и тепловые эффекты реакций, которые нельзя осуществить экспериментально.
Согласно закону Гесса тепловой эффект реакции представляет собой разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ. Для реакции
тепловой эффект Н определяется равенством
На практике при проведении термохимических измерений наиболее часто определяют следующие тепловые эффекты: теплоту образования, теплоту разложения, теплоту сгорания, теплоту растворения и теплоту нейтрализации.
Теплотой образования вещества называется тепловой эффект реакции образования 1 моля сложного вещества из простых, наиболее устойчивых при температуре 25˚С (298 0 К) и р = 101,3 кПа. Например:
Теплотой разложения вещества называется количество теплоты, выделяемое или поглощаемое при разложении 1 моля сложного вещества на более простые соединения, например:
СаСО3 = СаО + СО2 + 179,08 кДж
Теплотой сгорания называется тепловой эффект реакции окисления 1 моля данного соединения кислородом с образованием высших оксидов соответствующих элементов, например:
Теплотой растворения называется количество теплоты, которое выделяется или поглощается при растворении 1 моля вещества в таком объеме растворителя, чтобы при дальнейшем разбавлении раствора не наблюдалось изменения теплового эффекта.
При растворении соли в воде протекают одновременно два процесса:
3) разрушение кристаллической решетки вещества. При этом тепло поглощается (Q1);
4) гидратация ионов. При этом тепло выделяется (Q2).
Тепловой эффект растворения соли будет равен сумме тепловых эффектов этих процессов:
Поэтому вещества, обладающие прочной кристаллической решеткой и слабо гидратирующиеся в растворе, растворяются с поглощением тепла. Вещества с невысокой прочностью кристаллической решеткой, образующие в растворе сильно гидратированные ионы растворяются с выделением тепла.
Теплота растворения вещества увеличивается с разбавлением, но лишь до 100- 300 моль растворителя на 1 моль растворяемого вещества. Дальнейшее разбавление раствора практически не изменяет величину теплоты растворения.
Теплотой нейтрализации называется количество теплоты, выделяющееся при взаимодействии эквивалента кислоты с эквивалентом щелочи. При нейтрализации водных растворов сильных кислот сильными основаниями выделяется всегда одинаковое количество тепла, равное 57,11 кДж на 1 моль-эквивалент кислоты или основания (закон постоянства теплоты нейтрализации). Это объясняется процессом взаимодействия ионов:
Сказанное справедливо для растворов сильных кислот и оснований. В случае растворов слабой кислоты или основания процесс взаимодействия сопровождается диссоциацией слабого электролита. Диссоциация имеет характерный для каждого вещества тепловой эффект (тепловой эффект диссоциации)..
Второй закон термодинамики устанавливает возможность, направление и предел протекания самопроизвольных процессов. Чаще всего встречаются несколько формулировок второго закона:
Теплота не может сама собой переходить от менее нагретого тела к более нагретому.
Невозможен вечный двигатель второго рода, т. е. невозможна такая периодически действующая машина, которая позволяла бы получать работу только за счет охлаждения источника теплоты.
Эти формулировки связаны друг с другом и вытекают одна из другой. Обе они указывают на невозможность самопроизвольного протекания определенных процессов. Для оценки возможности протекания процесса в том или ином направлении введена величина – энтропия. Энтропия – это мера беспорядка.
При переходе системы из более упорядоченного в менее упорядоченное состояние энтропия возрастает (ΔS>0). В случае перехода из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (ΔS