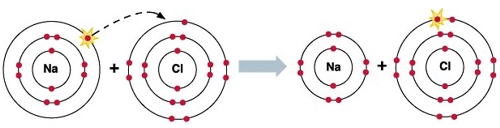
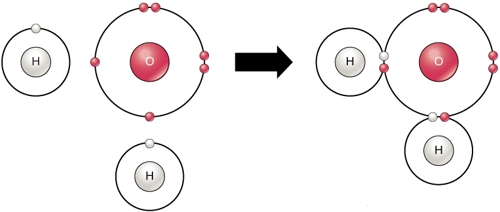
Чем определяется валентность элемента атомы которого образуют ковалентные связи по обменному
Ковалентная связь. Метод валентных связей.
В основе метода валентных связей лежат следующие положения:
1. Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Ковалентная связь – вид химической связи, осуществляемый за счёт образования электронной пары, которая принадлежит обоим атомам. Обозначается «:» или « – ».
По механизму образования ковалентная связь разделяется на:
Обменная ковалентная связь возникает между атомами. Где каждый атом отдаёт по одному неспаренному электрону в общую электронную пару.
Донорно-акцепторная ковалентная связь заключается в том, что один атом (донор) отдаёт электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Кроме одинарных связей, может образовываться двойная и тройная ковалентная связь.
Свойства ковалентной связи.
Насыщаемость – способность к образованию строго определённого количества ковалентных связей (от 1 до 6), которая определяет максимально возможную валентность элемента.
Направленность – стремление атомов к образованию наибольшей электронной плотности между ядрами.
Поляризуемость – смещение электронов под влиянием внешнего электрического поля.
Электроотрицательность – это способность атомов оттягивать к себе общую электронную пару.
Что такое валентность атома
В окружающем нас мире отдельные атомы химических элементов «сами по себе» существуют очень редко, как правило, атомы различных элементов соединяются друг с другом, образуя молекулы.
Если вместе соединяется несколько одинаковых атомов, получается простое вещество (современная наука знает порядка 500 простых веществ), но гораздо чаще вместе соединяются не одинаковые атомы, которые образуют сложные вещества (см. Атомно-молекулярная теория).
Примеры простых веществ: O2 (кислород), O3 (озон).
Примеры сложных веществ: NaCl (поваренная соль), H2SO4 (серная кислота), H2O (вода).
Состав и строение молекул описывают при помощи химических формул, которая показывает какие химические элементы входят в состав вещества, а также сколько атомов конкретного химического элемента входит в молекулу вещества. Например, в молекулу серной кислоты (H2SO4) входит водород (2 атома), сера (1 атом), кислород (4 атома).
По химической формуле очень легко определить молекулярную массу вещества, которая равна сумме атомных масс.
Молекулярная масса серной кислоты равна: H2SO4 = 1·2 + 32 + 16·4 = 98.
Еще одной весьма важной количественной характеристикой взаимодействующих между собой атомов, является валентность.
Валентность определяется по количеству связей, который образует атом с другими атомами. Чтобы написать правильную формулу вещества, необходимо знать валентность атомов, входящих в это вещество.
В структурных формулах химические связи между атомами обозначают чертой (см. формулы ковалентных связей), при этом каждая химическая связь образуется двумя электронами соседних атомов (каждый из атомов выделяет для этой цели по одному своему электрону, находящемуся на крайней внешней орбитали). Таким образом, валентность атома (количество связей, которое атом может образовать с соседними атомами) определяется числом его неспаренных валентных электронов.
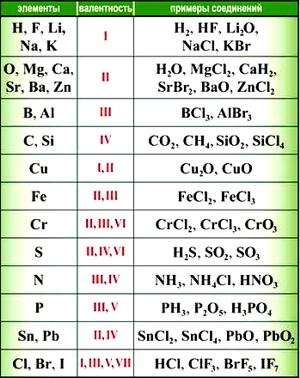
Некоторые химические элементы всегда проявляют постоянную валентность:
валентность водорода = I
валентность калия = I
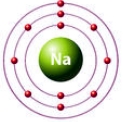
валентность натрия = I
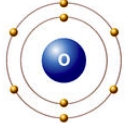
валентность кислорода = II
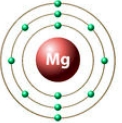
валентность магния = II
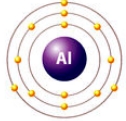
валентность алюминия = III
Другие элементы имеют переменную валентность.
валентность серы = II, IV, VI
Валентность неизвестного атома вещества можно определить по другим атомам с известной валентностью, входящих в это вещество.
Определим, какую валентность имеет сера в соединениях: H2S, SO2, SO3?
Известно, что валентность водорода = 1, а валентность кислорода = 2. Чтобы решить задачу необходимо известную валентность атома умножить на количество этих атомов, входящих в вещество: Н2 = 2; О2 = 4; О3 = 6. Так как во всех формулах присутствует только один атом серы, то полученные цифры и будут обозначать валентность серы в этих формулах.
Зная валентности всех элементов, входящих в вещество, можно составить правильную химическую формулу вещества. Для этого необходимо сначала найти наименьшее общее кратное, а затем, для определения числа атомов конкретного элемента наименьшее общее кратное разделить на валентность каждого атома, входящего в формулу.
Например, в оксид фосфора входят фосфор (валентность 5) и кислород (2). Наименьшее общее кратное будет 5·2 = 10. 10/5 = 2; 10/2 = 5. Получаем формулу P2O5.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Валентность
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Конспект лекции по теме «Понятие о валентности. Ковалентная связь» дисциплины ОУД.10 Химия, специальности 33.02.01 Фармация, СПО
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Тема: Понятие о валентности. Ковалентная связь
Понятие о валентности и химической связи
Вам известно, что одна из задач химии — изучение состава и строения веществ. При обычных условиях только молекулы благородных газов находятся в одноатомном состоянии, т. е. состоят из отдельных атомов. Большинство же веществ построены из молекул, которые состоят из 2, 3, 4 и большего числа атомов. Из этого следует, что атомы благородных газов, в отличие от атомов остальных элементов, не соединяются друг с другом. Возникает вопрос: в чём же причина одноатомности молекул благородных газов? Вы знаете, что атомы благородных газов имеют завершённый (восьмиэлектронный, а атом гелия — двухэлектронный) внешний энергетический уровень. Он является наиболее устойчивым (стабильным). Это и есть причина одноатомности молекул благородных газов. Атомы других элементов стремятся приобрести электронную конфигурацию ближайшего благородного газа, т. е. перейти в наиболее устойчивое состояние. Такое стабильное состояние атомы приобретают, взаимодействуя между собой, в результате между ними возникает химическая связь.
Химическая связь — это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
Способность атома элемента образовывать химические связи с другими атомами называют валентностью.
Значение валентности атома определяется числом химических связей, которые данный атом образует с другими атомами. В образовании химической связи принимают участие только валентные электроны атома.
Таким образом, валентные электроны — это электроны, которые могут принимать участие в образовании химической связи.
Вам известно, что в атомах элементов главных подгрупп валентными являются электроны внешнего энергетического уровня. При этом валентные электроны завершённого энергетического уровня располагаются парами (спаренные электроны), а незавершённого — и парами, и по одному (неспаренные электроны).
В образовании химической связи принимают участие не все валентные электроны атома, а только неспаренные.
В атомах элементов главной подгруппы VII группы один неспаренный электрон, а в атомах элементов главной подгруппы VI группы — два и т. д. Число неспаренных валентных электронов в атомах элементов главных подгрупп IV—VII групп, где знак Э обозначает символ элемента, а валентные электроны для наглядности обозначены точками вокруг него.
Число неспаренных электронов в атомах элементов главных подгрупп IV—VII групп можно определить и по формуле:
Число неспаренных электронов = = 8 — номер группы
Например, сера — это элемент главной подгруппы VI группы. Её атомы имеют по шесть электронов на внешнем уровне. Число неспаренных электронов равно 2 (8 — 6).
В зависимости от способа образования завершённого энергетического уровня атома различают два вида химической связи — ковалентную и ионную. С другими видами химической связи (металлическая, водородная) вы познакомитесь позже.
ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ СВЯЗИ
Теория ковалентной связи разработана в 1916 г. американским учёным Г. Льюисом.
Согласно теории ковалентной связи, атомы приобретают устойчивую электронную конфигурацию путём образования одной или нескольких общих для взаимодействующих ато мов электронных пар. В образовании электронной пары принимают участие оба атома, каждый предоставляет по одному неспаренному электрону*. При этом каждый атом приобретает завершённый энергетический уровень.
В общем виде механизм образования ковалентной связи можно представить схемой, на которой образующуюся общую электронную пару указывают двумя точками между символами элементов:
Неспаренные Общая
электроны пара электронов
В результате между ядрами образуется сгущение отрицательного заряда, которое притягивает к себе ядра атомов и уменьшает силы их взаимного отталкивания. Ковалентная связь — это химическая связь между атомами, осуществляемая с помощью общих электронных пар.
© 1 . Число неспаренных электронов в атоме фосфора равно: а) 5; 6)3; в )1; г) 7.
Составьте схему строения атома кислорода. Подчеркните валентные электроны. Обозначьте их точками вокруг символа атома. Сколько электронов атома кислорода могут участвовать в образовании связей с атомами водорода?
Опишите качественный и количественный состав каустической соды NaOH ,
вычислите её относительную молекулярную массу и массовые доли <%) элементов.
Образование ковалентной связи на примере некоторых молекул
(выделены валентные электроны). Из них шесть электронов образуют три электронные пары и только один электрон находится в неспаренном состоянии. Число неспаренных электронов можно подсчитать и по формуле: 8 — 7 = 1.
Для завершения внешнего электронного слоя каждому атому не хватает одного электрона. Поэтому при сближении двух атомов хлора каждый из них предоставляет по одному неспаренному электрону на образование одной обшей электронной пары, т. е. образуется ковалентная связь За счёт образования ковалентной связи каждый атом в молекуле хлора С1 3 приобретает устойчивый, завершённый восьмиэлектронный внешний слой (конфигурацию атома следующего за ним в Периодической системе благородного газа аргона: 2е
). Из этих 8 электронов 6, т. е. 3 неподелённые пары, принадлежат только этому атому, а остальные 2 электрона у него общие со вторым атомом.
Обозначая валентные электроны точками, составляют электронную формулу молекулы хлора:
Электронная формула молекулы состоит из символов элементов, вокруг которых точками обозначены валентные электроны (т. е. электроны внешнего уровня), а между ними — связывающие электронные пары.
Если в электронной формуле общую электронную пару заменить чёрточкой, то получится структурная формула молекулы.
Структурная формула молекулы хлора: С1-С1
Структурная формула — это формула молекулы, в которой каждая общая электронная пара изображается чёрточкой.
Электронная и структурная формулы показывают порядок соединения атомов в молекуле и число связей между атомами.
Связь в молекуле хлора является примером одинарной связи, а атом хлора — примером одновалентного атома.
Одинарная связь — это ковалентная связь, которая образована одной общей электронной парой.
Ковалентные связи могут быть также двойными, тройными, что определяется числом электронов, недостающих до завершения внешнего энергетического уровня атома.
Если молекула образована атомами одного элемента, то общая электронная пара в равной степени принадлежит обоим атомам. Такую ковалентную связь называют неполярной.
Если же молекула состоит из атомов различных элементов, то общая электронная пара обычно смещена в сторону одного из них, а именно в сторону того атома, который обладает более выраженными неметаллическими свойствами. Например, в молекуле HCI общая электронная пара смещена к атому хлора:
Такую ковалентную связь называют полярной. Аля качественной характеристики полярности связи ввели понятие электроотрицательности атомов элемента (ЭО).
Электроотрицательность — это способность атомов элемента притягивать к себе электроны, связывающие их с другими атомами.
Электроотрицательность — это условная, безразмерная характеристика именно атома элемента. Численные значения относительной ЭО атомов химических элементов приведены в Периодической системе элементов.
В периодах электроотрицательность атомов элементов возрастает с увеличением заряда ядра атомов (т. е. слева направо), а в главных подгруппах — снизу вверх.
Чем сильнее атомы притягивают электроны, тем больше значение ЭО. Наибольшую электроотрицательность имеют атомы фтора (4.0), а наименьшую — атомы цезия, франция (0,86).
В формулах соединений химический символ менее электроотрицательного элемента пишется, как правило, на первом месте.
Итак, ковалентная неполярная связь — это связь между атомами с одинаковой электроотрицательностью; при образовании неполярной связи общие электронные пары в равной степени принадлежат обоим атомам.
Ковалентная полярная связь — это связь между атомами, которые незначительно различаются по электроотрицательности; при образовании полярной связи общие электронные пары смещаются в сторону атома более электроотрицательного элемента.
Алгоритм составления схемы образования ковалентной связи
1. Составить электронные схемы атомов водорода (элемент главной подгруппы I группы, первого периода) и серы (элемент главной подгруппы VI группы, третьего периода), подчеркнуть валентные электроны и указать ЭО атомов:
2. Валентные электроны каждого атома обозначить точками вокруг символа элемента. В атоме серы два электрона находятся в неспаренном состоянии (8 — 6 = 2):
До завершения внешнего электронного слоя атому серы не хватает двух электронов, поэтому при образовании молекулы H 2 S возникают две пары общих электронов.
Вещества, в молекулах которых атомы связаны между собой ковалентными связями, обладают молекулярным строением. Именно молекулы являются носителями химических свойств этих веществ.
Молекулы имеют определённый качественный и количественный состав, поэтому чистые вещества молекулярного строения подчиняются закону постоянства состава: качественный и количественный состав соединений молекулярного строения является постоянным независимо от способа получения.
Это один из основных законов химии.
Например, чистая вода состоит из водорода и кислорода (качественный состав), причём в молекуле воды на 1 атом кислорода всегда приходится 2 атома водорода (количественный состав). Молекулы воды независимо от способа получения и местонахождения (речная, дождевая, ключевая, морская вода) всегда имеют приведённый выше состав.
Вам известно, что одно и то же вещество при разной температуре может существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Например, вода при обычных условиях представляет собой жидкость, при температуре выше 100 °С — газ
(пар), а при температуре 0 °С затвердевает, превращаясь в лёд. В любом агрегатном состоянии в веществах молекулярного строения сохраняются молекулы. Так, вода и в твёрдом виде (лёд), и в жидком, и в виде пара состоит из молекул Н 2 0.
Твёрдые вещества, как правило, находятся в кристаллическом состоянии. В кристаллических веществах частицы, образующие кристалл, находятся в строго определённых точках пространства. При соединении этих точек пересекающимися
прямыми линиями образуется пространственный каркас, который называют кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
В зависимости от вида частиц, расположенных в узлах кристаллической решётки, и от характера связи между ними различают четыре типа кристаллических решёток : молекулярные, ионные, атомные и металлические.
Задания для самостоятельного решения:
Выпишите названия и формулы веществ с молекулярной кристаллической решёткой из следующего перечня;
Массовая доля водорода наибольшая в веществе состава:
a ) HF ; б)НС1; в) НВг; г) H