Чем определяется то или иное агрегатное состояние
Агрегатное состояние вещества определяется: а) только расположением молекул б) характером движения и взаимодействия молекул
Ответ или решение 2
Для решения данной задачи определим
Что такое агрегатное состояние вещества
Итак, чтобы понять, что такое агрегатное состояние нам необходимо рассмотреть пример. Всякое вещество, будь то вода, металл, газ могут находиться в нескольких состояниях. Проще всего это объясняется на примере воды. Все мы очень хорошо знаем что вода в холодное время года замерзает и превращается в лед так вот, вода превращенная в лед в физике называется твердым агрегатным состоянием, но в то же время многие замечали туман или что при жаркой погоде лужи высыхают. Что же с ними происходит? Все очень просто, вода переходит в газообразное состояние, испаряется, превращается в пар.
Почему решили разделить агрегатные состояния
Просто некоторым любопытным людям стало интересно:»Почему та же вода, то твердая, то жидкая, то газообразная?» И вот они стали рассматривать все вещества под разными приборами и выявили закономерности в твердых, жидких и газообразных состояниях. Оказалось, что молекулы одного и того же вещества в разных состояниях ведут себя по разному.
На основе всех своих наблюдений, изучавшие агрегатные состояния вещества, ученые пришли к выводам, что данные состояния обусловлены как раз расположением, характером движения и взаимодействия молекул. Ответ в.
В данном вопросе теста правильным является вариант В:
агрегатное состояние вещества определяется расположением молекул, характером движения и взаимодействия молекул.
В твёрдом теле атомы расположены близко друг к другу, а скорость их движения небольшая.
В жидкостях атомы расположены дальше друг от друга, чем в твёрдом теле, и скорость их перемещения также выше.
В газообразных веществах атомы расположены далеко друг от друга и перемещаются с огромной скоростью.
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
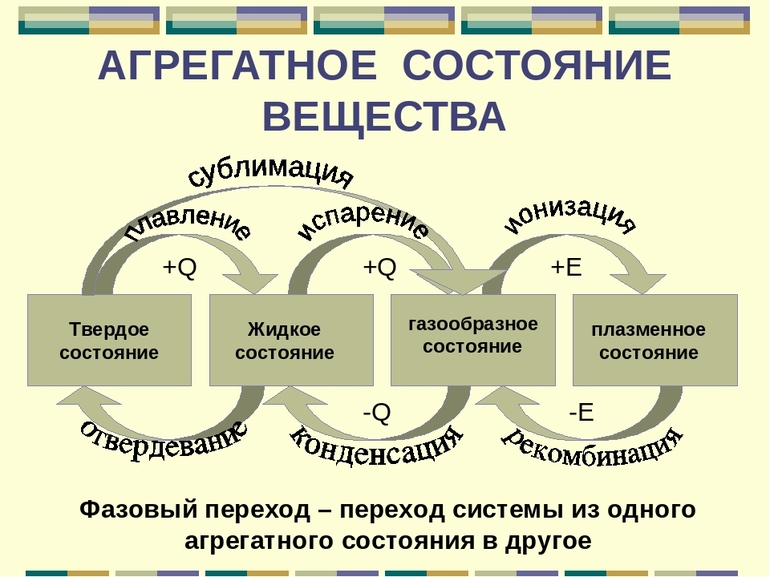
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
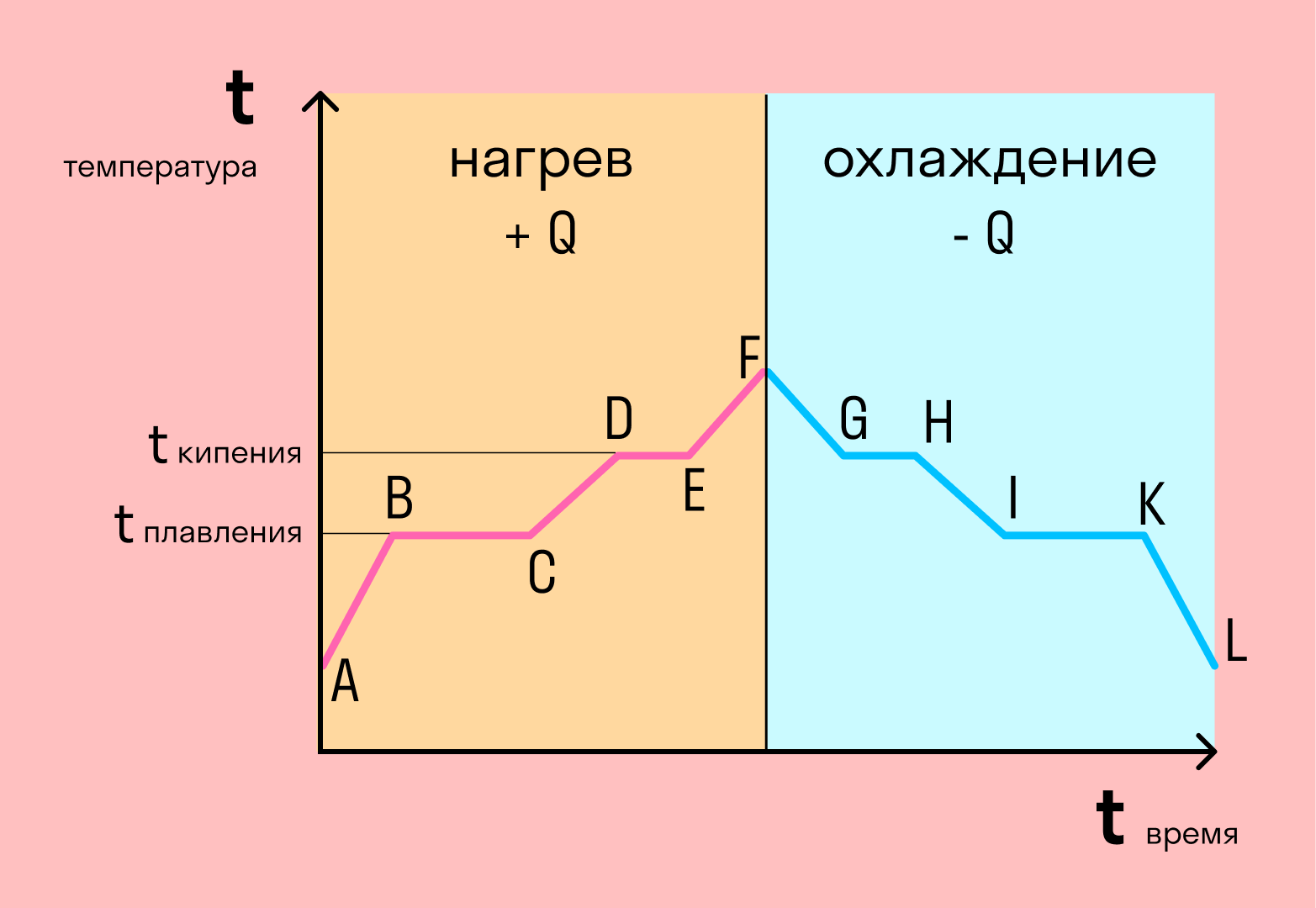
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Презентация. Физика. Агрегатные состояния вещества
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Агрегатные состояния вещества Переход из одного агрегатного состояния в другое называется фазовым переходом. Рассмотрим три агрегатных состояний вещества – жидкое, твердое и газообразное.
В зависимости от условий тела могут находиться в жидком, твердом или газообразном состоянии. Эти состояния называются агрегатными состояниями вещества. Например: Лед, вода и водяной пар. В жидкостях и твердых телах молекулы расположены ближе друг к другу и поэтому не могут удаляться далеко друг от друга. В газах расстояние между молекулами много больше размеров молекул. Если газу не мешают стенки сосуда, его молекулы разлетаются.
При определенных условиях вещества могут переходить из одного состояния в другое. Возможные превращения: Ж Т Г Плавление Кристаллизация Парообразовании Конденсация Сублимация Десублимация
В природе изменение агрегатных состояний происходит в широких масштабах. С поверхности океанов, морей и рек испаряется вода, а при охлаждении водяного пара образуются облака, роса, туман или снег. Реки зимой замерзают, а весной снег и лед тают.
Молекулы одного и того же вещества в разных агрегатных состояниях, одни и те же, они ничем не отличаются друг от друга. То или иное агрегатное состояние вещества определяется расположением и характером движения и взаимодействия молекул.
Агрегатные состояния вещества Твердое тело Жидкость Газ
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Физика: теория и методика преподавания в образовательной организации
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
В зависимости от условий тела могут находиться в жидком, твердом или газообразном состоянии. Эти состояния называются агрегатными состояниями вещества.
Например: Лед, вода и водяной пар.
В жидкостях и твердых телах молекулы расположены ближе друг к другу и поэтому не могут удаляться далеко друг от друга.
В газах расстояние между молекулами много больше размеров молекул. Если газу не мешают стенки сосуда, его молекулы разлетаются.
При определенных условиях вещества могут переходить из одного состояния в другое.
Номер материала: ДБ-371379
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В России утвердили новый порядок формирования федерального перечня учебников
Время чтения: 1 минута
Апробацию новых учебников по ОБЖ завершат к середине 2022 года
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Минпросвещения намерено расширить программу ускоренного обучения рабочим профессиям
Время чтения: 2 минуты
Минпросвещения планирует выделить «Профессионалитет» в отдельный уровень образования
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Общие понятия
При нормальных внешних условия все вещества находятся в своем привычном состоянии: кислород — в газообразном, вода — в жидком, кристаллы — в твердом. Их изменение вызывает переход одного и того же вещества в разные состояния, которые называются агрегатными. Повышение или понижение температуры и/или давления окружающей среды влияет на характер взаимодействия между частицами, составляющими вещество (молекулами, атомами, ионами), и расстояние между ними.
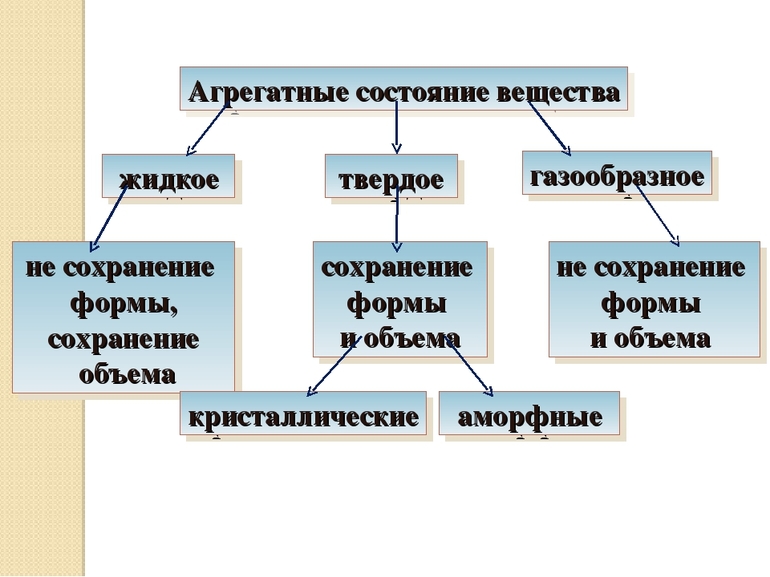
Бывает три вида агрегатных состояний (АС):
Переход вещества из одного АС в другое называется фазовым и сопровождается скачкообразным изменением его физических и химических свойств — плотности, растворимости, кинетической и потенциальной энергии частиц и др. Всего существует шесть процессов, вызывающих изменение агрегатного состояния вещества:
Сублимированию в той или иной мере подвержены все твердые тела, но в основном количество частиц, покинувших тело, настолько мало, что процесс практически незаметен. Примеры явной сублимации — графит и сухой лед (оксид углерода). Даже сильное нагревание не приводит их в жидкое состояние, а постепенно превращает в газ. Запахи твердых тел тоже обусловлены возгонкой — отрываясь от поверхности, молекулы скапливаются в пары, обладающие ароматом (камфара, нафталин). Молекулы некоторых органических веществ, например, белков, настолько большие, что не позволяют им принять газообразную форму.
Твердые тела
При нормальных условиях находятся в стабильной форме и сохраняют свой объем. По внутреннему строению и свойствам разделяются на кристаллические и аморфные. Первые отличаются строго упорядоченным положением частиц, между которыми установлены сильные взаимосвязи — ковалентные полярные и неполярные, ионные, металлические. Тип взаимодействия определяет физические свойства твердого тела. Это, как правило, металлы и их оксиды, обладающие хорошей тепло- и электропроводностью, прочные и упругие.
Свойства аморфных тел близки к жидкостным, так как их молекулы передвигаются между хаотично расположенными условными центрами. К ним относятся разнообразные смолы, пластмассы, стекло и другие неметаллы. Нагревание кристаллических веществ приводит к нарушению упорядоченного расположения частиц, увеличению расстояний между ними и рекристаллизации. При определенной температуре, которая называется температурой плавления, перестройка молекул приводит к превращению твердого тела в жидкость. Количество теплоты, которое нужно, чтобы расплавить некоторую массу вещества, вычисляют по формуле: Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Молекулярная кинетическая энергия остается неизменной, поэтому дальнейшее нагревание вещества не приводит к повышению его температуры до тех пор, пока все оно не превратится в жидкость. Если продолжать нагрев, то с поверхности расплавленного металла начнется испарение — беспорядочный отрыв отдельных молекул, который является началом перехода в газообразное состояние. При кристаллизации, начинающейся при снижении температуры, остывающее тело само отдает тепло в атмосферу.
Опытным путем установлено, что температуры плавления и кристаллизации у каждого металла равны друг другу, а их точно известное значение отличает кристаллические тела от аморфных. В отличие от металлов, аморфные вещества не плавятся, а размягчаются. Например, стекло при нагревании сначала становится мягким, его легко согнуть или растянуть.
Дальнейшее повышение температуры приводит к тому, что оно под действием силы тяжести растекается по сосуду, который занимает. Эта масса, поначалу очень густая, постепенно приобретает консистенцию воды. Таким образом процесс перехода аморфного тела в жидкое происходит не при фиксированной температуре, как у кристаллических тел, а растягивается на все время нагревания.
Изменение жидкостей
Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
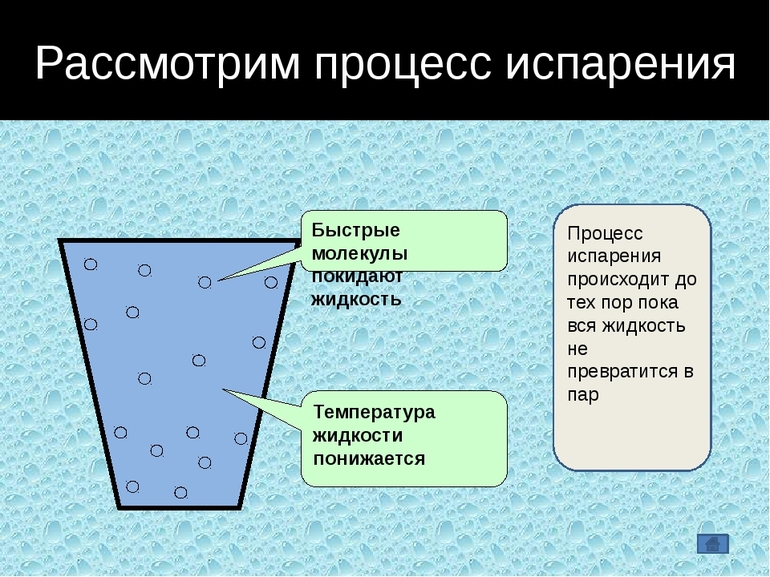
Процесс парообразования
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие
Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Газообразное состояние
При этом АС частицы химических элементов и их соединений связаны друг с другом слабо или не связаны вообще и заполняют весь предоставленный объем. Такое состояние вещества широко распространено в природе: воздушные массы атмосферы; скопления газов под землей; газообразная материя, растворенная в водах Мирового океана.
Все газы отличаются следующими свойствами:
Эти характеристики определяются большими расстояниями между молекулами и их притяжением друг к другу. Газообразное АС веществ можно рассматривать, как перегретый или ненасыщенный пар. При сверхвысоких температурах газ частично или полностью ионизируется, при этом сохраняя общую электрическую нейтральность, потому что плотности отрицательных и положительных зарядов находятся примерно на одном уровне.
Так образуется плазма, которую некоторые ученые рассматривают, как четвертый вид АС вещества. В ней взаимодействие происходит между ионами и свободными электронами с помощью электрических сил, действующих на большом расстоянии. Вещества, которые при нормальных условиях являются газами, самопроизвольно переходить в жидкое состояние не могут.
Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами и увеличению силы взаимодействия до такой степени, что вещество из газообразного состояния переходит в жидкое, т. е. изменяет свое АС. Этот процесс называется сжижением и характеризуется критической температурой. Она определяется в точке, после которой превращение газа в жидкость невозможно ни при каком давлении.
Для каждого газообразного вещества значение этой температуры свое. Оно бывает примерно равно комнатной, как у аммиака, хлора и углекислого газа, тогда для сжижения достаточно воздействовать на газ только давлением. У водорода и гелия, например, критическая температура намного ниже комнатной. Перед сжижением их сначала охлаждают до температуры чуть ниже критической, а затем доводят до жидкого АС повышенным давлением.
Сравнительная таблица
Различие между твердыми материалами, жидкостями и газами объясняется внутренними процессами, зависящими от агрегатного состояния вещества. В таблице приведены характерные для каждого класса особенности.
| Состояние вещества | Расположение и характер движения частиц | Энергия взаимодействия | Физические свойства |
| Твердое | Расстояния между частицами, колеблющимися около положения равновесия, сопоставимы с их размерами. | Потенциальная энергия превышает кинетическую. Взаимодействие между частицами сильное. | Сохраняют собственную форму и объем. Имеют точную температуру кристаллизации и плавления. Обладают твердостью, прочностью и упругостью. |
| Жидкое | Частицы расположены вплотную и сохраняют близкий порядок упорядоченности. Могут перескакивать из одного положения равновесия в другой. | Модуль кинетической энергии почти равен потенциальной. | Сохраняют объем, но не форму. Закипают при определенной температуре. Текучи, почти не поддаются сжатию. |
| Газообразное | Частицы расположены хаотично на расстояниях, сильно превышающих их собственные размеры. Хаотичное движение частиц с довольно большими скоростями приводит к постоянным столкновениям между ними. | Кинетическая энергия по модулю намного превышает потенциальную. Легко заполняют весь предоставленный объем и сжимаются. | Принимают форму тех предметов, в которых находятся. |
Можно отметить, что переход вещества из одного АС в другое зависит от соотношения потенциальной и кинетической энергии его частиц.
Область применения
Способность металлов плавиться и поддаваться обработке в жидком состоянии широко применяется в черной и цветной металлургии. В технологиях получения соли и других химических соединений используется процесс выпаривания, при котором нужное вещество получается после испарения жидкости. В разных областях промышленности и техники распространено применение жидких газов.
Инертные газы используются в осветительных приборах, жидкий кислород — в медицине в качестве средства анестезии, при сварке металлов в смеси с ацетиленом.
Жидкий водород — это ракетное топливо, а оксид серы уничтожает плесень. В рефрижераторах и промышленных холодильниках применяют жидкий аммиак, кроме того, сжиженные газы удобней транспортировать.