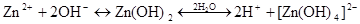Чем определяется направленность реакций в растворах электролитов приведите примеры
Чем определяется направленность реакций в растворах электролитов? Приведите, пожалуйста, примеры. Спасибо.
По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl + NaNO3,
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т. е. реакции не идут до конца слева направо) :
CH3COONa + H2O CH3COOH + NaOH
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl + NaNO3,
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т. е. реакции не идут до конца слева направо) :
CH3COONa + H2O CH3COOH + NaOH
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Реакции в растворах электролитов. Направленность обменных реакций в растворах электролитов.



При взаимодействии элекролитов происходят реакции обмена ионами. Отличительная черта обменных реакций: элементы, входящие в состав, не меняют свою степень окисления. К обменным реакциям в растворах относятся реакции нейтрализации, гидролиза, осаждения, растворения, комплексообразования.
По теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся в-ва – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами
выражаются одним и тем же ионно-молекулярным уравнением
из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды. Аналогично уравнения реакций
выражают один и тот же процесс образования из ионов Ва 2+ и SO4 2— осадка малорастворимого электролита – сульфата бария
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ.Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей
CH3COONa + HCl → CH3COOH + NaCl.
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов
или в сокращенном виде
Аналогично протекают реакции между щелочами и солями слабых оснований. Например,
Fe 2+ + SO4 2– + 2 Na + + 2 OH – → SO4 2– + 2 Na + + Fe(OH)2↓
Таким образом, реакции в растворах электролитов идут до конца, если в результате взаимодействия веществ происходит образование осадка, выделение газа и образование слабого электролита.При написании уравнений реакций, слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а находящиеся в растворе сильные электролиты – в виде составляющих их ионов. Все рассмотренные уравнения реакций являются необратимыми т.к. равновесие в них смещено вправо вследствие малой растворимости BaSO4 иFe(OH)2, образовании уксусной кислоты CH3COOH и воды H2О. Но в обменные реакции могут вступать растворы сильных и слабых электролитов, что может приводить к образованию слабых электролитов. Такие реакции являются обратимыми: FeS + 2HCl 
В сокращенном ионно-молекулярном уравнении сумма электрических зарядов левой части уравнения всегда равна сумме электрических зарядов правой части уравнения.
Направление реакций обмена в растворах электролитов
Реакции обмена – это реакции, которые идут без изменения степени окисления элементов. Цель любого химического процесса – получить новое вещество, которое можно выделить из реакционной системы. В растворах электролитов химические реакции протекают между ионами. Если в реакции участвует слабый электролит, основная масса которого находится в молекулярной форме, то при протекании реакции происходит смещение диссоциации слабого электролита в сторону ионной формы.
Любое взаимодействие между электролитами – это взаимодействие между противоположно заряженными ионами. Такие реакции называются ионными реакциями, а уравнения этих реакций записываются в виде молекулярных, полных ионных и сокращенных (кратких) ионных уравнений. В ионных уравнениях слабые электролиты (осадок, газ и малодиссоциирующие (слабые) соединения) всегда записывают в молекулярнойформе.
1. сильный электролит + сильный электролит = сильный электролит + слабый электролит,
ионная форма ионная форма ионная форма молекулярная форма
2. сильный электролит + слабый электролит = сильный электролит + слабый электролит,
ионная форма молекулярная форма ионная форма молекулярная форма
3. слабый электролит + слабый электролит = сильный электролит + слабый электролит.
молекулярная форма молекулярная форма ионная форма молекулярная форма
Приведем пример составления уравнений реакций обмена (1 тип):
соль (Р) соль (Р) соль (Н) соль (Р)
электролит сильный сильный слабый сильный
состояние в растворе ионное ионное молек-ное ионное
Аg + + С1‾ ↔ АgСl¯ сокращенное ионное
Пример 1 Составьте молекулярные и ионные уравнения реакций обмена между а). карбонатом натрия и сернистой кислотой; б) уксусной кислотой и гидроксидом аммония. Укажите причину необратимости реакции.
сильный слабый сильный слабый
Реакция необратима, так как Кдис (CH3COOH ) > Кдис (H2O) и Кдис (NH4OH) > Кдис (H2O).
Пример 2 Составьте сокращенные ионно- молекулярные уравнения реакций обмена к следующим молекулярным уравнениям:
а) СuС12 + 2КОН = Сu(ОН)2↓ + 2КС1 Сu 2+ + 2OH‾ = Сu(ОН)2↓
сильный сильный слабый сильный
сильный сильный слабый сильный
сильный сильный слабый сильный
слабый сильный сильный слабый
ЗАДАЧИ
60. Составьте молекулярные и сокращенные ионно-молекулярные уравнения реакций:
61. Составьте молекулярные и сокращенные ионно-молекулярные уравнения реакций:
62. Составьте молекулярные и сокращенные ионно-молекулярные уравнения реакций:
а) соляная кислота +нитратсеребра;
б) хлорид бария +серная кислота.
63. Составьте молекулярные и сокращенные ионно-молекулярные уравнения реакций:
в) гидроксид натрия + хлорид аммония;
г) карбонат натрия +гидроксид кальция;
д) гидроксид железа (III) + азотная кислота.
64. Составьте молекулярные уравнения реакций по данным ионно – молекулярным уравнениям:
в) Fе 3 + + ЗОН‾ → Fе(ОН)3↓
65. Напишите ионные уравнения реакций, протекающих с образованием малодиссоциирующих соединений:
66. Напишите молекулярные и ионные уравнения реакций нейтрализации:
67. Напишите молекулярные и ионные уравнения реакций образования средних солей из основных и кислых:
68. Выберите необратимые реакции и для них напишите молекулярные и ионно- молекулярные уравнения:
69. Напишите молекулярные уравнения реакций:
а) (АlOН) 2 + + Н + → Al 3+ + Н2O
б) НСO3‾+ OН‾ → СO3 2 ‾ + Н2O
в) А1(ОН)3 + OН‾ → АlO2‾+ Н2O
г) Fе(ОН)2 + 2Н + → Fе 2 + + 2Н2O
Для слабых электролитов выпишите соответствующие константы.
70. Объясните с помощью ионных уравнений, что произойдет при смешении ионов в растворе:
71. Приведите примеры трех реакций, которые можно выразить одним ионным уравнением:
СН3СОO‾+ Н + → СН3СООН
72. Приведите примеры трех реакций, которые можно выразить одним ионным уравнением:
73. Можно ли приготовить раствор, содержащий одновременно следующие вещества:
Ответ подтвердите уравнениями реакций. Для слабых электролитов выпишите соответствующие константы.
74. Напишите молекулярные уравнения реакций:
а) Аg + + Вг‾ =AgBr 6) Ва 2 + + SО4 2 ‾ = BaSO4
Для слабых электролитов выпишите соответствующие константы.
75. Напишите молекулярные и сокращенные уравнения реакций, протекающих при смешении растворов:
а) серной кислоты и гидроксида кальция;
б) гидроксида магния и соляной кислоты;
в) гидроксида цинка и гидроксида калия.
Для слабых электролитов выпишите соответствующие константы.
76. Напишите сокращенные ионные уравнения реакций:
77. Напишите сокращенные ионно-молекулярные уравнения реакций. Для слабых электролитов выпишите соответствующие константы.
78. Напишите в молекулярной и сокращенной ионной форме уравнения реакций нейтрализации:
Для слабых электролитов выпишите соответствующие константы.
79. Составьте в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
a). NO2‾ +Н + = НNO2 б). Сu 2 + + 2ОН‾ =Сu(ОН)2↓ в) Pb 2+ + 2I‾ =РbI2↓
НАПРАВЛЕННОСТЬ РЕАКЦИЙ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
В растворах электролитов реакции всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей:
CH3COONa + HCl = CH3COOH + NaCl
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов:
CH3COO – + Na + + H + + Cl – = CH3COOH + Na + + Cl –
или в сокращенном виде:
Сокращенное ионное уравнение отражает самую суть происходящего процесса. Вступают в реакцию или образуются в ней в действительности только те частицы (ионы или молекулы), которые записаны в сокращенном уравнении. Аналогично протекают реакции между сильными основаниями и солями слабых оснований. Например:
Fe 2+ + SO4 2– + 2 Na + + 2 OH – = SO4 2– + 2 Na + + Fe(OH)2
Fe 2+ + 2 OH – = Fe(OH)2
При составлении ионно-молекулярных уравнений необходимо помнить:
Таким образом, при написании ионно-молекулярных уравнений необходимо знать растворимость и силу электролитов.
Zn(OH)2 + 2H + + 2Cl – = Zn +2 + 2Cl – + 2H2O
или уравнение в сокращенном виде
NH 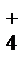
или уравнение в сокращенном виде
NH 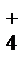
Реакции с участием малорастворимых веществ в молекулярной и ионно-молекулярной форме:
уравнение в сокращенном виде:
СаСО3 + 2Н + + 2Cl – = Са 2+ + 2Сl – + СО2 + Н2О,
уравнение в сокращенном виде
Большинство процессов в растворах электролитов обратимы. Равновесие всегда смещено в сторону образования более устойчивых форм, то есть более слабых электролитов или наименее растворимых веществ, более устойчивых комплексных ионов.
Для решения вопроса о глубине и направленности процессов в общем случае нужно рассчитывать изменение энергии Гиббса.
Судить о направленности реакций в растворах электролитов можно также по другим термодинамическим характеристикам: константам равновесия процессов диссоциации слабых электролитов, константам равновесия распада или образования комплексных соединений, ПР малорастворимых электролитов.
Так, процесс нейтрализации сильной кислоты сильным основанием, записанный в виде молекулярного уравнения
HCl + NaOH = NaCl + H2O,
характеризуется изменением энергии Гиббса, которое можно рассчитать по уравнению



Значение изменения энергии Гиббса свидетельствует о большой термодинамической вероятности процесса.
Процесс взаимодействия соли слабой кислоты с более сильной кислотой с образованием слабой кислоты также характеризуется отрицательной величиной 





Результат термодинамического расчета хорошо согласуется с известным правилом: более сильная кислота вытесняет слабую из растворов её солей.
Рассмотрим процесс нейтрализации слабой кислоты щелочью при стандартных условиях:
HClO + NaOН = NaCl + H2O.
Запишем процесс в ионно-молекулярной форме, по которой удобно проводить расчет:
HClO + OН – = ClO – + H2O.
Изменение энергии Гиббса 

Если умножить числитель и знаменатель дроби на СН 





и тогда 

К = 
К = 


и тогда 

Если в реакции участвуют малорастворимые электролиты, а также слабые электролиты, то непосредственно сравнивать величины ПР и Кдисс.. слабого электролита для решения вопроса о возможности осуществления процесса нельзя, следует проводить расчет констант равновесия суммарного процесса или расчет изменения энергии Гиббса.
Рассмотрим процесс растворения сульфида меди в соляной кислоте при стандартных условиях:
уравнение в ионно-молекулярной форме записывается

S 
Изменение энтальпии в соответствии со следствием из закона Гесса рассчитывается по уравнению:

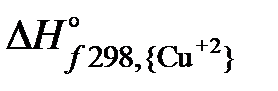
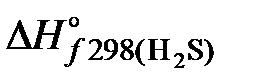


Изменение энтропии соответственно: DS 
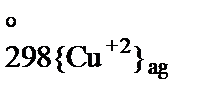






Рассчитанное изменение энергии Гиббса для процесса в прямом направлении свидетельствует о термодинамической невозможности растворения CuS в соляной кислоте. Правильность вывода, сделанного на основании термодинамического расчета, подтверждается экспериментальными данными, сульфид меди в соляной кислоте не растворяется.
Реакции в растворах электролитов



При растворении в воде кислоты, основания, соли под действием полярных молекул растворителя подвергаются электролитической диссоциации, распадаясь на положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы. Кислоты – электролиты, диссоциирующие в растворах с образованием катионов водорода Н + :
Диссоциация может протекать полностью или частично. Отношение числа продиссоциированных молекул к числу растворенных называют степенью диссоциации. В зависимости от величины степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты практически полностью диссоциируют на ионы. К ними относятся кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4; основания щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2; почти все соли.
Слабые электролиты диссоциируют на ионы в очень малой степени. К ним относятся: вода Н2О, неорганические кислоты (например, Н2СО3, Н2S, HNO2, HCN, HClO); многие органические кислоты (например, СН3СООН, НСООН); гидроксид аммония NH4OH, малорастворимые основания (например, Mg(OH)2, Fe(OH)2), амфотерные гидроксиды; некоторые соли (например, CdCl2, Mg(CN)2, HgCl2, Fe(SCN)3).
Уравнение процесса электролитической диссоциации сильного электролита записывают с указанием его практической необратимости: приводится лишь одна стрелка ®, направленная от молекулярной формы электролита к его ионам; уравнение диссоциации слабых электролитов записывают с указанием ее обратимости: Û.
Наличие электрических зарядов у ионов и совершаемые ими перемещения в растворе придают растворам электролитов высокую химическую активность. При смешивании растворов различных электролитов находящиеся в них ионы противоположного заряда могут ассоциировать в молекулы, комплексы или кристаллы нового вещества, в результате чего в растворе происходят химические реакции. Реакции, заключающиеся в обмене ионами между различными электролитами, называют реакциями ионного обмена. Реакции обмена протекают с очень высокими скоростями, так как реагенты уже находятся в активированном состоянии и химическое равновесие большинства процессов устанавливается быстро. Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентрации ионов. Направление реакции обмена (смещение равновесия системы) определяется возможностью образования малодиссоциирующего, малорастворимого или газообразного соединения. В результате те или иные ионы выводятся из сферы взаимодействия в виде слабого электролита, осадка, газа, что приводит к более полному протеканию реакции.
Если среди исходных и образующихся веществ имеются малодиссоциированные или малорастворимые соединения, то равновесие системы смещается в сторону наиболее полного связывания ионов, т. е. в сторону наименее диссоциированного и наименее растворимого вещества.
Реакции обмена удобно выражать в виде ионно-молекулярных (ионных) уравнений, которые показывают сущность происходящих в растворах процессов. Эта форма записи отражает состояние веществ в растворе и их взаимодействие.
При составлении ионно-молекулярных уравнений (полных и сокращенных) формулы сильных электролитов записывают в виде ионов, так как именно в таком состоянии они находятся в растворе. Формулы слабых электролитов, газообразных и малорастворимых веществ записывают в виде молекул, независимо от того, являются ли они исходными веществами или продуктами реакции. Газообразные вещества или вещества, выпадающие в осадок, принято отмечать вертикальной стрелкой или ¯ (см. приложение 2).
Пример 1. Написать молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ:
Решение. Запишем уравнение реакции в молекулярном виде:
HCl + NaOH = NaCl + H2O
Учитывая, что HCl, NaOH и NaCl относятся к сильным электролитам, а H2O – к слабым, запишем полное ионно-молекулярное уравнение:
Таким образом, реакция между любой сильной кислотой и любым сильным основанием (реакция нейтрализации) сводится к образованию из ионов водорода и гидроксид-ионов молекулы слабого электролита – воды.
Молекулярное уравнение реакции:
Для написания полного ионно-молекулярного уравнения реакции запишем сильные электролиты (растворимые соли Pb(NO3)2, Na2S и NаNО3) в ионной форме, а нерастворимую соль (PbS) в молекулярной форме:
Сокращенное ионно-молекулярное уравнение:
Протекание реакции обусловлено образованием труднорастворимого вещества.
Для написания ионно-молекулярного уравнения реакции запишем сильные электролиты (растворимые соли К2СО3, К2SO4 и H2SO4) в ионной форме, а СО2 (газообразное вещество) и Н2О (слабый электролит) – в молекулярной форме:
Полученное сокращенное ионно-молекулярное уравнение показывает, что данная реакция протекает с образованием газообразного вещества и слабого электролита.
Протекание реакции обусловлено образованием молекул воды. Но так как азотистая кислота HNO2 – слабый электролит и сама является фактором, определяющим протекание обратной реакции, то в отличие от трех предыдущих случаев реакция является обратимой. Однако равновесие системы смещено в направлении протекания прямой реакции, так как вода является гораздо более слабым электролитом, чем азотистая кислота.
Пример 2. Составьте два различных уравнения в молекулярном виде, которым будет соответствовать уравнение в сокращенном ионно-молекулярном виде: Ni 2+ + S 2— = NiS¯.
Решение. Наличие катионов никеля и сульфид – анионов в левой части уравнения говорит о том, что взаимодействуют два сильных электролита – растворимые соли, состав которых может быть весьма разнообразным и одному ионно-молекулярному уравнению может соответствовать несколько молекулярных уравнений. Подписываем под символами ионов левой части данного уравнения такие ионы противоположного заряда, которые образовали бы с исходными ионами растворимые сильные электролиты. Затем такие же ионы записываем и под правой частью уравнения:
Суммируя оба равенства, получаем полное ионно-молекулярное уравнение:
Объединив ионы в формулы соединений, записываем уравнение в молекулярной форме:
Подобрав другие подходящие ионы, получаем второе уравнение:

Пример 3. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия амфотерного гидроксида цинка с азотной кислотой и гидроксидом натрия. Напишите уравнения диссоциации гидроксида цинка в кислой и щелочной средах.
Решение. Так как гидроксид цинка Zn(OH)2 амфотерен, то он способен вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями.
При взаимодействии его с азотной кислотой получается нитрат цинка и вода:
При взаимодействии с гидроксидом натрия в водных растворах образуются комплексные соединения:
Уравнения диссоциации гидроксида цинка имеют вид:
(в кислой среде) (в щелочной среде)
Амфотерные гидроксиды диссоциируют и как основания и как кислоты. Прибавление кислоты смещает это равновесие влево, а прибавление щелочи – вправо. Поэтому в кислой среде преобладает диссоциация по типу основания, а в щелочной по типу кислоты. В обоих случаях связывание в молекулы воды ионов, образующихся при диссоциации малорастворимого амфотерного электролита, вызывает переход в раствор новых порций таких ионов, их связывание, переход в раствор новых ионов. Следовательно, растворение такого электролита происходит как в растворе кислоты, так и в растворе щелочи.
181.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaНСО3 и NaOH; б) К2SiO3 и HCl; в) BaCl2 и Na2SO4.
182. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) К2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOН, учитывая, что гидроксид хрома (III) проявляет амфотерные свойства.
183. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
184. Какие из веществ: Al(OH)3; H2SO4; Ba(OH)2; Cu(NO3)2 – будут взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
185.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и КOH; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
186. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH.
187. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
188. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Hg(NO3)2 и NaJ; б) H2SO4 и Na2S; в) Pb(OH)2 и KOH, учитывая, что гидроксид свинца (II) проявляет амфотерные свойства.
191. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
192. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Cu(OH)2 и HNO3;
б) ZnOHNO3 и HNO3; в) Be(OH)2 и NaOH, учитывая, что гидроксид бериллия проявляет амфотерные свойства.
193. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Sn(OH)2 и KOH, учитывая, что гидроксид олова (II) проявляет амфотерные свойства.
194. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
195. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CоS и HCl; б) Ba(OH)2 и CоCl2; в) Cr(OH)3 и NaOH, учитывая, что гидроксид хрома (III) проявляет амфотерные свойства.
196. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn 2+ + H2S = ZnS + 2H +
197. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba(OH)2; б) FeCl3 и NaOH; в) CH3COONa и HCl.
198. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuCl2 и KOH; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
199. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
200. Какие из веществ: NaCl, NiSO4, Be(OH)2, NaHCO3 будут взаимодействовать с раствором гидроксида натрия, учитывая, что гидроксид бериллия проявляет амфотерные свойства. Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.