Чем определяется многообразие и специфичность белков
Лекция № 3. Строение и функции белков. Ферменты
Строение белков
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
Купить проверочные работы
по биологии


Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Перейти к лекции №2 «Строение и функции углеводов и липидов»
Перейти к лекции №4 «Строение и функции нуклеиновых кислот АТФ»
Смотреть оглавление (лекции №1-25)
Чем определяется многообразие и специфичность белков?
Чем определяется многообразие и специфичность белков?
Например, с вазопрессином?
Некоторые белки выполняющие одинаковые функции, могут иметь одинаковое строение у разных видов.
Примером могут служить белки групп крови человека.
Известно что в эритроцитах (красных кровяных клетках) содержится гемоглобин, который доставляет кислород ко всем клеткам тела.
В структуре гемоглобина эритроцитов крови человека обнаружили, что каждая белковая молекула состоит из 4 полипептидных цепей.
Чем определяется специфичность каждого организма?
Чем определяется специфичность каждого организма?
Чем определяется многообразие и специфичность белков?
Чем определяется многообразие и специфичность белков?
Например, с вазопрессином?
ОТВЕТЬТЕ ПОЛНО И РАЗВЕРНУТО НА СЛЕДУЮЩИЕ ВОПРОСЫ?
ОТВЕТЬТЕ ПОЛНО И РАЗВЕРНУТО НА СЛЕДУЮЩИЕ ВОПРОСЫ.
1. Многообразие белков определяется составом, количеством и последовательностью аминокислот.
Как вы считаете, чем определяется многообразие углеводов?
Какое биологическое значение это имеет?
2. Почему жиры, а не углеводы являются главным источником метаболической воды?
Чем объясняется многообразие некоторых пород домашних животных(например, собака) по сравнению с дикими видами?
Чем объясняется многообразие некоторых пород домашних животных(например, собака) по сравнению с дикими видами?
Уровни организации молекулы белка?
Уровни организации молекулы белка.
Чем объясняется многообразие молекул белка?
Приживлению чужих органов мешает специфичность 1)углеводов 2)липидов 3)белков 4)аминокислот?
Приживлению чужих органов мешает специфичность 1)углеводов 2)липидов 3)белков 4)аминокислот.
Общие сведения о многообразий растений.
Что такое видовая специфичность хромосом?
Что такое видовая специфичность хромосом?
Какие факторы определяют многообразие растительного и животного мира разных биомов суши?
Какие факторы определяют многообразие растительного и животного мира разных биомов суши?
В чем выражена специфичность анализатора?
В чем выражена специфичность анализатора?
1 шишка 2 размножаются семенами 3 везде.
Я думаю что второе но это не точно я могу ошибаться.
Биосистема является суммой живых организмов.
Нервные клетки и наверно волокна.
С начала зимы холода не отступают сначала я думал что я решил правильно задачу во время каникул я много гулял вовремя пришел на урок на конец Августа я решил куда буду паступать наконец вышел выпуск программы больше не зная только магут быть ошибки в..
Ответ : Сердце состоит из предсердий и желудочков.
Чем определяется многообразие и специфичность белков
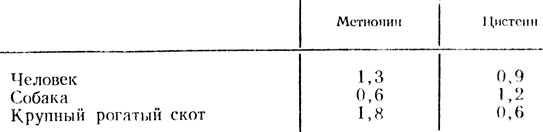
Видовая и тканевая специфичность белков
Таблица 2. Содержание метионина и цистеина в гемоглобине в процентах
Различия обнаружены при изучении состава инсулина и ряда других белков. Наряду с этим существуют определенные различия в составе белков в зависимости от возраста. Так, у плода человека в крови обнаружен специфический вид гемоглобина, который называется фетальным. Этот вид гемоглобина после рождения практически исчезает. При изучении его структуры также были выявлены определенные изменения аминокислотного состава по сравнению с гемоглобином взрослого человека.
Эти данные свидетельствуют о том, что структура белка внутри одного вида строится по вполне определенному плану, специфичному именно для представителей данного вида.
Важно отметить, что внутри одного и того же вида имеются и индивидуальные различия в составе белка. Показано, что одни особи обладают только одним видом гемоглобина и β-лактоглобулином молока, у других встречается смесь двух различных видов этих белков. Существуют и наследственные различия в составе белков, что в ряде случаев является причиной тяжелых наследственных заболеваний.
Приведенные примеры касались в основном гемоглобина как наиболее изученного белка, но все сказанное в полной мере относится и к другим белкам.
РАЗДЕЛ 1. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
VI. Многообразие белков
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Белки построены из 20 химически различных аминокислот, каждая из которых может занимать любое положение в полипептидной цепи. Кроме того, белки различаются количеством аминокислот, из которых они построены.
Однако большинство таких белков в среде должны принимать множество конформаций с приблизительно одинаковой энергией, но разными химическими свойствами и функциями. Поэтому в эволюции, по-видимому, была отобрана лишь небольшая часть возможных вариантов белков, которые способны принимать единственную стабильную конформацию.
Таким образом, первичная структура известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной из возможных конформаций, которая и определяет особенности функционирования данного белка.
Возникновение новых белков часто связано с незначительными изменениями в структуре уже имеющихся белков. Кроме того, благодаря генетическим механизмам, о которых будет сказано в разделе 4, белок с полезными свойствами или основная структурная часть этого белка могут входить в состав других белков. Такие белки, имеющие схожую последовательность аминокислот и родственные функции, объединяют в семейства родственных белков.
А. Классификация белков
До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
✵ по форме молекул (глобулярные или фибриллярные);
✵ по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
✵ по химическому строению (наличие или отсутствие небелковой части);
✵ по выполняемым функциям (транспортные, защитные, структурные белки и др.);
✵ по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
✵ по локализации в организме (белки крови, печени, сердца и др.);
✵ по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
✵ по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т 1 /2 менее 1 ч, до очень медленно обновляющихся белков, Т 1 /2 которых исчисляют неделями и месяцами);
✵ по схожим участкам первичной структуры и родственным функциям (семейства белков).
Б. Классификация белков по форме молекул
Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т. е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков — рассмотренные выше миоглобин и гемоглобины.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин — белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией.
1. Строение и функции коллагенов
Коллагены — семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани. Коллагены — самые распространённые белки не только межклеточного матрикса, но и организма в целом, они составляют около 1/4 всех белков организма человека. В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена (более подробно это описано в разделе 15). Фибриллы коллагена обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. По прочности коллагеновые фибриллы превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Необычные механические свойства коллагенов связаны с их первичной и пространственной структурами. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α- цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи.
Первичная структура α-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 1 /4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11% — аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, а гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота — гидроксилизин. Полипептидную цепь коллагена можно представить, как последовательность триплетов Гли-Х-Y, где X и Y могут быть любыми аминокислотами, но чаще в положении X стоит пролин, а в положении Y — гидроксипролин или гидроксилизин. Каждая из этих аминокислот имеет большое значение для формирования коллагеновых фибрилл.
Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя левозакрученную спиральную конформацию. На один виток спирали приходится 3 аминокислотных остатка, а не 3,6, как это характерно для вторичной структуры глобулярных белков. Спираль пептидной цепи коллагена стабилизирована не за счёт водородных связей (так как пролин их не образует), а силами стерического отталкивания пирролидиновых колец в остатках пролина. В результате расстояние между аминокислотными остатками по оси спирали увеличивается, и она оказывается более развёрнутой по сравнению с туго закрученной α-спиралью глобулярных белков.
Спирализованные полипептидные цепи, перевиваясь друг около друга, образуют трёхцепочечную правозакрученную суперспиральную молекулу, часто называемую тропоколлагеном (рис. 1-41). Цепи удерживаются друг около друга за счёт водородных связей, возникающих между амино- и карбоксильными группами пептидного остова разных полипептидных цепей, входящих в состав трёхспиральной молекулы. «Жёсткие» аминокислоты — пролин и гидроксипролин — ограничивают вращение полипептидного стержня и увеличивают тем самым стабильность тройной спирали. Глицин, имеющий вместо радикала атом водорода, всегда находится в месте пересечения цепей; отсутствие радикала позволяет цепям плотно прилегать друг к другу.
Рис. 1-41. Строение молекулы тропоколлагена (фрагмент).
В результате такого скручивания пептидных остовов полипептидных цепей и наличия удлинённой структуры два других радикала из триады аминокислот Гли-Х-Y оказываются на наружной поверхности молекулы тропоколлагена. Некоторые комплементарные участки молекул тропоколлагена могут объединяться друг с другом, формируя коллагеновые фибриллы, причём эти участки расположены таким образом, что одна нить тропоколлагена сдвинута по отношению к другой примерно на 1/4 (рис. 1-42). Между радикалами аминокислот возникают ионные, водородные и гидрофобные связи.
Рис. 1-42. Строение коллагеновой фибриллы (фрагмент).
Важную роль в формировании коллагеновых фибрилл играют модифицированные аминокислоты: гидроксипролин и гидроксилизин. Гидроксильные группы гидроксипролина соседних цепей тропоколлагена образуют водородные связи, укрепляющие структуру коллагеновых фибрилл. Радикалы лизина и гидроксилизина необходимы для образования прочных поперечных сшивок между молекулами тропоколлагена, ещё сильнее укрепляющие структуру коллагеновых фибрилл. Кроме того, к гидроксильной группе гидроксилизина могут присоединяться углеводные остатки (гликозилирование коллагена), функция которых пока неясна.
Таким образом, аминокислотная последовательность полипептидных цепей коллагена позволяет сформировать уникальную по своим механическим свойствам структуру, обладающую огромной прочностью. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней (см. раздел 15).
2. Строение и функция эластина
В отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин (также белок межклеточного матрикса) обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются к свёрнутой конформации.
Эластин содержит в составе около 800 аминокислотных остатков, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией (рис. 1-43). Это как раз тот случай строения первичной структуры, когда отсутствие одной стабильной упорядоченной конформации приводит к возникновению необходимых белку свойств.
Более подробно особенности строения и функционирования эластина рассмотрены в разделе 15.
Рис. 1-43. Случайные конформации молекулы эластина.
В. Классификация белков по химическому строению
Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют «простые белки». Примером простых белков могут служить основные белки хроматина — гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд (более подробно гистоны описаны в разделе 4). Рассмотренный выше белок межклеточного матрикса эластин также относят к простым белкам.
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют «сложные белки». Прочно связанная с белком небелковая часть носит название простетической группы.
Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты — цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции (например, в составе гемоглобина переносит O2, а в составе цитохромов — электроны).
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами — металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют «холопротеин».
Г. Классификация белков по функциям
Белки выполняют в клетках множество биологических функций. По признаку сходства выполняемых белками функций их можно разделить на следующие большие группы.
Ферменты — специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот — аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи.
Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях.
2. Регуляторные белки
К регуляторным белкам относят большую группу белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки- мишени. Например, гормон инсулин выделяется в кровь при повышении концентрации глюкозы в крови после еды и, стимулируя использование глюкозы клетками, снижает концентрацию глюкозы до нормы, т.е. восстанавливает гомеостаз.
Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Например, белок кальмодулин в комплексе с четырьмя ионами Са 2+ может присоединяться к некоторым ферментам, меняя их активность.
Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации (они описаны в разделе 4).
3. Рецепторные белки
Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.
4. Транспортные белки
Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, белок плазмы крови альбумин переносит жирные кислоты и билирубин (продукт распада гема), а гемоглобин эритроцитов участвует в переносе O2 от лёгких к тканям. Стероидные гормоны переносятся в крови специфическими транспортными белками.
Транспортные белки участвуют также в переносе гидрофильных веществ через гидрофобные мембраны. Так как транспортные белки обладают свойством специфичности взаимодействия с лигандами, их набор в клеточной мембране определяет, какие гидрофильные молекулы могут пройти в данную клетку. С помощью белков-переносчиков в клетку проникают глюкоза, аминокислоты, ионы и другие молекулы.
5. Структурные белки
Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Например, как уже говорилось выше, главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий высокую прочность. Другой структурный белок (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие).
Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы.
Защитными свойствами обладают белки свёртывающей системы крови, например, фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
7. Сократительные белки
Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин — фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков — тубулин, из которого построены клеточные органеллы — микротрубочки. Микротрубочки в период деления клетки регулируют расхождение хроматид. Микротрубочки — важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются.
Однако существует большое количество белков, имеющих уникальные функции, которые не вошли в эту довольно простую классификацию.
Д. Семейства родственных белков
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Гомологичными называют последовательности, имеющие много сходных черт. Они содержат во многих положениях одни и те же аминокислоты, называемые инвариантными, а в некоторых положениях могут находиться разные, но близкие по физико-химическим свойствам аминокислотные остатки.
Эти белки имеют поразительно схожие конформации: количество и взаиморасположение α-спиралей и/или β-структур, большинство поворотов и изгибов полипептидных цепей сходно или идентично. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков.
Пример семейства родственных белков — семейство миоглобина, куда включены, кроме самого миоглобина, и все виды гемоглобина.
1. Семейство сериновых протеаз
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз — специфические пептидные связи в белках (часто в других сериновых протеазах).
Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты (рис. 1-44). Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами.
Рис. 1-44. Пространственные структуры эластазы (А) и химотрипсина (Б).
Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами.
Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. В процессе активации нативных белков сериновые протеазы гидролизуют одну или две особенные пептидные связи из сотен связей, имеющихся в белковом субстрате. Это связано с тем, что в нативном белке фермент узнаёт не только аминокислоты, непосредственно формирующие пептидную связь, но и некоторые аминокислотные остатки, окружающие связь, подвергающуюся ферментативному гидролизу.
Более подробно о сериновых протеазах можно прочесть в разделах 9, 14.
2. Суперсемейство иммуноглобулинов
В работе иммунной системы огромную роль играют белки, относящиеся к суперсемейству иммуноглобулинов. Это суперсемейство включает по крайней мере три больших семейства белков, участвующих в иммунной защите организма: семейство иммуноглобулинов, семейство Т-клеточных антигенраспознающих рецепторов и белки главного комплекса гистосовместимости I и II классов, которые в литературе обозначают МНС (от англ. major histocompatibility complex). В это суперсемейство включено также семейство адгезивных белков, участвующих в узнавании определённых типов клеток и их межклеточных взаимодействиях.
Основной критерий включения белков в суперсемейство иммуноглобулинов — их доменная организация, достоверная гомология аминокислотных последовательностей и пространственных структур отдельных доменов. Кроме того, белки этого суперсемейства имеют схожие функции: иммуноглобулины взаимодействуют с чужеродными структурами, находящимися в крови, лимфе, межклеточной жидкости или секретах желёз, а рецепторы Т-лимфоцитов и белки главного комплекса гистосовместимости — с антигенами, находящимися на поверхности клеток данного организма.
3. Семейство иммуноглобулинов
Иммуноглобулины, или антитела, — специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 10 7 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 10 7 видов иммуноглобулинов.
Все иммуноглобулины характеризуются общим планом строения, который мы рассмотрим на примере строения IgG.
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L — от англ. light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н — от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам.
Лёгкие цепи IgG состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоёв с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена (рис. 1-45).
Рис. 1-45. Строение иммуноглобулина G.
Тяжёлые цепи IgG имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СН1 и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют «шарнирной областью»; он придаёт молекуле гибкость.
Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют «биваленты». В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных доменов обеих цепей, а всего лишь 20— 30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител взаимодействовать с соответствующим (комплементарным) антигеном.
Основные функции антител — обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген — антитело зависит от класса антител.
Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ε, y и μ. В соответствии с ними различают 5 классов иммуноглобулинов: А, D, Е, G и М. Особенности строения тяжёлых цепей придают их «шарнирным участкам» и С-концевым областям, характерную для каждого класса конформацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками).
Иммуноглобулины М — первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами, в кровь.
Мембранно-связанная форма иммуноглобулинов М. Созревающие В-лимфоциты, синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой («хвостовой») области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков.
Взаимодействие антигена с рецептором на поверхности В-лимфоцита, вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М. Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46).
Рис. 1-46. Строение пентамерной секреторной молекулы иммуноглобулина М.
В тяжёлых цепях их мономеров отсутствует гидрофобная «хвостовая» часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления неизвестного ранее антигена к иммуноглобулину (рис. 1-47).
Рис. 1-47. Связывание IgM с антигенами бактериальных клеток и их разрушение активированными белками системы комплемента.
Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его «хвостовой» области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами, в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм.
У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1, а в наименьшем — IgGg4). Степень гомологии между этими подклассами очень высока (около 90 — 95%).
IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в «хвостовой» области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах (рис. 1-48).
IgG — единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10 — 15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J (рис. 1-49).
Рис. 1-49. Строение димерной молекулы иммуноглобулина А.
На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство (рис. 1-50).
Рис. 1-50. Транспорт иммуноглобулинов А через эпителиальные клетки в протоки желёз.
Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE — мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток (рис. 1-51).
Рис. 1-51. Выброс биологически активных веществ тучной клеткой в результате присоединения антигена к фиксированным на её поверхности IgE.
После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций.
Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
4. Семейство Т-клеточных антигенраспознающих рецепторов
Если антитела, вырабатываемые В-лимфоцитами, связывают антигены в жидкостях организма (так называемый гуморальный иммунитет), то Т-лимфоциты взаимодействуют с антигенами на поверхности заражённых вирусами и изменённых в результате опухолевой трансформации собственных клеток организма (клеточный иммунитет). Т-лимфоциты узнают антигены только в комплексе с молекулами МНС I или II класса, также присутствующими на клеточной поверхности.
Рецепторы Т-лимфоцитов — гетеродимеры, т. е. состоят из α- и β-цепей. Каждая цепь имеет два иммуноглобулиноподобных домена: вариабельный (V) и константный (С) (рис. 1-52). С-концевые участки каждой цепи встроены в плазматическую мембрану. Единственный антигенсвязывающий участок располагается между двумя вариабельными доменами Vα и Vβ. Количество рецепторов Т-лимфоцитов с разными антигенсвязывающими участками сопоставимо с разнообразием иммуноглобулинов.
Рис. 1-52. Строение рецептора Т-лимфоцитов.
Семейство белков главного комплекса гистосовместимости
Белки главного комплекса гистосовместимости были открыты при изучении вопросов внутривидовой пересадки тканей, откуда и произошло их название. Их называют также белками МНС (см. выше), или белками HLA (от англ. human lymphocyte antigen — человеческие лимфоцитарные антигены), так как впервые они были обнаружены на лимфоцитах человека.
Существует два основных класса молекул МНС: I и II. Молекулы МНС класса I расположены на поверхности практически всех клеток организма человека, а белки МНС класса II только на определённых клетках иммунной системы, называемых антигенпредставляющими клетками. К ним, в первую очередь, относят макрофаги и В-лимфоциты, контактировавшие с антигеном.
Молекулы МНС класса I — гетеродимеры. Они имеют одну полипептидную a-цепь, связанную нековалентными связями с небольшим внеклеточным белком β2-микроглобулином. Полипептидная a-цепь имеет три внеклеточных глобулярных домена (α1, α2, α3), трансмембранный участок и карбоксильный конец, локализованный в цитоплазме (рис. 1-53, А). α3-Домен и β2-микроглобулин имеют конформацию, напоминающую структуру иммуноглобулинов. Домены α1 и α2 содержат вариабельные участки, способные связывать «развёрнутый» антиген (чаще всего пептидный фрагмент чужеродного белка), расположенный на поверхности клеток.
Рис. 1-53. Строение белков главного комплекса гистосовместимости: МНС класса I (А) и МНС класса II (Б).
Молекулы МНС класса II — также гетеродимеры. Они состоят из двух полипептидных цепей — α и β, имеющих по одному консервативному иммуноглобулинподобному домену и по одному вариабельному домену на N-концевых участках. Связывание антигенов происходит в области вариабельных доменов α- и β-цепей (рис. 1-53, Б).
Чужеродные белки в клетке человека (например, белки вирусных частиц), в лизосомах подвергаются ограниченному протеолизу, и небольшие фрагменты этих белков вместе с белками МНС класса I или II экспонируются на поверхности клеточной мембраны.
Комплексы пептид — белок МНС узнаются рецепторами Т-лимфоцитов. В результате происходит специфическое взаимодействие (рис. 1-54), активация Т-лимфоцита и развитие иммунной реакции. Так, взаимодействие цитотоксического Т-лимфоцита с комплексом антиген — МНС I на поверхности заражённой вирусом клетки приводит к высвобождению лимфоцитом специальных белков, вызывающих повреждение и гибель заражённой клетки.
Рис. 1-54. Специфическое взаимодействие рецептора цитотоксического Т-лимфоцита с комплексом антиген-МНС I белком.
Е. Изофункциональные белки
Изофункциональные белки — семейства белков, выполняющих почти одинаковую или близкую функцию, но небольшие особенности строения и функционирования некоторых членов этого семейства могут иметь важное физиологическое значение. Пример таких белков — изоформы гемоглобина человека: НbА, НbА2, НbF и другие, рассмотренные выше. Все они представляют собой тетрамеры, но состоят из разного набора протомеров α, β, y, δ. Гемоглобины выполняют одинаковую функцию — присоединяют O2 и переносят его в ткани. Однако каждый из них обладает функциональными особенностями. Так, гемоглобин F имеет большее сродство к O2, чем НbА, и благодаря этому обеспечивает диффузию O2 от НbА из крови матери к НbF в крови плода.
Изобелки — множественные формы белка, обнаруживаемые в организмах одного вида. Белки, выполняющие одинаковые функции в организмах разных биологических видов, носят название «гомологичные белки». Например, цитохром С — митохондриальный белок, участвующий в биологическом окислении, присутствует у многих видов животных. Цитохромы С курицы и утки отличаются лишь двумя аминокислотными остатками в первичной структуре, выполняют одинаковую функцию, но так как они принадлежат разным видам, то их относят к гомологичным белкам.
К изобелкам относят также множество изоформ структурного белка коллагена (см. раздел 15). Многие ферменты имеют несколько изоформ и носят название изоферментов (см. раздел 2).
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2021 Все права на дизайн сайта принадлежат С.Є.А.