Чем определяется координационная ненасыщенность атома в соединении
Большая Энциклопедия Нефти и Газа
Координационная ненасыщенность
Нитрозил-катион вследствие его большей электрофильности и координационной ненасыщенности является более активным диазотирующим агентом, чем ангидрид и галоидоангидриды азотистой кислоты. Поэтому с помощью нитрозил-серной кислоты могут быть продиазотированы такие слабоосновные амины ( три-нитроанилин, аминоантрахиноны), у которых плотность электронов у атома азота настолько мала, что с обычными, менее электрофильными, агентами диазотирования они с заметной скоростью не реагируют. Известное значение может иметь и концентрация диазотирующего агента, более высокая у нитрозил-катиона в серной кислоте, чем у N2Os и NOC1 в водном растворе. NjOs и NOC1, указывает, что таким образом может быть хорошо объяснено влияние природы аниона кислоты на скорость реакции. [17]
Пятивалентный хром в окиснохромовых катализаторах характеризуется координационной ненасыщенностью и с донорами электронов образует координационные комплексы. Образование комплексов пятивалентного хрома с основаниями Льюиса ( Н2О, HC1, NH3, R2O) сопровождается изменением интенсивности и формы сигнала ЭПР [63, 68], что обусловлено изменением электронной плотности на атоме хрома и повышением его координационного числа. [18]
С другой стороны, по Вейлю [3], координационная ненасыщенность атома кремния увеличивается с ростом числа связанных с ним групп ОН. [20]
Причину реакций между кислотами и основаниями Усано-вич приписывает координационной ненасыщенности их атомов. Он придерживался наиболее широкого понимания кислотно-основных реакций, при которых окислительно-восстановительные процессы считаются частным случаем кислотно-основного взаимодействия. [21]
Причину реакции между кислотами и основаниями Усанович приписывает координационной ненасыщенности их атомов. [22]
По теории Вернера, причиной присоединения ангидридами воды является координационная ненасыщенность металлоида в ангидриде. [26]
Химические свойства железопорфиринов определяются ароматическим характером порфиринового кольца, координационной ненасыщенностью ( железо, имеющее шесть координационных мест, связано лишь с четырьмя атомами азота порфиринового кольца) и характером замещающих групп. [28]
Стабилизированные в каркасе цеолита при дегидратации катионы Си2 обладают значительной координационной ненасыщенностью и, следовательно, способны координировать около себя донорные молекулы. [29]
Для того чтобы отразить различие граней, связанное со степенью координационной ненасыщенности атомов на поверхности, удобно использовать квазнхимические формулы, которые применяются для описания структуры неупорядоченных твердых тел. В этих формулах вместе с символом элемента, образующего узел решетки определенного типа, перечисляются также атомы ( ли-ганды), формирующие одну или несколько координационных сфер данного узла. [30]
Большая Энциклопедия Нефти и Газа
Координационная ненасыщенность
Координационная ненасыщенность допускает присоединение олефина, вероятно, с образованием я-комплекса. Затем гидрид-ион мигрирует в комплексе с образованием алкильного производного. [1]
Благодаря координационной ненасыщенности и наличию кратных связей в ароматических ядрах реакция их нитрования начинается со взаимодействия нитрующего агента с атомом углерода; в случае предельных углеводородов действие нитрующего агента ( N02) направлено на атом водорода. [4]
Благодаря координационной ненасыщенности и наличию кратных связей в ароматических ядрах реакция их нитрования начинается со взаимодействия нитрующего агента с атомом углерода; в случае предельных углеводородов действие нитрующего агента ( NOa) направлено на атом водорода. [5]
Из-за координационной ненасыщенности молекул тетрагалиды молекулярной структуры химически активны. [6]
Вследствие координационной ненасыщенности молекул тетрагалиды молекулярной структуры химически активны. [7]
Из-за координационной ненасыщенности молекул те-трагалогениды химически активны. [8]
Вследствие координационной ненасыщенности молекул тетрагалогениды молекулярной структуры химически активны. [9]
Взаимодействие галогенидов металлов с координационной ненасыщенностью непосредственно с каучуками также благоприятствует вулканизации. [11]
Таким образом, уменьшение степени координационной ненасыщенности кобальта за счет координации им более полярного разбавителя или образования смешанного комплекса с ТОА понижает его способность соэкстрагировать марганец. [13]
Чем определяется координационная ненасыщенность атома в соединении
4.3.3.3. Ранние химические теории цветности
Уровни энергии молекул в основном и возбужденном состояниях, от которых зависит энергия возбуждения и равная ей энергия фотона, избирательно поглощаемого данным веществом и обусловливающего его цвет, определяются химическим строением вещества.
Основоположник теории строения органических соединений А.М. Бутлеров впервые предпринял попытку найти зависимость между химическим строением молекул и их способностью избирательно поглощать световые лучи. В 1864 г. во «Введении к полному изучению органической химии» он отмечал, что введение в бесцветные органические соединения некоторых групп, способных восстанавливаться (нитро-, нитрозо-, например) сообщает веществу окраску, а при восстановлении этих групп окраска исчезает. Таким образом, Бутлеров установил фундаментальный для теории цветности факт — ненасыщенность молекул веществ, обладающих цветом.
Хромофорно-ауксохромная теория. В 1868 г. немецкие химики Гребе и Либерманн подтвердили и развили идеи Бутлерова о связи ненасыщенности органических соединений с их окраской. В 1876 г. русский ученый П.П. Алексеев отмечал, что интенсивно окрашенные соединения наряду с ненасыщенными группами должны содержать и такие заместители, как гидрокси- и аминогруппы. Эти идеи получили законченное выражение в хромофорно-ауксохромной теории цветности, сформулированной в 1876 г. немецким ученым О. Виттом. Согласно этой теории, причиной окраски органических соединений является присутствие в их молекулах ненасыщенных: нитро- (–NO2), нитрозо- (–N=O), карбонильной (–C(О)–), азо- (–N=N–), виниленовой (–CH=CH–) и др. Эти группы были названы хромофорными группами, или хромофорами, т. е. носителями цветности (от греч. слов «хрома» — цвет, «форео» — ношу). Окрашенные соединения, содержащие хромофоры, были названы хромогенами. Эти соединения еще не являются красителями, т. к. обладают неинтенсивной окраской и не имеют сродства к волокнам. Для превращения хромогена в краситель в его молекулу необходимо ввести ауксохромные группы, или ауксохромы — усилители цветности (от греч. слова «ауксо» — увеличиваю). К ауксохромам относятся группы: гидрокси-(–OH), амино-(–NH2), меркапто-(–SH) и др.
Схема красителя по О. Витту:
Хромофорно-ауксохромная теория цветности оказала большое влияние на развитие химии красителей, позволила предсказать возможность синтеза большого числа новых окрашенных соединений и систематизировать их. На основе этой теории была создана классификация красителей (по типу хромофор).
Теория координационно-ненасыщенных атомов. После открытия свободных радикалов, оказавшихся окрашенными соединениями, Пфейфер (1911) включил в число хромофоров трехвалентный углерод, а Дилтей (1920) все многообразие хромофорных групп свел к нескольким хромофорным атомам. По мнению Дилтея, координационная ненасыщенность атома является признаком его хромофорного характера. Ненасыщенность выражается в том, что атом связан с меньшим числом других атомов, чем это соответствует его максимальному координационному числу. Например, атомы углерода, координационное число которого 4, в алмазе и парафине не являются хромофорами, т. к. каждый связан с четырьмя другими атомами и, следовательно, координационно насыщен. Однако в графите, этилене, бензоле и подобных соединениях атомы углерода являются хромофорами, т. к. связаны только с тремя другими атомами. Если хромофорных атомов в соединении достаточно много, оно становится окрашенным, причем окраска соединения усиливается в результате ионизации молекул. Теория Дилтея была дополнена Вицингером (1926), который преобразовал понятие об ауксохромах и дал новую классификацию красителей.
Хиноидная теория. Хромофорно-ауксохромная теория и теория координационно-ненасыщенных атомов объясняли окраску соединений только наличием хромофорных и ауксохромных групп. Эти теории не принимали в расчет остальную часть молекулы, которая рассматривалась лишь как пассивный носитель этих групп, и не учитывали, в частности, сильнейшее влияние, которое оказывали некоторые заместители на реакционную способность и другие свойства ароматических соединений. В 1888 г. Армстронг и Нецкий создали хиноидную теорию цветности, в которой появление окраски соединения объяснялось перестройкой обычного ароматического (бензоидного) ядра в хиноидное. Эта теория утверждала, что само по себе ни наличие ароматического ядра, ни наличие хромофоров и ауксохромов Витта не делают вещество окрашенным. Например, 1,4-циклогексадион (1), содержащий две карбонильные группы — хромофоры Витта, и гидрохинон [бензолдиол-1,4 (2)], имеющий ароматическое кольцо и две гидроксигруппы — ауксохромы Витта, бесцветны. Однако п-бензохинон [циклогексадиен-2,5-дион-1,4 (3)], обладающий хиноидным ядром, окрашен в желтый цвет.
Сторонники хиноидной теории считали, что все окрашенные органические соединения имеют хиноидное строение. На основе этой теории была создана классификация красителей (по типу хиноидных систем).
Осцилляционная теория. Хромофорно-ауксохромная и хиноидная теории цветности по-разному объясняли причины окраски органических соединений. Однако обе теории рассматривали молекулу окрашенного вещества как нечто неизменное и совершенно не учитывали, что эта молекула взаимодействует со светом. Между тем новые факты свидетельствовали о подвижности связей между атомами в молекуле; в результате появились теории, которые пытались установить зависимость между изменениями связей в молекуле и поглощением света.
Согласно осцилляционной теории А.Е. Порай-Кошица (1910 г.), избирательное поглощение света происходит в результате интерференции между колебаниями световых лучей и осцилляцией (перемещением) связей внутри молекул ненасыщенных соединений. Чем больше скорость осцилляции связей, тем больше частота колебаний поглощаемых лучей и, следовательно, меньше длина волны этих лучей. Таким образом, теория А.Е. Порай-Кошица связывала поглощение света с процессами изменения связей в молекуле. Когда появилась электронная теория валентности, раскрывшая физическую природу связей между атомами, эта идея получила полное признание.
Переход к электронной теории цветности. Основы современной электронной теории цветности органических соединений были заложены в многочисленных работах В.А. Измаильского, начатых с 1913 г. Основная идея Измаильского заключается в том, что способность органических соединений поглощать свет определяется особым электронным состоянием их молекул. Это состояние возникает при наличии достаточно длинной цепочки сопряженных двойных связей и присоединенных к ней электронодонорных (поставляющих электроны) и электроноакцепторных (принимающих электроны) заместителей. Развитие и уточнение представлений В.А. Измаильского привело к созданию принятой в настоящее время теории цветности органических соединений.
4.3.3.4. Энергетические уровни молекул
Энергия фотонов электромагнитных излучений, поглощаемая молекулой, идет на увеличение ее внутренней энергии, т. е. на перевод молекулы из основного состояния в возбужденное. Поскольку полная энергия молекулы складывается из вращательной энергии Ев, колебательной энергии Ек и энергии электронов Еэ (Е = = Ев + Ек + Еэ), энергия поглощенных фотонов может расходоваться на увеличение каждого из этих слагаемых. Наибольший вклад в эту сумму вносит энергия электронных переходов.
Диапазон энергии электронных переходов достаточно широк: от значений ≈110 кДж/моль, соответствующих излучению с длиной волны λ = 1100 нм, что характерно для ближней ИК-области спектра, до (4 · 10 3 )–(4 · 10 6 ) кДж/моль, соответствующих излучениям с длинами волн порядка 30–0,03 нм, что характерно для рентгеновских лучей. В этих границах находятся и световые лучи видимой части спектра (ΔЕ = 158÷300 Дж/моль, λ = 760÷400 нм), поглощение которых сопровождается возникновением окраски. Этой энергии недостаточно для перевода в возбужденное состояние электронов внутренних электронных слоев атомов, которые прочно удерживаются притяжением атомного ядра, и поэтому эти электроны не участвуют в поглощении света в видимой и ближних УФ- и ИК-областях спектра. Электроны наружного электронного слоя атомов (валентные электроны) слабее удерживаются ядром и переходят в возбужденное состояние значительно легче — при поглощении порций энергии порядка 110–1050 кДж/моль. Конкретная величина энергии возбуждения определяется характером электронных переходов, в которых участвуют валентные электроны.
Современная теория электронных спектров основывается на квантово-механических представлениях, и наиболее широко в этом случае применяется метод молекулярных орбиталей (МО). Метод МО предполагает, что энергетические уровни, на которых располагаются валентные электроны, — это молекулярные орбитали, которые образуются как линейные комбинации атомных орбиталей (принцип МО ЛКАО). Каждая молекула имеет свой набор молекулярных орбиталей со своими волновыми функциями. В органических соединениях это связывающие σ- и π-орбитали, несвязывающая n-орбиталь и разрыхляющие (антисвязывающие) σ*- и π*-орбитали, причем каждым связывающим σ- и π-орбиталям соответствуют разрыхляющие σ*- и π*-орбитали. Относительное расположение энергетических уровней валентных электронов показано на рис. 4.3.5.

Рис. 4.3.5. Энергетические уровни и типы электронных переходов в простых (а) и сложных (б) молекулах
В соответствие с принципом Паули на каждой орбитали может размещаться не более двух электронов. Обычно в основном состоянии все связывающие и несвязывающие орбитали заняты. Связывающие орбитали заняты валентными электронами, образующими химическую связь между атомами. Образование связи всегда сопровождается выигрышем энергии, вследствие чего уровень энергии связывающих орбиталей значительно ниже уровня энергии атомных орбиталей. Несвязывающие орбитали занимают валентные электроны, не участвующие в образовании связей с другими атомами. Это неподеленные пары электронов, локализованные в поле одного ядра; они имеют энергию того же порядка, что и валентные электроны в атоме.
Переход молекулы в возбужденное состояние означает переход валентных электронов на свободные орбитали с более высокими уровнями энергии, т. е. разрыхляющие орбитали. Различают переходы: σ→σ*, π→π*, n→σ* и n→π*.
Теоретические основы координационной химии



Краткая история становления координационной химии как самостоятельной науки. Основные положения координационной теории А.Вернера. Координационная ненасыщенность атомов и возможность образования комплексных (координационных) соединений. Теория Льюиса-Сиджвика и Косселя-Магнуса. Состав комплексных соединений. Эффективный атомный номер (ЭАН) комплексообразователя, “правило 18 электронов” и “правило 32 электронов”.
Изомерия комплексных соединений. Основные виды структурной и пространственной изомерии.
Химическая связь в комплексных соединениях и особенности их строения. Метод валентных схем в координационной химии. Спинспаренные и спинсвободные, внешне- и внутреннеорбитальные комплексные соединения. Метод молекулярных орбиталей в координационной химии. σ- и π- комплексы. Орбитальные молекулярные диаграммы. Теория кристаллического поля в координационной химии (ТКП). Энергия стабилизации кристаллическим полем лигандов (ЭСКП). Расчет величины ЭСКП в единицах параметра расщепления (∆) и в единицах энергии (кДж/моль). Зависимость ЭСКП от электронной конфигурации центрального атома и от силы и симметрии поля лигандов. Расщепление d- и f-АО комплексообразователя в электростатических полях лигандов различной величины и различной симметрии. Факторы, влияющие на величину параметра расщепления. Теорема центра тяжести термов. Взаимосвязь ∆ и ЭСКП (δ). Оценка величины ∆ в единицах энергии (кДж) с применением ЭСП.
Чем определяется координационная ненасыщенность атома в соединении
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
Курс лекций для студентов химфака ЮФУ (РГУ)
ИСТОРИЯ КООРДИНАЦИОННОЙ ХИМИИ
Координационная теория Вернера
Теория координационных соединений, предложенная А. Вернером в 1893 году, до сих пор является основной теорией координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения.
1. Большинство элементов проявляет два типа валентности – главную и побочную.
2. Атом элемента стремится насытить не только главные, но и побочные валентности.
3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства.
В современной химии синонимом главной валентности является степень окисления элемента (обозначим ее сплошной линией), а побочная валентность определяется как координационное число, то есть количество атомов непосредственно связанных с металлом при насыщении его побочной валентности (обозначим ее пунктирной линией).
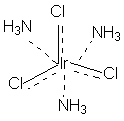
В соответствии с изложенными представлениями Вернера строение первого из указанных в таблице 1 комплексов выглядело так, как показано ниже. Для остальных соединений стехиометрическое соотношение исходных веществ таково, что молекул аммиака не хватает для насыщения всех шести побочных валентностей и их насыщают ионы хлора. При этом хлор, насыщающий эти валентности меняет свое состояние и уже не может обмениваться в реакциях ионного обмена. Те же ионы хлора, которые насыщают только главные валентности имеют те же свойства, что и в исходном хлориде кобальта и, как и в последнем, могут замещаться или обеспечивать электропроводность комплекса.
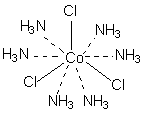
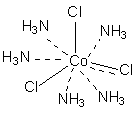
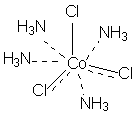
В последнем соединении все три хлора участвуют не только в насыщении главной, но и побочных валентностей. В связи с этим в нем нет «подвижных» ионов хлора и он не способен на ионные реакции и не проводит электрический ток.
Главная валентность обусловлена, как уже упоминалось, степенью окисления кобальта (+3), то есть электростатическим притяжением трех однозарядных ионов хлора и одного трехзарядного иона кобальта. Побочная же валентность обусловлена так называемым явлением координации, которое, с современных позиций, может иметь различную природу. Те ионы, атомы, молекулы, которые координируются ионом металла называют лигандами; вместе с ионом металла они образуют так называемую внутреннюю координационную сферу. Не трудно заметить, что, несмотря на различие в строении комплексов, количество лигандов в каждом случае равно шести, однако в первом из соединений ни один из ионов хлора не является лигандом, так как не входит во внутреннюю координационную сферу, а образует так называемую внешнюю сферу противоионов, которая для последнего из соединений в ряду полностью отсутствует.
Ионы, не входящие во внутреннюю координационную сферу, при растворении комплекса обуславливают его электропроводность. В соответствии с этим диссоциацию комплексов можно записать так:
Таким образом, первые два тезиса теории Вернера закрывают вопросы 1 – 3. Остановимся подробнее на третьем тезисе теории Вернера, а именно на том, что побочные валентности фиксированы в пространстве и определяют геометрию комплекса и его стереохимию.
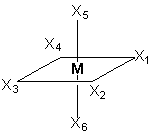
При координационном числе 6, возможны три способа расположения шести точек в пространстве, относительно центра координации – то есть атома металла. Это правильный шестиугольник, правильный (или искаженный) октаэдр и центрированная правильная трехгранная призма, изображенные на рисунке 1.
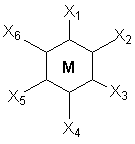
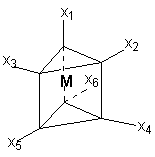
Рисунок 1. Возможные фиксированные положения лигандов в пространстве
при координационном числе шесть – шестиугольник, призма и октаэдр.
Во времена Вернера рентгено-струкутрный анализ еще не был разработан, как метод определения пространственной структуры соединений, поэтому был использован следующий «остроумный» способ определения геометрии комплексов. Он состоял в сравнении количества реально существующих изомеров комплекса (полученных при всевозможных вариациях условий синтеза) с теоретически найденным числом изомеров, возможных только исходя из предполагаемой геометрической модели. При этом варьировалось также количество различных по типу лигандов, которые мы назовем X и Y.
Для шестикоординированного иона кобальта полученные результаты сведены в таблице 2.
Таблица 2. Теоретически возможные и практически найденные
пространственные изомеры шестикоординированного
комплексного иона Сr 3+
Количество реальных изомеров
(Y1Y2)
(Y1Y3)
(Y1Y4)
2
(Y1Y2)
(Y1Y3)
3
(Y1Y2Y3)
(Y1Y2Y4)
(Y1Y3Y5)
3
(Y1Y2Y3)
(Y1Y2Y4)
(Y1Y3Y5)
Обратим внимание на два обстоятельства. Во-первых, заместители типа Х заполняют оставшиеся положения в структурах и их рассмотрение опускается. Во-вторых, октаэдр является правильным, то есть любая пара лигандов, расположенных напротив друг друга может быть представлена на оси, а оставшиеся образуют «экваториальную» плоскость. Если октаэдр является искаженным (вытянутым вдоль оси четвертого порядка), то аксиальные положения отличаются от экваториальных. В этом случае количество теоретически возможных изомеров возрастет.
Из таблицы можно сделать вывод, что единственным возможным пространственным строением шестикоординированного иона кобальта является октаэдрическое, так как лишь для него наблюдается полное совпадение количеств теоретических изомеров и препаративно выделенных.
Copyright © А. Н. Морозов, 2008.
- Чем определяется конфиденциальность информации
- Чем определяется коэффициент деформации длиной пружины