Чем определяется гидрофобность и гидрофильность липидов входящих в состав клеточных мембран
Мембранные липиды. Фосфолипиды, гликолипиды, стероиды
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Мембранные липиды. Состав биологических мембран
В состав биологических мембран входят представители трех классов веществ, обмен которых составляет основу метаболизма: это белки, жиры (липиды) и углеводы. В весовом отношении белки составляют 40–60%, согласно некоторым данным от 20% до 80%, остальное приходится на долю липидов. Часть углеводов представлена свободными олигосахаридами, а часть входит в состав сложных липидов (гликолипиды) или сложных белков (гликопротеиды). Белковый состав мембран чрезвычайно разнообразен, он в значительной мере определяет свойства мембран и их функциональную активность. Мембранные белки, как правило, почти не отличаются от растворимых по количеству входящих в них гидрофобных аминокислот. Однако эти гидрофобные аминокислоты сгруппированы в мембранных белках в ряд доменов так, что гидрофильных групп пептидной цепи недостает для их маскировки. Такие белки не активны вне гидрофобного окружения. Мембраны предоставляют им возможность стабилизировать свою структуру и нормально функционировать.
ФОСФОЛИПИДЫ, ГЛИКОЛИПИДЫ, СТЕРОИДЫ
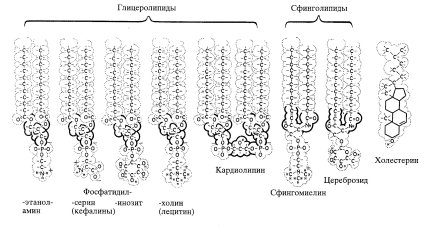
Липиды клеточных структур эукариотических клеток представлены 3 основными группами: фосфолипиды, гликолипиды и стероиды. Распространение и свойства фосфолипидов изучены наиболее детально.
Фосфолипиды подразделяются на 2 группы:
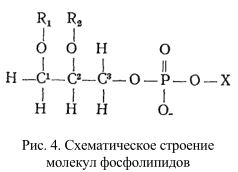
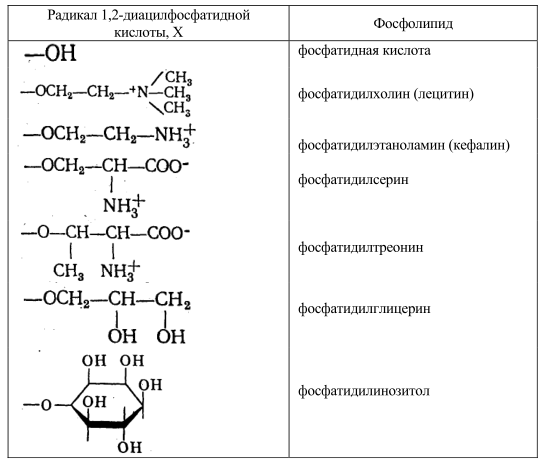
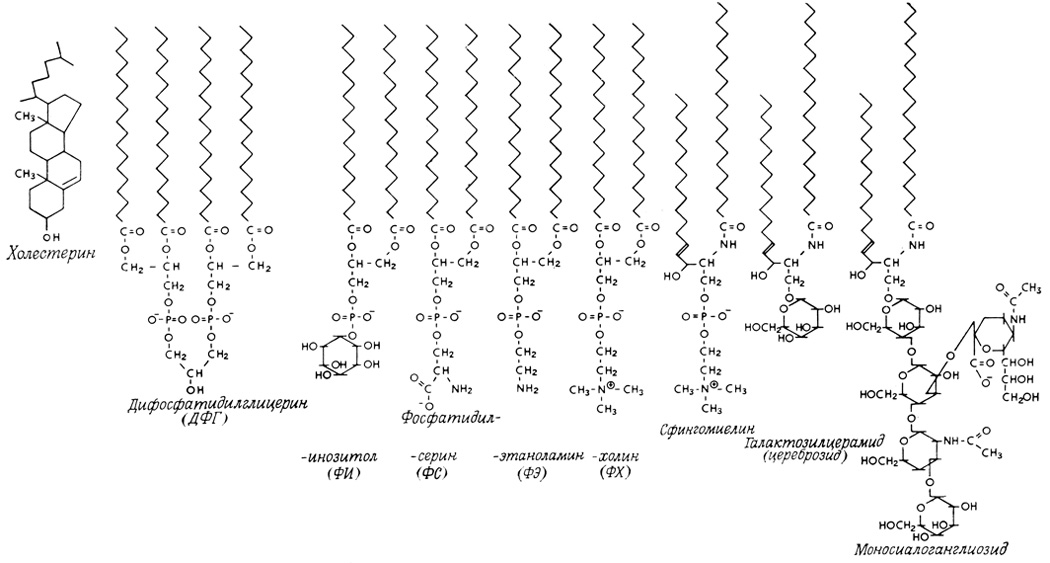
Глицерофосфолипиды представляют собой производные фосфатидной кислоты, к гидроксилу фосфорной кислоты которой сложноэфирной связью присоединен радикал Х (рис. 4., табл. 1), где R1 и R2 – ацильные остатки жирных кислот, содержащих от 12 до 18 атомов углерода (как правило, четное количество). В названия фосфолипидов, потерявших одну из двух ацильных цепей, вводится приставка «лизо». Лизофосфолипиды обнаруживаются в мембранах в небольших количествах – появление этих веществ приводит к нарушению структуры бислоя и лизису клеток.
Таблица 1. Классификация фосфолипидов осуществляется по структуре полярных радикалов
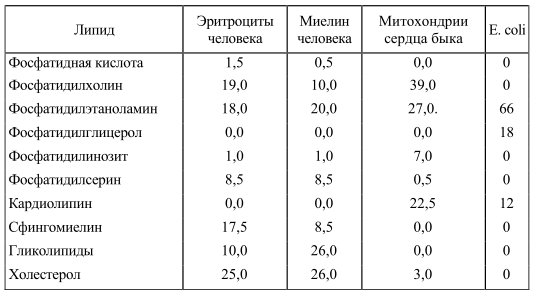
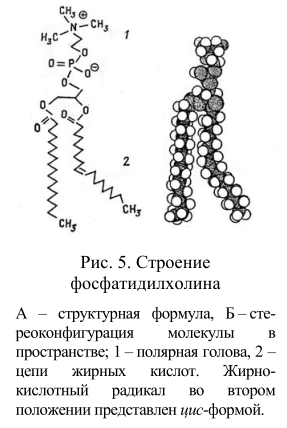
Характеристика липидного состава некоторых мембран животных представлена ниже (табл. 2). Видно, что основными липидами мембран животных клеток являются глицерофосфолипиды: фосфатидилхолин и фосфатидилэтаноламин. Структура фосфатидилхолина представлена на рисунке 5. Наиболее часто встречающиеся фосфолипиды построены по единому плану, их молекулы стерически хорошо соответствуют друг другу. В то же время, огромное разнообразие фосфолипидов обеспечивается различием жирных кислот, которые входят в состав их молекул. Так, есть несколько десятков природных видов фосфатидилхолина, причем диолеилфосфатидилхолин сильно отличается по своим свойствам от дипальмитоилфосфатидилхолина.
Таблица 2. Липидный состав некоторых биологических мембран (в % от общего их количества)
Существует несколько групп фосфолипидов, отличающихся от приведенных в таблице 1 по своему строению:
2) диольные фосфолипиды
В молекуле плазмалогена первый углерод глицерина (С 1) вместо ацильной группы присоединяет альдегид (рис. 4). Радикал Х в плазмалогенах мышц представлен холином, в плазмалогенах мозга – серином или этаноламином. Диольные фосфолипиды характеризуются тем, что вместо глицерина в составе их молекул содержатся двухатомные спирты: этиленгликоль или пропандиол; это одноцепочечные липиды. По физико-химическим свойствам, например растворимости, диольные фосфолипиды напоминают лизоформы фосфолипидов. В отношении клеточных мембран они обладают более сильной разрушающей способностью, чем лизолецитин. В малых дозах они не повреждают мембрану, а лишь изменяют ее свойства, например, повышают проницаемость для небольших молекул и ионов. В больших дозах они вызывают гемолиз эритроцитов, снижают рецепцию ацетилхолина, модифицируют иммунные реакции. По-видимому, некоторые клетки используют это свойство – начинают интенсивно синтезировать диольные липиды в период быстрого роста и прекращают их образование, когда клеточный рост замедляется. Возможно, это связано с тем, что в период роста клеток их мембраны должны быть более лабильными. Они присутствуют в виде незначительных примесей в органах и тканях, характеризующихся усиленной активностью (созревание семян, регенерация печени и т.д.).
Биологическое действие диольных фосфолипидов основано на их способности модифицировать структуру мембраны. Любопытно, что существуют организмы, которым не страшны высокие концентрации диольных липидов. Клетки морских звезд, например, могут накапливать очень много диолов без вреда для их собственных мембран, хотя механизм защиты клеточных мембран от этих соединений не известен.
Жирнокислотный радикал во втором положении представлен цис-формой.
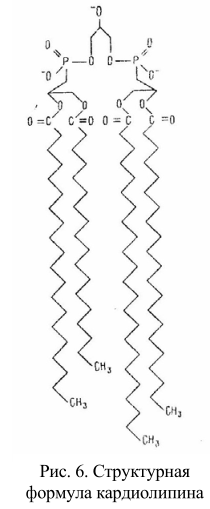
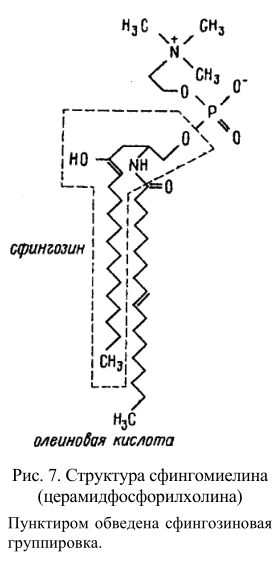
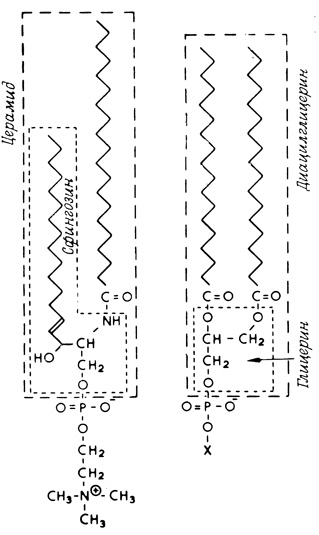
Дифосфатидилглицериды – наиболее широко распространенным представителем этой группы фосфолипидов является кардиолипин – непременный компонент митохондриальных мембран, выделенный первоначально из сердечной мышцы (рис. 6). Как упоминалось выше, кроме глицерофосфолипидов в группу фосфолипидов входят и сфинголипиды, которые можно представить как производные церамида (жирнокислотного эфира ненасыщенного аминоспирта сфингозина) и монофосфорных эфиров спиртов. В случае наиболее распространенного сфинголипида – сфингомиелина таким эфиром является фосфорилхолин (рис. 7).
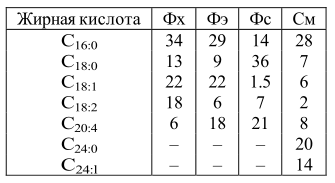
Сфингомиелин содержится в больших количествах в белом веществе мозга, в миелиновых оболочках нервных стволов. Жирные кислоты, входящие в его состав, – длинноцепочечные и содержат мало двойных связей. Обычно это лигноцериновая С 24:0 и невроновая С 24:1 кислоты. В сером веществе мозга до 70% жирных кислот сфингомиелина представлено стеариновой кислотой С 18:0.
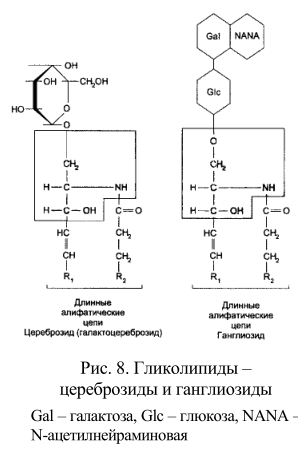
Гликолипиды клеточных мембран – гликозильные производные церамида, представлены цереброзидами, сульфатидами и ганглиозидами (рис. 8). В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа – углеводный остаток, присоединенный гликозидной связью к гидроксильной группе у первого углеродного атома церамида (рис. 9).
В зависимости от длины и строения углеводной части различают цереброзиды, содержащие моно- или олигосахаридный остаток, и ганглиозиды, к ОН-группе которых присоединен сложный, разветвленный олигосахарид, N-ацетилнейраминовую кислоту (рис. 8). Гликолипиды в большом количестве присутствуют в мембранах миелина. Природной функцией мембранных ганглиозидов является участие в дифференцировке нейрональной ткани, ганглиозиды других клеток – лимфоцитов, определяют видоспецифичность и регулируют межклеточные контакты. Накапливается все больше фактов, характеризующих роль различных гликолипидов в функции иммунокомпетентной системы организма. При определенных состояниях организма некоторые ганглиозиды могут являться модуляторами иммунного ответа. Стероиды – спирты со стерановым скелетом, к которым относятся как немембранные липиды (из них наиболее важны гормоны), так и компоненты мембран. В перечень мембранных компонентов стероидного ряда входят холестерин, ситостерин, тетрахименин. В тканях животных распространен холестерин.
В растительных клетках холестерин не обнаружен, его заменяют фитостерины. У бактерий стероиды отсутствуют. Холестерин и его эфиры – непременные составляющие плазматических мембран клеток животных. При этом холестерин легче встраивается в мембрану, чем его эфиры (рис. 10). Молекула холестерина не содержит длинных прямых цепочек, а состоит из четырех колец; крайнее шестичленное кольцо соединено с полярной гидроксильной группой (ОН), а наиболее отдаленное от него пятичленное кольцо – с разветвленной углеводородной цепочкой из восьми атомов углерода (рис. 10).
Таким образом, молекулы холестерина, как и другие липидные молекулы, имеют полярную голову и вытянутую в длину неполярную часть. Поэтому они хорошо встраиваются в бислойные липидные структуры, образующие клеточные мембраны (рис. 10). При образовании эфиров холестерина (через гидроксильную группу) связь молекулы с бислоем ослабляется, что облегчает его вытеснение из мембраны. Особенно много холестерола содержится в наружных мембранах. Например, в плазматической мембране клеток печени холестерин составляет около 30% всех мембранных липидов.
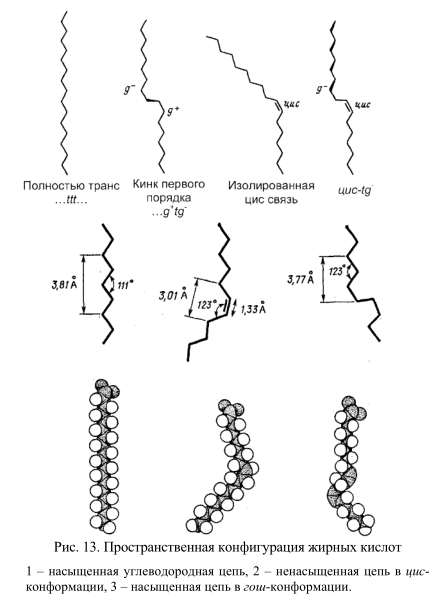
ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ
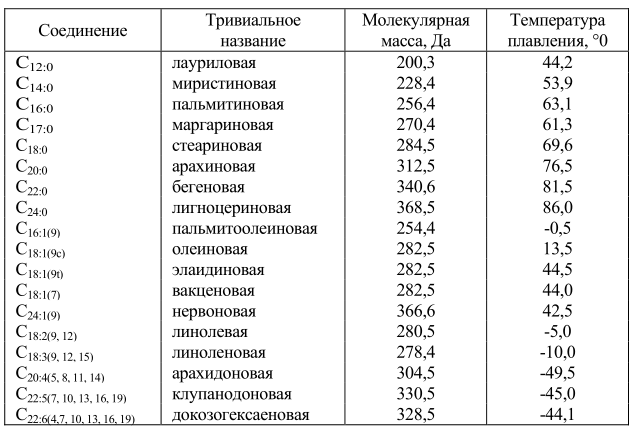
И фосфо-, и гликолипиды включают в состав молекул различные жирнокислотные радикалы (табл. 3). Холестерин и его аналоги также способны образовывать эфиры с разнообразными жирными кислотами. Вследствие этого свойства образующихся при этом липидов сильно варьируют. При всем разнообразии жирных кислот преобладающими для данной ткани являются обычно две или три из них.
В организме животных кроме пальмитиновой и олеиновой кислот содержатся большие количества стеариновой кислоты, а также и более высокомолекулярные кислоты с числом атомов углерода 20 и более. Как правило, они имеют четное количество атомов углерода; жирные кислоты с нечетным числом атомов встречаются только в составе цереброзидов и ганглиозидов.
Таблица 3. Распространенные жирные кислоты в составе мембранных липидов
Углеродные связи в молекулах жирных кислот имеют различную конформацию (рис. 13). По своей структурной конфигурации насыщенные жирные кислоты сильно отличаются от ненасыщенных. Насыщенные жирные кислоты могут принимать множество конфигураций вследствие высокой свободы вращения вокруг одиночных С-С связей. Энергетически наиболее выгодной является транс-конфигурация. Ненасыщенные жирные кислоты имеют жесткую структуру, поскольку вращение вокруг двойных связей невозможно. Они существуют либо в транслибо в цис-конфигурации. Ненасыщенные жирные кислоты содержат двойные связи почти всегда в цис-конформации (Рис. 13), транс-ненасыщенные жирные кислоты в природе почти не встречаются. Исключение составляет лишь вакценовая кислота – конформационный антипод олеиновой кислоты. Температура плавления ее 44ºС, в то время как олеиновая кислота плавится при температуре 13,5ºС.
Цис-конфигурация двойной связи обусловливает изгиб цепи под углом приблизительно 30º. По этой причине цис-ненасыщенные жирные кислоты с одной двойной связью вызывают локальные возмущения бислоя. При этом длина такой цепи уменьшается, а занимаемый ею объем возрастает (рис. 13). В области локализации двойных цис-связей образуются изгибы (так называемая гошформа).
При повышении температуры тепловая подвижность жирнокислотных цепей приводит к спонтанному возникновению изгибов. Если изгибы, соответствующие гош-конформации, появляются на близлежащих участках жирнокислотной цепи, эта область может принимать вид петли или полости (кинк). В результате взаимопревращения транс- и гош-конформаций (так называемого трансгош-перехода) кинки могут «скользить» вдоль цепи, обеспечивая перемещение их содержимого поперек мембраны. Таким образом, может осуществляться диффузия захваченной воды через гидрофобный бислой.
При повышении плотности упаковки бислоя конфигурационная подвижность С-С-связей ограничивается. В таком бислое подвижность цепей ограничена согласованными колебаниями или вращательной подвижностью около точки прикрепления жирнокислотных радикалов к полярной «головке» фосфолипида. В этой ситуации в бислое наиболее предпочтительны две конформации цепи: когда вся цепь находится в транс-конфигурации или когда имеется «двойной гош», то есть изгибы, возникающие на двух соседних участках цепи вследствие образования гош-конформации, компенсируют друг друга, и вся цепь в целом не имеет изгибов.
У бактерий полиненасыщенные жирные кислоты, как правило, отсутствуют. Для их мембран также характерно более высокое содержание свободных жирных кислот, которые в мембранах растений и животных содержатся в исчезающе малых количествах. Синтез 16–18-углеродных жирных кислот осуществляется в цитоплазме. Удлинение жирнокислотных цепей осуществляется ферментными системами эндоплазматического ретикулума при участии НАДФН и малонил-КоА. Процесс удлинения может протекать также и в матриксе митохондрий. Образование двойных связей происходит при участии десатураз. У животных превращения олеил-КоА в олеинол-КоА (необходимых для вторичной десатурации) не происходит, вследствие чего линолевая, линоленовая и арахидоновая (полиненасыщенные) кислоты являются для них незаменимыми.
Ввиду высокой скорости обмена мембранных липидов синтез мембранных компонентов постоянно требует большого количества жирных кислот для образования диацилглицеридов. Из них образуются фосфатидная кислота, лежащая в основе обмена фосфолипидов, или галактозилдиглицерид, приводящий к гликолипидам. Жирные кислоты включаются также в обмен сфинганиновых соединений, приводящий к образованию церамида и сфингозина. В обмен стероидов жирные кислоты вступают на последних стадиях, когда становится возможным образование эфиров холестерина и его аналогов.
Жирнокислотный состав мембранных липидов животных, в отличие от бактериальных и растительных организмов, не так своеобразен, но более вариабелен. Разные липиды обладают различным жирнокислотным составом (табл. 4). Специфика этого состава сохраняется при условии неизменности среды обитания, преимущественного характера питания и т.д.
Таблица 4. Жирнокислотный состав фосфолипидов эритроцитов человека
Поскольку все фосфолипиды являются продуктами обмена фосфатидной кислоты, можно заключить, что именно жирнокислотный состав ее молекул будет определять, какой вид фосфолипида образуется из этого предшественника в данных условиях. Но изменение состава диеты, особенно ее липидной части, быстро приводит к изменению липидного состава мембранных структур. Смена условий среды обитания, например, при переходе к зимней спячке у животных, при изменении солености у проходных рыб (смолтификация) и т. д., также изменяют жирнокислотный состав мембранных липидов, приспосабливая свойства мембран к условиям среды и новым потребностям организма.
Гипотеза адаптационной роли мембранных липидов была выдвинута и обоснована Е.М. Крепсом. Согласно этой гипотезе при сравнении мембран мозга рыб разных сред обитания наиболее резкие различия в жирнокислотном составе обнаруживают ганглиозиды (гликолипиды). В этой же фракции наиболее быстро обнаруживаются изменения в наборе жирных кислот при смене температур и глубины обитания, а именно: понижение температуры и увеличение глубины синергично повышают содержание полиненасыщенных жирных кислот в составе ганглиозидов. Цереброзиды и сульфатиды (другие гликолипиды) адаптационной изменчивости не проявляют.
Чем определяется гидрофобность и гидрофильность липидов входящих в состав клеточных мембран
6.2. Липидные компоненты
Рис. 111. Липидные молекулы содержат различные полярные ‘головки’ и длинные углеводородные остатки
Рис. 112. Строение некоторых важных мембранных липидов
Рис. 113. Строение некоторых важных мембранных липидов
Некоторые липидные молекулы в мембранах можно заменить на другие или даже извлечь из мембран путем инкубации мембранных препаратов с водными суспензиями различных липидсодержащих агрегатов. Ряд липидов, в частности холестерин и слабополярные фосфолипиды, удается экстрагировать из мембраны органическими растворителями (скажем, эфиром или ацетоном), которые при низких температурах не вызывают существенных нарушений мембранной структуры. Однако большая часть полярных фосфолипидов экстрагируется из мембраны лишь с помощью системы растворителей, повреждающих молекулярную организацию мембраны (такова, например, смесь хлороформа и метанола). Возможность экстракции данного липида из мембраны зависит не только от локализации в мембранной структуре и сил, удерживающих липид в мембране, но и от сродства этого липида к соответствующему растворителю.
Липидный анализ многочисленных мембранных препаратов выявил поразительное сходство липидного состава однотипных мембран различных клеток. Значительная часть (от 35 до 75%) фосфолипидных молекул (ФХ, СМ и ЛФХ) клеточных мембран содержит цвиттерионную фосфорилхолиновую головку. В мембранах эритроцитов различных животных общее содержание ФХ и СМ остается сравнительно постоянным, а доля отдельных фосфолипидов варьирует в широких пределах. Мембраны животных клеток характеризуются относительно постоянным содержанием (от 15 до 25%) фосфолипидов, несущих большой отрицательный заряд (ФС, ФИ, ДФГ). Существенный вклад в суммарный отрицательный заряд мембраны при физиологических значениях pH вносит также ФЭ.
* ( В некоторых опухолевых клетках наблюдается «выравнивание» липидного состава мембран различного типа. В таких клетках митохондрии могут содержать значительные количества СМ, а в мембранах эндоплазматической сети присутствует ДФГ. Это явление получило название «липидной дедифференцировки».- Прим. ред.)
Углеводородные остатки липидных молекул в мембранах животных клеток представляют собой неразветвленные цепи с четным числом атомов углерода, чаще всего от 14 до 24. Двойные связи в таких цепях (от 0 до 6 на цепь) имеют цис-конфигурацию. Мембраны некоторых цитоплазматических органелл отличаются более высоким содержанием ненасыщенных углеводородных цепей по сравнению с плазматической мембраной той же клетки. Это, по-видимому, отражает различия в фосфолипидном и гликолипидном составе между соответствующими мембранами. Получены данные о влиянии пищевого рациона на содержание и характер жирных кислот в составе мембранных липидов. Благодаря более высокому содержанию холестерина и одновременно низкому уровню ненасыщенных жирных кислот липидная фаза плазматической мембраны отличается большей упорядоченностью (жесткостью) по сравнению с липидами цитоплазматических органелл (рис. 115).
Рис. 115. Структура насыщенных (А) и ненасыщенных (Б) жирных кислот
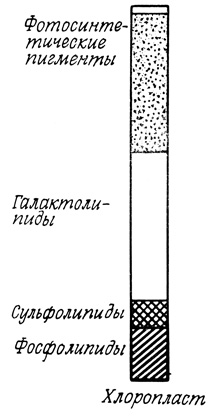
В растительных клетках мембраны внутриклеточных органелл весьма сходны по липидному составу с соответствующими органеллами животных клеток. Хлоропласты же близки по липидному составу к сине-зеленым водорослям и, подобно последним, содержат моно- и дигалактозилдиглицериды, сульфогликозилдиглицериды и фосфатидилглицерин. Такое сходство может служить свидетельством в пользу гипотезы о происхождении хлоропластов из сине-зеленых водорослей. В состав мембраны хлоропласта входят также другие липиды (ФХ, ФЭ и ФИ), характерные для эукариотических клеток. Источником этих липидов служат, по-видимому, процессы липидного метаболизма, протекающие в других областях клетки (рис. 116).
Рис. 116. Липиды, содержащиеся в мембранах растительных клеток
У дрожжей мембрана протопласта содержит около 40% липидов, которые представлены в основном нейтральными липидами и лишь 15-25% приходится на фосфолипиды. Главными компонентами последних являются ФЭ (33%) и ФХ (23%). Фосфолипиды с большим отрицательным зарядом (ФС, ФИ и ФА) составляют вместе почти 40%.
Липидный состав бактериальных мембран варьирует не только от штамма к штамму, но и в пределах одного штамма в зависимости от условий культивирования и фазы роста. Выделенные из бактериальных клеток мембранные фракции, содержащие плазматическую мембрану, мембраны лизосом, а иногда элементы клеточной стенки, содержат от 10 до 30% липидов. Более высокое содержание липидов было обнаружено в мембранах бактерий, лишенных клеточной стенки (L-формы), а также в мембранах Mycoplasma и Acholeplasma.
Фосфолипиды мембран грамположительных бактерий представлены в основном фосфатидилглицерином (ФГ) и ДФГ, а также аминоацильными производными ФГ. У грамотрицательных микроорганизмов в составе фосфолипидов мембран преобладает ФЭ. L-формы существенно отличаются по липидному составу от родительских клеток, причем этот состав у них в большей мере зависит от питательной среды. Например, холестерин среды включается в мембраны L-форм, даже если он полностью отсутствовал в родительской клетке. В обычных условиях холестерин является фактором роста для Mycoplasma, тогда как родственный последнему Acholeplasma, хотя и способен эффективно поглощать холестерин из среды, растет и в отсутствие этого соединения. Следует, правда, отметить, что при росте без холестерина клетки Acholeplasma имеют более хрупкие мембраны. Определенные штаммы Mycoplasma и Acholeplasma, а также некоторых бактерий могут включать жирные кислоты из культуральной среды в состав своих липидных молекул. Это позволяет произвольно изменять в эксперименте липидный состав исследуемых мембран. Было показано, что разветвленные углеводородные цепи, а также цепи с кольцевыми структурами вызывают дезорганизацию бактериальных липидов подобно тому, что происходит в липидах эукариотов под влиянием ненасыщенных двойных связей. В мембранах галофильных бактерий липиды представлены почти исключительно глицеролипидами, которые в качестве заместителей в положениях 2 и 3 (вместо обычных 1 и 2) содержат углеводородные цепи фитина, связанные с остатком глицерина простыми эфирными связями.
Чем определяется гидрофобность и гидрофильность липидов входящих в состав клеточных мембран
Все без исключения клеточные мембраны построены по общему принципу: это тонкие липопротеидные пленки, состоящие из двойного слоя липидных молекул, в который включены молекулы белка. В весовом отношении в зависимости от типа мембран на долю липидов приходится 25-60%, на долю белков — 40-75%. В состав многих мембран входят углеводы, количество которых может достигать 2-10%.
К липидам относится большая группа органических веществ, обладающих плохой растворимостью в воде (гидрофобность) и хорошей растворимостью в органических растворителях (липофильность). Состав липидов, входящих в мембраны клетки, очень разнообразен (рис. 116). Характерными представителями липидов, встречающихся в клеточных мембранах, являются фосфолипиды (глицерофосфатиды), сфингомиелины и из стероидных липидов — холестерин.
Рис. 116. Структурные формулы некоторых важнейших липидов
Глицерофосфатиды, или глицеролипиды, представляют собой сложные эфиры трехатомного спирта глицерина с двумя жирными кислотами и с фосфорной кислотой, которая в свою очередь может быть связана с различными химическими группами (холин, серии, инозит, этаноламин и др.). Например, в структуру наиболее часто встречающегося в мембранах глицеролипида лецитина входят участки двух жирных кислот, глицерина, фосфорной кислоты и холина. Другая группа мембранных липидов называется сфингомиелиновой, в ней глицерин замещен аминоспиртом сфингозином.
Из липидов, относящихся к стероидам, в мембранах больше всего холестерина. В растительных клетках холестерин не обнаружен, его там заменяют фитостерины. У бактерий стерины отсутствуют.
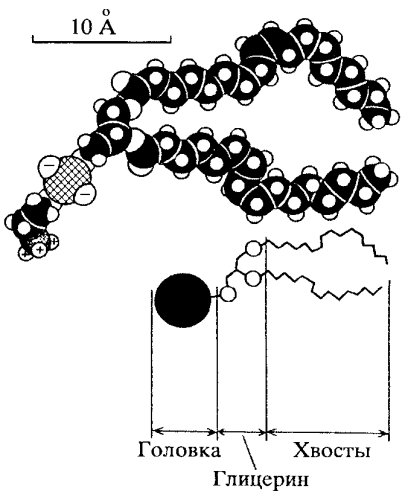
Характерной особенностью липидов мембран является разделение их молекулы на две функционально различные части: неполярные (не несущие зарядов) хвосты, состоящие из жирных кислот, и заряженные полярные головки (рис. 117). Полярные головки несут на себе отрицательные заряды или могут быть нейтральными (в случае, если они имеют одновременно положительные и отрицательные заряды). Наличие неполярных хвостов липидов объясняет их хорошую растворимость в жирах и органических растворителях.
Рис. 117. Схема строения молекул фосфолипидов
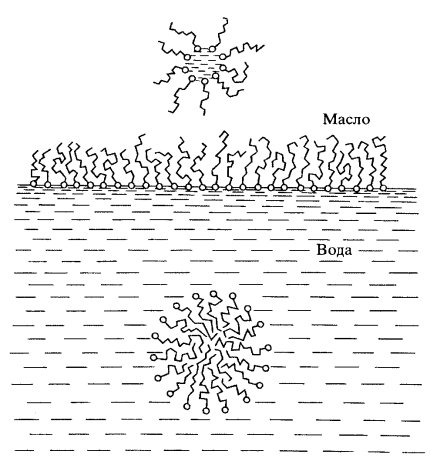
Если полярные липиды смешать с водой, то образуется эмульсия, состоящая из мицелл. При этом незаряженные (гидрофобные) хвосты будут стремиться образовывать однородную фазу в центре мицеллы, а заряженные (гидрофильные) головки будут торчать в водную фазу. Холестерин сам по себе мицелл не образует, но легко включается в мицеллы полярных липидов, в результате чего образуются мицеллы смешанного типа. Если к липидам добавить масло, то образуются мицеллы, как бы вывернутые наизнанку: их гидрофобные хвосты будут обращены в масляную фазу, а заряженные (гидрофильные) головки будут располагаться внутри мицеллы (рис. 118).
Рис. 118. Мономолекулярный слой липидов на поверхности раздела фаз вода—масло и мицеллы липидов в масле и воде
На поверхности воды растворы полярных липидов, растекаясь, образуют мономолекулярную пленку, в которой в водную фазу будут направлены заряженные (гидрофильные) головки, а неполярные хвосты будут обращены в сравнительно гидрофобную воздушную фазу. Смешивая с водой экстрагированные из мембран липиды или беря смеси разных липидов, можно получить бимолекулярные слои или мембраны толщиной около 7,5 нм, где периферические зоны слоя, смотрящие в водную фазу, будут содержать исключительно полярные головки, а незаряженные хвосты будут образовывать общую гидрофобную центральную зону такой образовавшейся мембраны (рис. 119).
Рис. 119. Сплошной билипидный слой, образующийся в воде при высокой концентрации липидов
Эта способность липидов самопроизвольно образовывать мембранные структуры определяется свойствами самих липидов, а именно наличием в их структуре полярных головок и неполярных хвостов.
В таких искусственных системах липидные мицеллы и мембраны могут взаимодействовать с белками своими полярными зонами или гидрофобными хвостами, при этом образуются искусственные липопротеидные мембраны, сходные с теми мембранами, которые можно выделить из клеток. Они имеют толщину около 7,5 нм. При окраске четырехокисью осмия в электронном микроскопе видна трехслойная структура искусственных мембран: два темных периферических слоя толщиной 2,5 нм и светлый, центральный, примерно такой же толщины. Естественные клеточные мембраны имеют такое же строение.
Необходимо подчеркнуть, что как искусственные, так и естественные мембраны не представляют собой плоские слои, они всегда замкнуты сами на себя, образуя полые вакуоли, пузырьки, везикулы, плоские замкнутые мешки или трубчатые образования.
Представление о том, что в основе клеточных мембран лежит двойной липидный слой, было сформулировано еще в 1920-х годах. Если экстрагировать липиды из оболочки эритроцитов, а затем поместить липиды на поверхность водного мениска, то можно рассчитать площадь, занимаемую образовавшимся монослоем липидов. Оказалось, что эта площадь вдвое больше площади, занимаемой поверхностью эритроцитов, из которых были экстрагированы липиды. Было сделано предположение, что в мембранах эритроцитов липиды располагаются в два слоя. К тому же оказалось, что поверхностное натяжение мембраны клетки (1-2 дин/см 2 ) значительно ниже, чем поверхностное натяжение искусственного липидного слоя (7—15 дин/см 2 ). Обнаружено, что при добавлении белка к липидам поверхностное натяжение снижается до величины, характерной для поверхностного натяжения клеток.
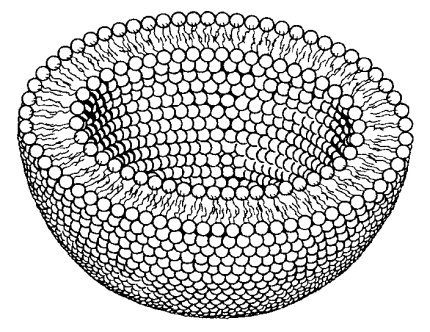
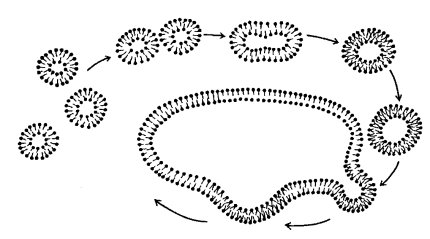
Образовавшиеся искусственные липидные мембраны служат непроницаемым барьером для любых заряженных молекул, даже для ионов солей. Это определяет основное функциональное свойство мембран — служить преградой для свободной диффузии через слой липидов. Такое свойство может быть использовано для практических целей. Например, при смешивании липидов в водной среде образуется масса полых мембранных пузырьков — липосом (рис. 120). Жидкость, попавшая внутрь этих пузырьков, уже не может свободно обмениваться с жидкостью, находящейся снаружи. Таким способом искусственные мембраны липосом можно «загрузить» лекарственными веществами, которые могут в нужных концентрациях поступать к клеткам.
Рис. 120. Липосома: замкнутый билипидный слой в виде вакуоли
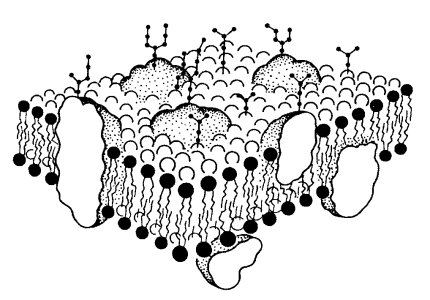
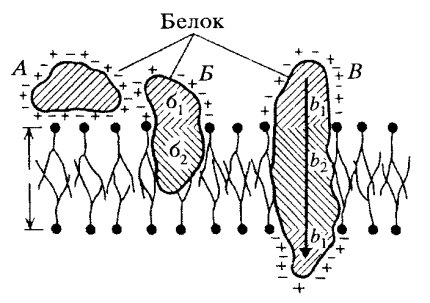
Большая часть белков взаимодействует с липидами в составе мембран на основе гидрофобных сиязей. Оказалось, что многие мембранные белки состоят как бы из двух частей: из участков, богатых полярными (несущими заряд) аминокислотами, и участков, обогащенных неполярными аминокислотами (глицином, аланином, валином, лейцином). Эти белки в липидных слоях мембран располагаются так, что их неполярные участки как бы погружены в «жирную» часть мембраны, где находятся гидрофобные участки липидов (рис. 121). Полярная (гидрофильная) часть таких белков взаимодействует с головками липидов и обращена в сторону водной фазы (рис. 122), поэтому эти белки, связанные с липидами путем гидрофобных взаимодействий, практически не экстрагируются в водных фазах. Их можно выделить, лишь разрушая мембрану, экстрагируя из нее липиды или органическими растворителями, или детергентами. Поэтому эти белки мембран и называют интегральными.
Рис. 122. Взаимодействие белков с липидными слоями
А — ионные связи; Б, В — гилрофилыю-гидрофобные взаимодействия белков с билипидным слоем
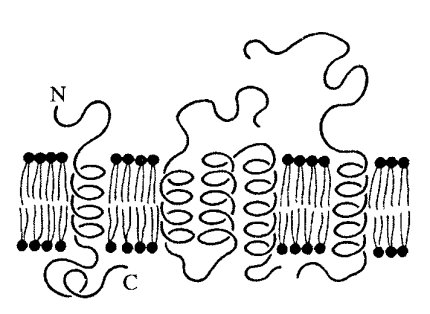
Размер интегральных мембранных белков в среднем равен 8 нм, но встречаются крупные белки — до 35 нм величиной (белок тилакоидов хлоропластов). Обычно это очень асимметричные по своей природе белки и соответственно асимметрично локализованы в мембране (рис. 123): их разные функциональные части локализованы по обе стороны мембраны, и все белки данного типа расположены одинаково. С цитоплазматической стороны мембраны интегральные белки связаны с периферическими белками.
Рис. 123. Асимметричное расположение молекул белков в мембранах, определяемое расположением С- и N-концевых и α-спиральных участков полипептидных цепей
Латеральная подвижность липидов и белков мембран
Рис. 124. Перемещение вдоль плазматической мембраны связанных лектинов
а — первичная посадка; б — объединение в мелкие сгустки; в — образование «колпачков»
Латеральную подвижность белковых (гликопротеидных) молекул плазматической мембраны можно наблюдать при изучении клеточных гибридов, имеющих разные поверхностные антигены, которые можно пометить. В этом случае в гибридной клетке антигены поверхностей сначала были разобщены, а через некоторое время они равномерно распределились по всей поверхности гетерокариона.
Асимметричность клеточных мембран
Состав липидов по обе стороны мембраны различен, что определяет асимметричность в строении билипидного слоя. Так, с помощью химического маркирования было найдено, что 80% сфингомиелина, 75% фосфатидилхолина и 20% фосфатидилэтаноламина локализованы на наружной поверхности плазматической мембраны, на внутренней — располагается весь фосфатидилсерин и 80% фосфатидилэтаноламина. Примерно такую же композицию имеют мембраны эндоплазматического ретикулума (для них наружной надо считать ту поверхность, которая обращена внутрь полости).
Особенно выражена асимметрия мембран в отношении интегральных белков. В составе естественных мембран белки строго ориентированы. Большей частью их N-концы смотрят в полость вакуолей или в случае плазматической мембраны — во внешнюю для клетки среду. Такое полярное расположение цепи белковой молекулы в липидном бислое создается в процессе синтеза мембранного белка на рибосоме. Полуинтегральные и примембранные белки также асимметрично расположены в мембранах. Так, в эндоплазматическом ретикулуме белки- ферменты, синтезирующие липиды, расположены на цитозольной стороне мембран, а ферменты, пришивающие сахара к белковым цепочкам (гликозидазы), локализованы на внешней стороне мембраны.
Наличие углеводного компонента характерно практически для всех мембран клетки, но особенно для мембран вакуолярной системы и плазматической мембраны. Углеводный компонент мембран представлен главным образом гликопротеинами — молекулами белков, ковалентно (в отличие от нуклеопротеидов) связанных с цепочками углеводов. Как правило, цепочки углеводов расположены в наружных слоях мембран (для цитоплазматических вакуолей наружными считают слои, обращенные не к матриксу цитоплазмы, а в полость везикул или вакуолей). Они имеют ковалентные связи с интегральными белками, образуя гликопротеиды, или с липидами (гликолипиды). Углеводы мембран представляют собой короткие линейные или разветвленные цепочки, в состав которых входят галактоза, манноза, фруктоза, сахароза, N-ацетилглюкозамин, N-ацетилгалактозамин, пентозы (арабиноза и ксилоза), а также нейраминовая (сиаловая) кислота. Значение этого компонента очень велико для функционирования плазматической мембраны.
Различные свойства разных мембран
Несмотря на поразительную схожесть строения различных мембран, построенных по принципу липидного бислоя с вмонтированными в него белками, физические и химические свойства разных мембран различны. Это связано с тем, что в разных мембранах общий состав липидов значительно различается, что определяет особые свойства мембран.
Разные мембраны клетки могут отличаться друг от друга по количеству липидов. Так, плазматическая мембрана содержит 35-40%, а мембраны митохондрий — 27-29% липидов. Самое высокое содержание липидов в плазматической мембране шванновских клеток, образующих миелиновую оболочку нервов, — до 80%.
Обнаружено, что клеточные мембраны сильно отличаются друг от друга по составу липидов. Так, плазматические мембраны клеток животных богаты холестерином (до 30%) и в них мало лецитина, в то вре мя как мембраны митохондрий, наоборот, богаты фосфолипидами и бедны холестерином. Из общего количества липидов содержание фосфатидилхолина (лецитина) во фракциях эндоплазматической сети составляет 60—70% от всех фосфолипидов, в то время как в плазматической мембране его может быть 25-35%.
В целом для плазматической мембраны характерно высокое содержание холестерина и сфинголипидов, а также преобладание насыщенных и мононенасыщенных жирных кислот в составе фосфолипидов, тогда как в митохондриях, эндоплазматической сети и во многих других цитоплазматических мембранах содержится мало холестерина и сфинголипидов и сравнительно много полиненасыщенных жирных кислот. Видимо, в связи с этим мембраны цитоплазмы менее жесткие, чем плазматическая мембрана, они более «легкоплавки».
Особенно отличаются мембраны по составу белков, которые главным образом определяют функциональные свойства мембран.
По биологической роли мембранные белки можно разделить на три группы: ферменты, рецепторные белки и структурные белки. Набор ферментов в составе мембран может быть очень велик и разнообразен (например, в плазматической мембране клеток печени обнаружено не менее 24 различных ферментов). В разных мембранах существует характерный набор ферментов. Например, в плазматической мембране, как и во многих других, локализуется (К + /Na + )-зависимая АТФаза, участвующая в транспорте ионов. В митохондриях специфическими являются набор белков-переносчиков электронов и фермент АТФ-синтетаза, обеспечивающие окислительное фосфорилирование и синтез АТФ.
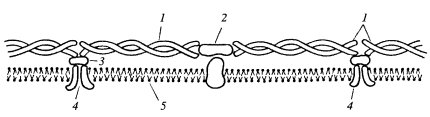
Связь мембран с цитоплазматическими белками
Рис. 125. Примембранные белки эритроцитов
1 — спектрин; 2 — актин; 3 — анкирин; 4 — белок III полосы; 5 — плазмалемма
Рост многих мембран за счет встраивания вакуолей
После деления клеток происходит увеличение объемов растущих дочерних клеток и тем самым рост клеточной поверхности, увеличение площади плазматической мембраны. Но это не единственный пример быстрого роста объема и поверхности. Поверхность быстро растущих клеток в тычиночных нитях злаков может за 1 ч увеличиться в 65 раз, т.е. каждую минуту плазмалемма нарастает на ее первоначальную величину. Такую большую скорость роста плазматической мембраны можно объяснить только тем, что происходит быстрое встраивание (интеркаляция) пузырьков в растущую плазматическую мембрану. Здесь внутриклеточные мембранные пузырьки подходят к внутренней стороне плазматической мембраны (возможно, их подгоняют к себе микрофиламенты кортикального слоя), происходит слияние мембран и тем самым увеличение поверхности плазматической мембраны (рис. 126).
Рис. 126. Слияние клеточных мембран с мембранными вакуолями
Откуда же берутся эти готовые блоки, мембранные пузырьки? Удалось проследить, что первичный генезис мембран происходит в гранулярном эндоплазматическом ретикулуме, который является источником всех клеточных мембран, кроме мембран митохондрий и пластид. От мембран гранулярного ЭПР отщепляются мелкие вакуоли, которые сливаются с мембранами аппарата Гольджи, от которого в свою очередь отщепляются мелкие мембранные вакуоли, сливающиеся или с лизосомами, или с плазматической мембраной, или с секреторными вакуолями.
Таким образом, наблюдается последовательный каскад переходов одних мембран в другие. Первичные же мембранные вакуоли строятся за счет синтеза белка и липидов на мембранах гранулярного ЭПР.
Рост мембран митохондрий и пластид иного характера. Увеличение площади мембран митохондрий происходит за счет синтеза основной массы белков и липидов в гиалоплазме клетки, вслед за чем эти митохондриальные белки и липиды транспортируются через мембранную оболочку митохондрий и встраиваются в их компоненты.
Величко В.В. © Copyright 2008.