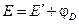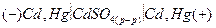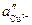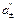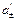Чем определяется эдс концентрационного элемента
Гальванические элементы: химические, концентрационные. Расчет ЭДС.
Типы гальванических элементов:
Zn / Zn 2+ // Cu 2+ / Cu.
При работе этого элемента протекают реакции:
При схематическом изображении гальванических элементов слева записывают анод, справа – катод. Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
ЭДС элемента Даниэля – Якоби рассчитывается с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:


Концентрационный гальванический элемент состоит из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией.
ЭДС концентрационного гальванического элемента равна:

Электроды сравнения (водородный, хлорсеребряный, каломельный).
Электрода сравнения – это электрод с устойчивым потенциалом. К электродам сравнения относятся стандартный водородный, каломельный и хлорсеребряный электроды.
Стандартный водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю.
Схематически электрод изображают следующим образом:
Рt, Н2 / Н+
На электроде идет реакция:
Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Хлорсеребряный электрод, представляет собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия.
Аg / АgСl, КСl
Индикаторные электроды (водородный, хингидронный, стеклянный).
Индикаторные электроды это электроды, потенциал которых зависит от активности ионов водорода в растворе, т. е. от pH раствора:
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода.
На электроде идет реакция:
Схематически электрод изображают следующим образом: Рt, Н2 / Н+
Потенциал водородного электрода зависит от активности ионов Н + в растворе;
Схематически электрод изображают следующим образом: Рt/С6Н4О2,С6Н4(ОН)2,Н+
Потенциал хингидронного электрода равен
Стеклянный электрод, относится к ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов/
Дата добавления: 2018-05-02 ; просмотров: 1532 ; Мы поможем в написании вашей работы!
Концентрационный гальванический элемент его устройство химизм работы и расчет его эдс
В качестве примера концентрационного элемента можно привести концентрационный свинцовый гальванический элемент. Электроды этого элемента сделаны из свинца, при этом один из электродов которого погружен в раствор соли свинца с концентрацией Pb 2+ равной 0,1 моль/л, а другой — в раствор с концентрацией Pb 2+ равной 0,01 моль/л.
Схема данного элемента: 
В данном элементе происходят электродные процессы:
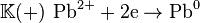

Работа гальванического элемента основана на разнице в активности металлов катодной и анодной пластин. Иными словами, на различной энергии выхода иона металла в раствор из пластины, погруженной в раствор. Вместо энергии выхода иона, обычно пользуются понятием электродный потенциал металла, который тесно связан с электроотрецательностью, радиусом иона и валентностью металлов. Существует специальный ряд стандартных электродных потенциалов, сокращенный вариант которой представлен на рисунке 1.
В этом ряду активность металлов увеличивается с право на лево, то есть, чем левее находится металл в этом ряду, тем легче его ионы покидают металлическую поверхность, переходя в раствор («соблазнившись” на отрицательный заряд на диполях воды). К примеру, металлы с лития по натрий, при погружении в воду, энергично насыщают ее катионами, превращая в раствор щелочи. Получившийся раствор при этом вскипает от нагрева и пузырьков водорода. Металлы правее меди могут лежать хоть на дне океана многие века, практически не растворяясь.
Этот ряд также полезен тем, что при взаимодействии кислород содержащих кислот и металла, продукты реакции зависят от положения металла в этом ряду. Металлы левее марганца при реакции с кислотой, дают соль и газообразный водород. Металлы правее водорода, дают соль, воду и оксид неметалла в степени близкой к высшей (для азотной, например, NO2). Металлы средней части при реакции дают соль, воду и низший оксид неметалла (для азотной, NO).
37. Практическое применение химических источников тока: сухие гальванические элементы, электрохимические аккумуляторы, топливные элементы.
На основе электрохимических систем осуществляются многие технологические процессы и процессы преобразования энергии (химические источники тока – ХИТ). Достоинства ХИТ – высокий КПД, бесшумность, безвредность, возможность использования под водой, в космосе, в переносных устройствах. К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы.
Большое распространение получили гальванические элементы (однократного действия).
«Классическим» ХИТ является сухой марганцово-цинковый элемент. Исп-ся для питания радиоаппаратуры, карманных фонарей и т.п.
Дата добавления: 2015-01-19 ; просмотров: 53 ; Нарушение авторских прав
Расчет ЭДС и составление схемы концентрационного гальванического элемента
1. Определим концентрацию ионов серебра в насыщенном растворе AgCl
Уравнение диссоциаци AgCl:
2. Определим концентрацию ионов серебра в насыщенном растворе Na[Ag(CN)2]
Уравнение диссоциаци [Ag(CN)2]:
Схема электродных процессов:
Катод (-): Ag + + 1 
Анод (+): Ag 0 + 1 
Для расчета ЭДС и составления схемы элемента необходимо рассчитать потенциалы катода и анода по уравнению Нернста:
E = E 0 Me + (R • T/n • F) • ln[Men + ] = E 0 Me + (0,059 /n) • lg[Men + ], где
E 0 Me – стандартный потенциал металла, В;
R – универсальная газовая постоянная, Дж/моль•К;
T – температура, К;
n – число электронов, принимающих участие в электродной реакции
F – число Фарадея, Кл/моль;
[Men + ] – концентрация катионов металла, моль/л.
Определим потенциалы электродов:
Электрод с меньшим равновесным потенциалом – анод, с большим равновесным потенциалом – катод.
ЭДС = Екатода – Еанода = +0,511 – (+0,375) = +0,136 В.
Ответ: ЭДС = +2 В.
Поскольку электрод в растворе с минимальной (максимальной) концентрацией является анодом (катодом), расчет ЭДС можно реализовать через следующую формулу:
E = (R • T/n • F) • ln[Men + max/Men + min] = (0,059/n) • lg[Men + max / Men + min]
Е = (0,059/1) • lg(1,334 · 10-5)/(6,503 · 10-8) = +0,136 В.
Схема альванического элемента:
Men + + n • e = Me;
Me = Men + + n • e, где n – валентность металла.
В данном случае:
на катоде Ni 2+ + 2 
на аноде Ni 0 = Zn 2+ + 2
Для расчета ЭДС и составления схемы элемента необходимо рассчитать потенциалы катода и анода по уравнению Нернста:
E = E 0 Me + [(R • T)/(n • F)] • ln[Men + ] = E 0 Me + (0,059/n) • lg[Men + ], где
E 0 Me – стандартный потенциал металла, В;
R – универсальная газовая постоянная, Дж/моль•К;
T – температура, К;
n – число электронов, принимающих участие в электродной реакции
F – число Фарадея, Кл/моль
[Men + ] – концентрация катионов металла, моль/л.
Определим полярность электродов:
Электрод с меньшим равновесным потенциалом – анод, с большим равновесным потенциалом – катод.
Поскольку электрод в растворе с минимальной (максимальной) концентрацией является анодом (катодом), расчет ЭДС можно реализовать через следующую формулу:
ЭДС = [(R • T)/(n • F)] • ln[Men + max/Men + min] = (0,059/n) • lg[Men + max/Men + min].
ЭДС = [(8,31 • 298)/(2 • 96500)] • ln[0,3]/[0,1] = 0,014 B.
Схема альванического элемента:
анод (-) Ni|Ni 2+ (0,1 М)||Ni 2+ (0,3 М)|Ni (+) катод
Чем определяется эдс концентрационного элемента
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
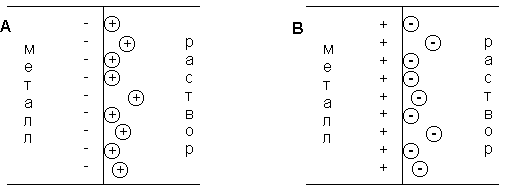
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
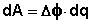
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
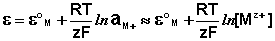
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
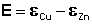
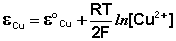
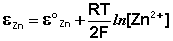
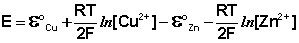
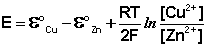
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
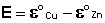
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
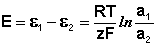
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Концентрационные цепи



Гальванические элементы второго типа – концентрационные цепи представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны. Электрическая энергия в концентрационных элементах вырабатывается за счет выравнивания концентраций веществ.
Различают концентрационные цепи без переноса и с переносом. Концентрационными цепями без переноса называются элементы:
а) с одинаковыми электродами, но с разными концентрациями электролитов при отсутствии непосредственного соприкосновения между растворами;
б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации, опущенными в один раствор электролита;
в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа (с одним раствором электролита).
Примером концентрационной цепи без переноса может служить амальгамная концентрационная цепь:
где a1 и a2 – активности кадмия в амальгаме.
На электродах этого концентрационного элемента протекают следующие электрохимические реакции:
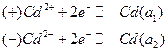
ЭДС этого элемента вырабатывается за счет выравнивания активности кадмия в амальгамах ( 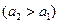
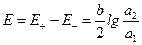
Концентрационными цепями с переносом называются такие концентрационные элементы, в которых имеется непосредственная граница соприкосновения между растворами. На границе между растворами двух одинаковых электролитов разной концентрации, в результате разной подвижности катионов и анионов, возникает так называемый диффузионный потенциал
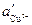
где 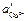
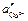
Запишем потенциалы обоих электродов:
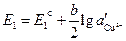
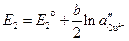
Тогда ЭДС элемента будет
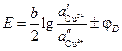
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС. Существует несколько соотношений для расчета ЭДС гальванического элемента с учетом диффузионного потенциала.
1. Если электроды обратимы относительно катиона, то ЭДС гальванического элемента будет равна:
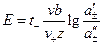
где t– –число переноса анионов, n – общее число формульных частиц, составляющих данный электролит (общее число ионов, на которые распадается электролит ), n+ — число формульных частиц катионов(число катионов, на которые диссоциирует электролит), составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению:
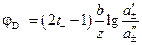
Примером концентрационного гальванического элемента обратимого относительно катиона будет, например, элемент:
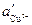
2. Если электроды обратимы относительно аниона, то ЭДС гальванического элемента будет равна:
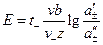
где t+ – число переноса катионов, n– – число формульных частиц анионов, составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению:
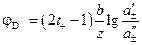
Примером концентрационного гальванического элемента обратимого относительно аниона будет, например, элемент:
Ag | AgCl | HCl(aq) | NaCl(aq) | AgCl | Ag
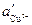
3. Так как причиной возникновения диффузионного потенциала является различная подвижность ионов, то он возникает даже на границе двух различных растворов одинаковой концентрации. В этом случае для различных бинарных электролитов 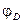
jD = 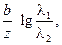
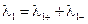
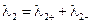
где 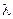
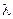
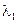
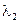
Диффузионный потенциал может быть величиной как положительной, так и отрицательной:
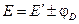
где 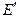
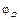
Выбор знака “+” или “–” перед диффузионным потенциалом зависит от взаимного направления электрических полей между электродами элемента и на границе двух растворов. Если направления обоих электрических полей совпадают (см. пример), то диффузионный потенциал (абсолютная величина) прибавляется к 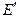
(–) Ag|AgNO3(aq)–½+AgNO3 (aq)| Ag (+) (