Чем определяется дентатность лиганда
Чем определяется дентатность лиганда
Основы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах.
Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 
В комплексных ионах комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH 4 ] + и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO) 4 ] и [Fe(CO) 5 ], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
так и находясь в составе молекулы:
P H 3 + H + 
B F 3 + NH 3 
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
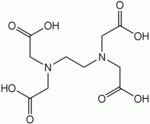
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число ( КЧ ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6:
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах и
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9 [Bi(NCS) 12 ].
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками:
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, либо отрицательный, например, или нулевой заряд, например, как для
При растворении в воде комплексные соединения необратимо диссоциируют на ионы:
Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу :
в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды.
Примером комплекса смешанного типа может служить карбонильный комплекс кобальта состава [Co 2 (CO) 8 ], имеющий следующее строение:
Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
Классификация лигандов по дентантности
(1) монодентантные лиганды:
(2) бидентантные лиганды:
(3) полидентантные лиганды. Важнейшими из них являются комплексоны– аминополикарбоновые кислоты и их соли. К широко используемым комплексонам относится этилендиаминтетрауксусная кислота (ЭДТА),
а также ее динатриевая соль(Na2H2Y),известная как Трилон Б:
Комплексоны находят применение в медицине для лечения мочекаменной болезни. Они способны растворять камни, образующиеся в почках и мочевом пузыре. Процесс растворения оксалатного камня описывается уравнением:
Комплексоны широко используются в аналитической химии. Например, метод комплексонометрии является одним из методов объемного анализа, в основе которого лежит реакция комплексообразования:
Me 2+ + Na2H2Y 
Классификация комплексных соединений
1) по природе лигандов
а) Комплексы с монодентантными лигандами:
б) Комплексы с би- и полидентантными лигадами. Особую группу составляют хелатные (клешневидные) комплексы, содержащие полидентантные лиганды, образующие замкнутые циклы.
Например, комплекс меди с этилендиамином:
Тетацин применяется в медицине как лекарственный препарат для детоксификации организма при отравлении тяжелыми металлами. Приведенное ниже уравнение описывает связывание токсичных катионов ртути в прочный комплекс, легко выводящийся из организма с мочой:
Hg 2+ + [CaY] 2 ‾ ® Ca 2+ + [HgY] 2 ‾.
2) По скорости образования комплексов:
(а) лабильные, образующиеся с высокой скоростью;
(б) инертные, образующиеся с низкой скоростью.
Номенклатура комплексных соединений
1) Вначале называют катионы, а затем анионы. Названия комплексных анионов заканчиваются суффиксом –ат.
Названия лигандов-анионов заканчиваются на – о:
OH‾ ― гидроксо NO2‾ ― нитро
NO3‾ ― нитрато CN‾ ― циано
СNS‾ ― родано SO4 2 ‾ ― сульфато
Катион-лиганд NH2NH3 + имеет название гидразиниум.
Названия некоторых комплексообразователей зависит от того, в состав катиона или аниона они входят (таблица 13).
Таблица 13 ― Название некоторых комплексообразователей
| Металл | Название комплексообразователя | |
| В комплексном катионе | В комплексном анионе | |
| Fe Hg Au Ag Cu Sn Pb | Железо Ртуть Золото Серебро Медь Олово Свинец | Феррат Меркурат Аурат Аргентат Купрат Станат Плюмбат |
3) Степень окисления комплексообразователя указывают, если у металла их несколько.
Ниже приведены названия некоторых комплексных соединений:
Na[Al(OH)4] ―- натрий тетрагидроксоалюминат
Строение КС
Строение комплексных соединений описывается либо в рамках метода валентных связей (метод ВС), либо с позиции теории кристаллического поля.С позиций метода ВС связи металл — лиганд являются ковалентными полярными, образованными по донорно-акцепторному механизму. Лиганды выступают в роли доноров электронных пар, а комплексообразователи — в роли их акцепторов. Схема взаимодействия металлов и лигандов представлена на рисунок 54.
Рисунок 54 — Схема взаимодействия металлов и лигандов
Конфигурация комплексного иона определяется типом гибридизации атомных орбиталей комплексообразователя (таблица 14).
Таблица 14 — Конфигурация комплексных ионов.
| Координа-ционное число комплексообразо-вателя | Тип гибриди-зации | Конфигурация комплексных ионов | Примеры |
| sp |  линейная линейная | [Ag(NH3)2]+ | |
| sp3 dsp2 | тетраэдрическая  Квадратно-плоскостная Квадратно-плоскостная  | [Zn(NH3)4]2+ [AuCl4]- | |
| sp3d2 | Октаэдрическая  | [FeF6]3- [Fe(CN)6]3- |
Теория кристаллического поля исходит из того, что металлы и лиганды связаны между собой силами электростатического притяжения. Эта теория рассматривает воздействие лигандов на d-орбитали иона-комплексообразова-теля. Если катион металла находится в симметричном магнитном поле, его d-орбитали имеют одинаковый запас энергии (являются вырожденными). Если ион находится в октаэдрическом, тетраэдрическом или другом несимметричном поле лигандов, то происходит расщепление его d-подуровня(рисунки 55-56).
Рисунок 55 — Расщепление d-подуровня в октаэдрическом поле
Рисунок 56 — Расщепление d-подуровня в тетраэдрическом поле
Величина энергии расщепления (∆) зависит от конфигурации комплекса и природы лиганда.
Лиганд
Лига́нд (от лат. ligare — связывать ) — атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
Содержание
В неорганической химии
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи, где лиганды выступают в роли основания Льюиса, то есть являются донорами электронной пары. При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов
Характеристики лигандов
Электронное строение
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали — разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы.
Дентатность
Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью (от лат. dens, dent- — зуб ). Лиганды, занимающие одно координационное место, называются монодентатными (например, NH3), два — бидентатными (оксалат-анион [O-C(=O)-C(=O)-O] 2− ). Лиганды, способные занять большее количество мест, обычно обозначают как полидентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Способы координации
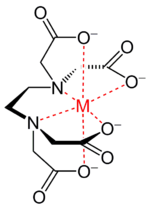
Лиганды с дентатностью больше двух способны образовывать хелатные комплексы (греч. χηλή — коготь) — комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M—O в нём могут формально являться ионными.
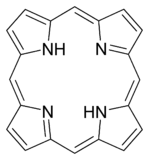
Среди хелатирующих лигандов можно выделить класс макроциклических лигандов — молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания — основы важнейших биохимических комплексов, таких, как гемоглобин, хлорофилл и бактериохлорофилл. Также в качестве макроциклических лигандов могут выступать краун-эфиры, каликсарены и др.
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ (мю).
Примечания
Полезное
Смотреть что такое «Лиганд» в других словарях:
лиганд — аддент Словарь русских синонимов. лиганд сущ., кол во синонимов: 1 • аддент (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ЛИГАНД — ЛИГАНД, ион, молекула или группа атомов, соединенные с помощью координатных химических связей с атомом или ионом металла и формирующие металлический комплекс. Так, ионы хлорида являются лигандами в ионе (СuСl4)2, а молекулы монооксида углерода… … Научно-технический энциклопедический словарь
лиганд — Небольшая молекула, связывающаяся с белковой молекулой (с рецептором) [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN ligand … Справочник технического переводчика
лиганд — – обязательная составная часть комплексных соединений; в структуре комплексов непосредственно связан с комплексообразователем, а при образовании комплексов является донором электронных пар. Словарь по аналитической химии [3] … Химические термины
лиганд — ligand лиганд. Mолекула, взаимодействующая с комплементарным участком определенной структуры, например, кислород является Л. для гемоглобина и т.п. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А.,… … Молекулярная биология и генетика. Толковый словарь.
лиганд — ligandas statusas Aprobuotas sritis augalininkystė apibrėžtis Molekulė ar jonas, kompleksiniame junginyje susijungęs koordinaciniu ryšiu su centriniu atomu (kompleksodariu). atitikmenys: angl. ligand vok. Ligande, f rus. лиганд pranc. ligand, m… … Lithuanian dictionary (lietuvių žodynas)
лиганд — ligandas statusas T sritis chemija apibrėžtis Molekulė ar jonas, kompleksiniame junginyje susijungęs koordinaciniu ryšiu su centriniu atomu. atitikmenys: angl. ligand rus. адденд; лиганд … Chemijos terminų aiškinamasis žodynas
лиганд — ligandas statusas T sritis chemija apibrėžtis Molekulė ar jonas, susijungęs su baltymo molekule. atitikmenys: angl. ligand rus. лиганд … Chemijos terminų aiškinamasis žodynas
лиганд — ligandas statusas T sritis chemija apibrėžtis Molekulė, galinti tiesiogiai sąveikauti su mišinio komponentu. atitikmenys: angl. ligand rus. лиганд … Chemijos terminų aiškinamasis žodynas
Чем определяется дентатность лиганда
Более сложные лиганды: дентатность и хелатирование
Особенно интересен и важен случай, когда при образовании комплекса координационные центры полидентатного лиганда связываются с одним металлом – образуется циклический комплекс. Такие комплексы принято называть хелатами, опять с помощью аллюзии из мира животных, но в этом случае каждый координационный центр сравнивают с клешней рака или краба, приписывая этим существам привычку хвататься за пищу сразу обеими клешнями. Ну нет у них такой привычки – отлично справляются и одной клешней, но координационным химикам если уж что приснится, то спорить бесполезно.
Самые желанные циклы вроде бы такие же, как и в органической химии – пяти и шестичленные, именно с расчетом на такие циклы проектировали большинство хелатирующих лигандов. Почему 5- или 6-членные? – вовсе не потому, что они якобы самые устойчивые, а потому, что это компромисс, золотая середина, между энергией и энтропией. Для образования меньших циклов приходится сгибать связи за пределы нормальных валентных углов, а это невыгодно (энергия), а для больших циклов быстро уменьшается вероятность образования цикла – чем длиннее цепь, связывающая центры, тем реже сближаются реакционные центры. Тем больше степеней свободы теряет лиганд при связывании в цикл, а это отрицательный вклад в энтропию, и чем больше степеней свободы потеряно, тем больший.
Но – и это очень важно – в органической химии превосходство 5 и 6-членных циклов выражено очень явно и бесспорно; уже 7-членные циклы хоть и получаются в тех же реакциях, но выходы редко превышают 20-30%, а у больших циклов и 1-2% часто считаются прекрасным результатом. С другой стороны 4-членный цикл даже ещё более ненавистен: большинство реакций, ведущих к образованию такого цикла, имеют фотохимическую природу – в возбуждённом состоянии молекулы, как и другие объекты Природы, часто ведут себя довольно странно, хватаются за что ни попадя, часто пренебрегая и напряжением, и стерикой, и обычными для себя невозбуждённых свойствами и реакционной способностью.
Но в комплексообразовании немного другие закономерности, из-за чего золотое правило циклизации – пять или шесть – оказывается не таким однозначным. Это связано и с иной стереохимией переходных металлов и наличием у них более разнообразных стереохимических конфигураций, и с гораздо большей пространственной протяжённостью d-орбиталей, что позволяет связям образовываться при гораздо больших межатомных расстояниях. Кроме того, в хелатировании комплексов переходных металлов при образовании хелатного цикла связи металл-лигандный центр образуются не одномоментно, а последовательно, и связываемая гибкая молекула лиганда теряет много степеней свободы не сразу, а понемногу на каждой стадии.
Поэтому образование больших хелатных циклов, и семи- и восьмичленных, и ещё больших гораздо более распространено. На таких хелатах строится современный дизайн катализаторов, и мы это увидим, когда доберёмся до конкретных методов. Можно даже сказать так: обычные хелаты (5 и 6-членные) обычно играют чисто вспомогательную, служебную роль (стабилизируют металл в нужной степени окисления, защищают координационную сферу от непрошенных гостей, повышают растворимость комплексов и т.п.). В то же время, у необычных хелатов чаще бывает более существенная роль, они настраивают механизм каталитической реакции, определяют селективность и реакционную способность, делают возможным то, что было без них невозможно. Увидим много таких примеров.
Бывают и малые хелатные кольца – четырёхчленные, и нередко. И у них тоже своя роль.
А вот с трёхчленными циклами проблема. Нарисовать такие легко, но при определении того, как реально связан такой лиганд с металлом возникает вопрос, два ли там лигандных центра, или один дигапто-типа (об этом ниже). Вернёмся к этой проблеме, когда разберёмся с гапто-лигандами.
Определение структурного типа комплекса, и других параметров для хелатных комплексов делают точно так же, как для обычных. 
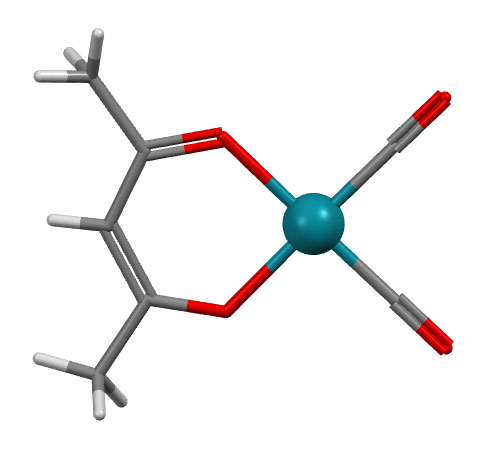
Каждый координационный центр считают отдельно, определяют типы лигандов, а дальше все как обычно. Хелатных циклов может быть несколько. Самый, наверное, знаменитый из хелатирующих лигандов – этилендиаминтетраацетат (ЭДТА, комплексон III, трилон Б) образует до пяти пятичленных хелатных циклов на одном металле, но никаких проблем в определении координационного окружения металла и всех его параметров нет.
Шестичленные хелатные циклы, например, образуют очень широко распространенные лиганды – дикетонаты. С самым распространенным дикетонатом – ацетилацетонатом (сокращается смешно: acac) знакомы все. Комплекс образуется енольной формой, один кислород поэтому связан как X-лиганд, второй как L-лиганд.
Хелатные циклы бывают и других размеров, и четырех, и семичленные (больше совсем уже редко). Четырехчленный хелатный цикл очень часто образуют ионы карбоновых кислот и карбонат-ион, но не только. Конечно, количество комплексов с четырёхчленным циклом на порядки меньше, чем 5- и 6-членных хелатов, но их нельзя считать экзотикой: четырёхчленный хелатный цикл довольно широко распространён, и легко образуется. Вполне понятно почему. На стереохимию переходных металлов нельзя просто так переносить закономерности стереохимии углерода и других неметаллов. У углерода нет стереохимических конфигураций с валентными углами близкими к 90 градусов, поэтому такой валентный угол для углерода невыгоден и ведёт к значительному угловому напряжению. Но у переходных металлов таких конфигураций очень много – это октаэдр и всё, что из него получается сокращением числа лигандов (пирамида, плоский квадрат, уголок), а значит, и никаких напряжений при образовании таких циклов нет.
Бидентатные фосфины
Шестичленный хелатор бис(дифенилфосфино)пропан dppp несколько менее популярен. На типичной структуре хорошо видно, что хелатный цикл неплоский и имеет типичную конформацию кресла (точнее, полукресла, больше похожего на форму циклогексанона, чем самого циклогексана.
Бидентатные и полидентатные лиганды не обязательно образуют хелаты
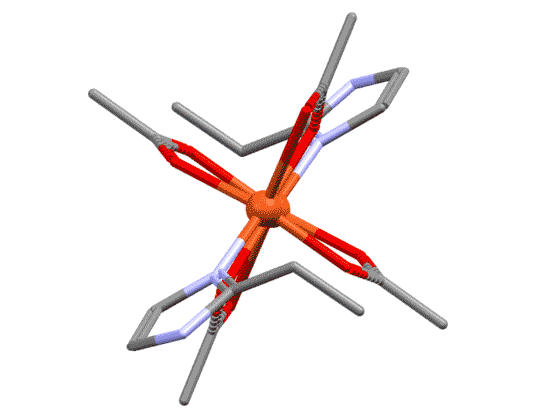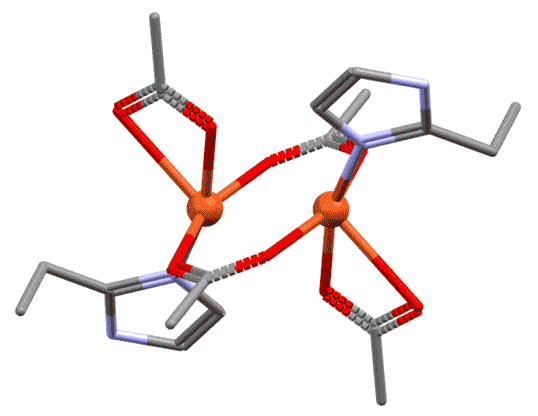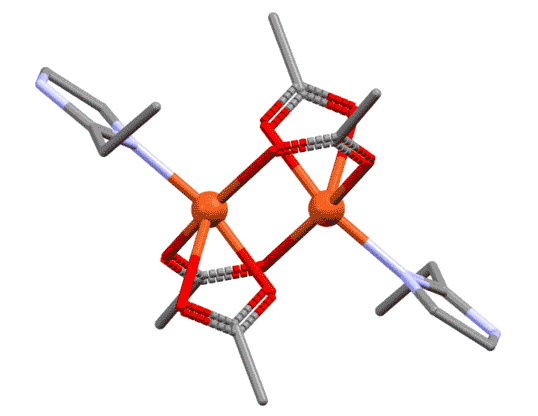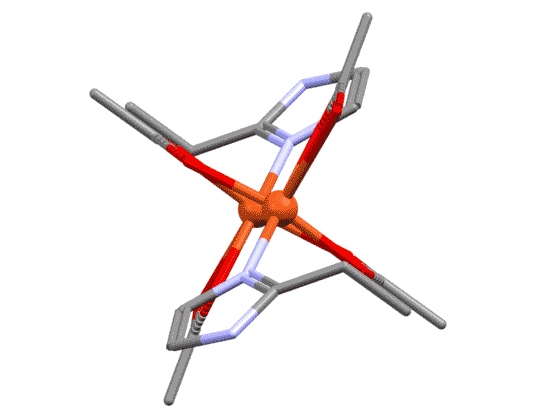
Разглядывая этот двухядерный комплекс, мы можем поупражняться в обычных подсчётах электронов. Каждый атом металла ведёт себя как независимый координационный центр, и мы его оцениваем отдельно. В данном случае оба центра одинаковы, поэтому запишем для любого из них. Мостиковый лиганд мы оцениваем точно так же, как обычный хелатирующий – в данном случае у него два центра, один X-типа, другой L-типа. И если на одном атоме лиганд преоставляет оба типа, то в мостиковом варианте два таких лиганда как бы меняются ролями, уравнивая окружение у каждого атома. Если бы у нас был один мостиковый лиганд такого типа, то центры не смогли бы стать одинаковыми – один получил бы X-конец, второй – L. Слава всем заинтересованным богам, у нас их два. Получаем, что каждый атом меди имеет координационное число 5, степень окисления +2.
Мостиковые лиганды не обязательно являются бидентатными или полидентатными
Для того, чтобы служить мостиком, лиганд не обязательно должен быть настоящим би- или полидентатным. Но обязательно должен иметь минимум два места связывания с атомом металла. Это может быть всё, что угодно – переходные металлы исключительно изобретательны и иногда находят в самых незатейливых молекулах возможности, о которых те и не подозревали. Как минимум, это, например, две неподелённые пары, а это есть, например, у атомов галогенов или кислорода, и поэтому галогениды, вода, гидроксид, алкоксиды и прочее весьма неплохо играют роль мостиков в миллионах координационных соединений.
Когда мы рассматриваем такие комплексы, есть небольшая сложность в том, как учитывать мостиковые лиганды. Общая рекомендация проста – нужно внимательно относиться к валентным возможностям каждого. Фокус здесь в том, что по отношению к связанным мостиком металлу мостиковый лиганд симметричен, каждый металл видит его совершенно одинаково. Но для анализа структуры приходится формально разделить функции. Самый простой и распространённый случай, как в приведённом комплексе. Оба атома металла одинаковы, имеют один и тот же структурный тип. Хлоридный лиганд образует мостик, но до образования мостика он сидел на одном атоме металла хлоридом, то есть X-лигандом. При образовании мостика степень окисления не меняется, поэтому для второго атома металла он стал L-лигандом. Поскольку таких мостика два, второй мы учтём точно так же, но в другом порядке. Это и даст нам симметричное окружение металла. Если металлы в многоядерном комплексе одинаковы, достаточно указать общий структурный тип. Если разные, а так бывает очень часто, то каждый металл должен быть охарактеризован отдельно.
Разберитесь в структуре приведённых комплексов, определите тип лигандов, структурный тип, степень окисления и число d-электронов металла.