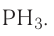Чем определяется число энергетических уровней в атоме
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
Поэтому современная формулировка периодического закона звучит так:
« Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов «.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
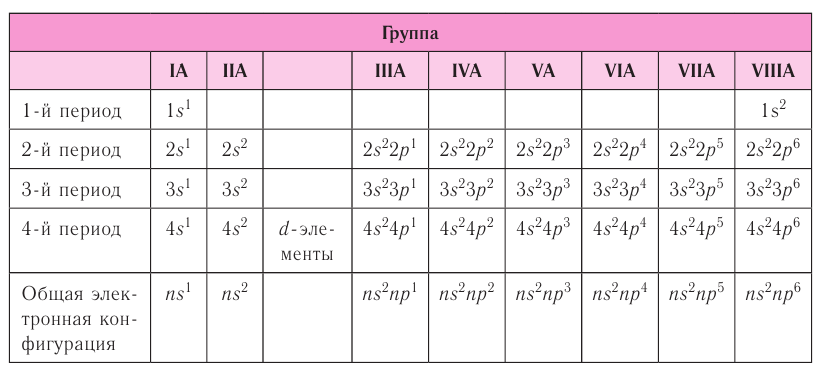
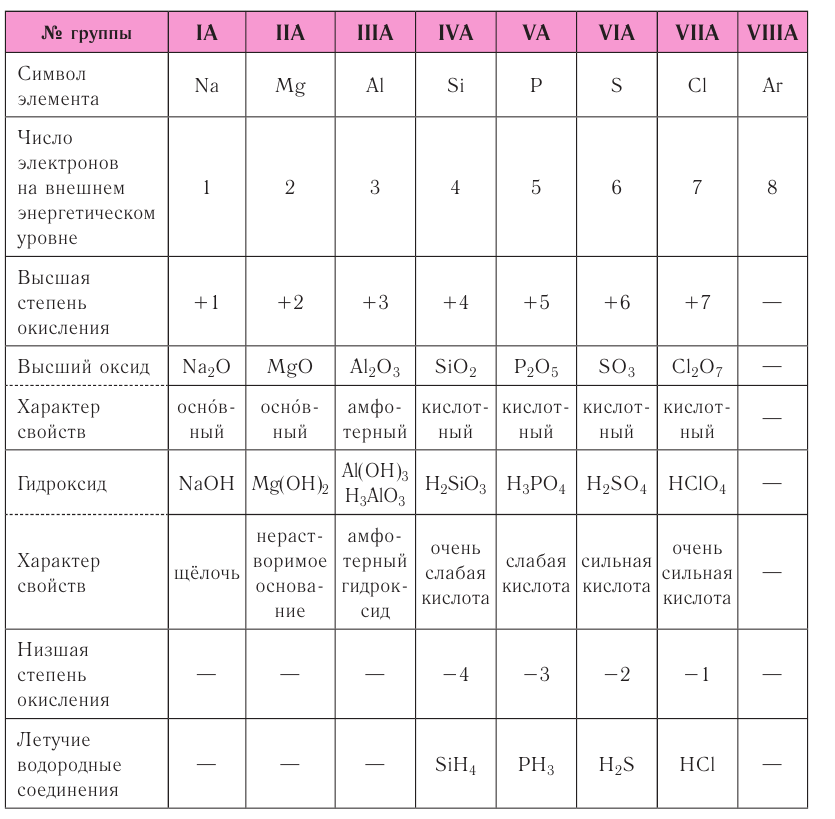
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные , или подгруппы А и побочные , или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
1) O 2) Se 3) F 4) S 5) Na
В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S.
В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142.
Ответ: 142
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома 1) K 2) Li 3) F 4) B 5) Na |
| Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
Рассмотрим закономерности изменения радиусов ионов : катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности: 1) Mg 2) P 3) O 4) N 5) Ti |
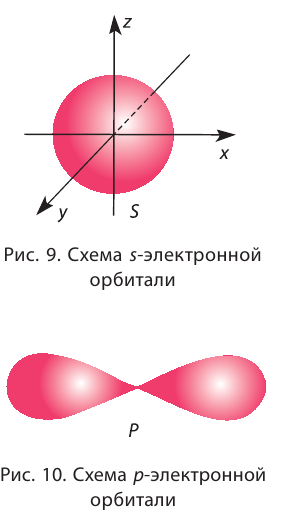
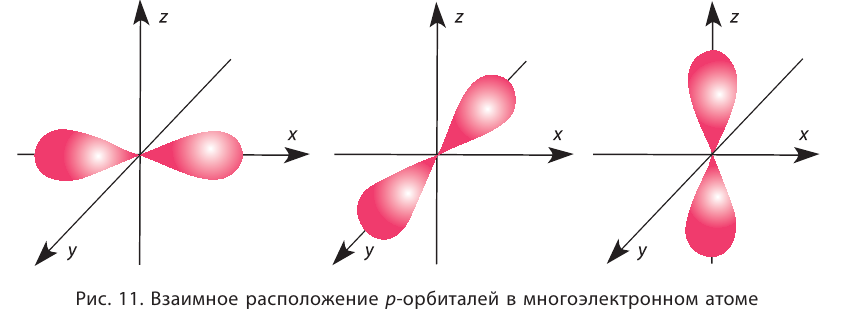
| Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Строение энергетических уровнейПри изучении предыдущей темы мы узнали, чему равно максимальное число электронов на каждой орбитали, на различных энергетических уровнях и подуровнях. Что еще нужно знать для установления строения электронной оболочки атома любого элемента? Для этого нужно знать порядок заполнения орбиталей электронами. Порядок заполнения электронами атомных орбиталей определяет принцип наименьшей энергии (принцип минимума энергии): Основное (устойчивое) состояние атома — это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии. Орбитали одного подуровня имеют одинаковую энергию. Например, три орбитали данного р-подуровня имеют одинаковую энергию. Поэтому принцип наименьшей энергии определяет порядок заполнения энергетических подуровней: электроны заполняют энергетические подуровни в порядке увеличения их энергии. Как показывает рисунок ниже, наименьшую энергию имеет 15-подуровень, который первым заполняется электронами. Затем последовательно заполняется электронами следующие подуровни: 2s, 2р, 3s, 3р. После 3р-подуровня электроны заполняют 4, подуровень, так как он имеет меньшую энергию, чем 3d-подуровень. Это объясняется тем, что энергия подуровня определяется суммой главного и побочного квантовых чисел, т. е. суммой (n + l). Чем меньше эта сумма, тем меньше энергия подуровня. Если суммы n + l одинаковы для разных подуровней, то их энергия тем меньше, чем меньше главное квантовое число n. Изложенные правила были сформулированы в 1951 г. советским ученым В. М. Клечковским (правила Клечковского). На подуровнях, которые показаны на рисунке, может разместиться 112 электронов. В атомах известных элементов находится от 1 до 110 электронов. Поэтому другие подуровни в основных состояниях атомов не заполняются электронами. Наконец, осталось выяснить вопрос, в каком порядке электроны заполняют орбитам одного подуровня. Для этого нужно познакомиться с правилом Гунда: На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома. Рассмотрим, например, какое расположение трех электронов на р-подуровне соответствует устойчивому состоянию атома: Рассчитаем абсолютное значение суммарного спина для каждого состояния: Строение электронных оболочек (электронные конфигурации) атомов элементов I – IV периодов Чтобы правильно изобразить электронные конфигурации различных атомов, нужно знать: 1) число электронов в атоме (равно порядковому номеру элемента); 2) максимальное число электронов на уровнях, подуровнях; 3) порядок заполнения подуровней и орбиталей. Элементы I периода:В таблицах представлены схемы электронного строения, электронные и электронно-графические формулы атомов элементов II, III и IV периодов. Содержание: Строение атома: Атом — наименьшая составная часть простых и сложных веществ. Говоря об атомах, мы подчёркивали, что это химически неделимые частицы, не исчезающие и не возникающие при химических реакциях. В течение многих веков атом считался элементарной, т. е. далее неделимой частицей. И только открытия, сделанные физиками в XIX веке, дали весомые доказательства сложности строения атома. К этим открытиям относятся прежде всего: а) изучение электролиза, т. е. процесса разложения веществ электрическим током; б) открытие катодных лучей — потока отрицательно заряженных частиц, которые впоследствии получили название электроны; и, наконец, в) обнаружение явления радиоактивности, которое представляет собой самопроизвольный распад атомов одних элементов с образованием атомов других элементов. Ядерная модель строения атомаВ начале XX века на основе исследований многих учёных и прежде всего английского физика Э. Резерфорда была установлена принципиальная модель строения атома, получившая название ядерная (планетарная). Согласно этой модели атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Почти вся масса атома (более 99,96 %) сосредоточена в его ядре. Диаметр ядра приблизительно в 100 000 раз меньше диаметра всего атома (порядка Состав атомных ядерСогласно современным представлениям ядра атомов состоят из двух видов частиц: протонов и нейтронов, имеющих общее название нуклоны (от лат. nucleus — ядро). Протоны и нейтроны имеют практически одинаковую массу, равную примерно lu, т. е. одной атомной единице массы (см. § 4). Протон (его символ р) имеет заряд 1+, а нейтрон (символ n) электронейтрален. Заряд электрона (символическое обозначение В таблице 4 приведены основные характеристики элементарных частиц, входящих в состав атома. Протоны и нейтроны удерживаются в ядре особыми силами, которые так и называются ядерные силы. Ядерные силы действуют только на очень малых расстояниях (порядка 10-13 см), но их величина в сотни и тысячи раз превышает силу отталкивания одноимённо заряженных протонов. Энергия связи нуклонов в ядрах атомов в миллион раз превышает энергию химической связи. Поэтому при химических реакциях ядра атомов не разрушаются, а происходит лишь перегруппировка атомов. Число протонов (Z) в ядре атома носит название протонное число. Оно равно атомному номеру элемента и определяет его место в периодической системе. В этом заключается физический смысл атомного номера. Атомный номер определяет место элемента в периодической системе и поэтому его часто называют порядковым номером. Заряд ядра определяется числом протонов, и поскольку атом в целом электроцентралей, то очевидно, что число протонов в его ядре равно числу электронов. Общее число протонов (Z) и нейтронов (N) называется массовым (или нуклонным) числом (A): Массовое число практически определяет массу атома в атомных единицах, так как масса электронов составляет ничтожную часть общей массы атома. Заряд ядра атома (протонное число) и его массовое число указывают числовыми индексами слева от символа химического элемента Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом. ИзотопыБольшинство элементов существуют в виде нескольких нуклидов, которые отличаются друг от друга своими массовыми числами. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Так, природный кислород (Z = 18), кроме атомов, в ядрах которых находится 8 нейтронов Изотопы — нуклиды, имеющие одинаковый атомный номер, но различные массовые числа. Другими словами, изотопы — это нуклиды одного и того же элемента. Поэтому термин «изотопы» следует употреблять только во множественном числе. Изотопы любого элемента действительно занимают одно место в периодической системе, так как принадлежат одному и тому же элементу. Следовательно, и химические свойства изотопов данного элемента также будут практически одинаковы. Теперь мы можем дать более точное определение химического элемента. Химический элемент — это совокупность всех нуклидов, имеющих одинаковый атомный номер (т. е. одинаковый заряд ядра). Названия и символы изотопов совпадают с названиями и символами соответствующих элементов. Только изотопы водорода имеют собственные названия и символы: протий — Так как большинство химических элементов в природе существует в виде смеси нуклидов, то относительная атомная масса данного элемента является средней величиной массовых чисел нуклидов с учётом доли каждого из них в природной смеси. Это объясняет тот факт, что относительные атомные массы большинства элементов не являются целочисленными величинами. Например, углерод существует в природе в виде двух нуклидов — Явление радиоактивностиВсе нуклиды делятся на два типа: стабильные и радиоактивные (радионуклиды). Стабильные нуклиды могут существовать без изменения состава ядер неограниченно долго. Поэтому большинство природных нуклидов, входящих в состав окружающих нас веществ, стабильны. Устойчивому состоянию ядер атомов соответствуют определённые соотношения чисел протонов и нейтронов: для лёгких элементов (с атомными номерами от 1 до 20) — Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц. Основными типами радиоактивных превращений являются (рис. 7): 1) а-распад: а-частицы представляют собой ядра атомов нуклида 2) В данном случае Радиоактивный распад часто сопровождается испусканием Устойчивость радионуклида характеризуется периодом полураспада После открытия явления радиоактивности стало возможным искусственное превращение одних химических элементов в другие, синтез ядер элементов, которые не существуют на Земле. Так были получены элементы, находящиеся в периодической системе после урана U. Конечно, такие процессы, хотя и называются ядерными реакциями, не являются химическими реакциями, при которых атомы не исчезают и не возникают вновь. Атом является электронейтральной микросистемой, состоящей из положительно заряженного ядра и отрицательно заряженных электронов. Атомный номер химического элемента равен относительному заряду ядра его атома, числу протонов в ядре и числу электронов в атоме. Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом. Радиоактивность — самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц. Состояние электрона в атомеХимические свойства атомов проявляются только при химических реакциях. Так как состав ядер атомов при этом не меняется, то очевидно, что все изменения, происходящие с данным атомом в процессе химического превращения, являются результатом изменения его электронного состояния. Большинство свойств атома определяется его электронным строением. Как оно влияет на конкретные свойства атома, на свойства веществ, в составе которых атом находится, можно понять, только правильно представляя состояние электрона в атоме. Электронное облакоОсновой современной теории строения атома являются законы и положения квантовой волновой механики — раздела физики, изучающего движение микрообъектов (электронов, протонов, нейтронов и других частиц). Согласно квантово-механическим представлениям движущемуся электрону присуща двойственная природа. Он является частицей (имеет определённую массу, заряд), но его движение вблизи ядра имеет волновой характер (отсутствует определённая траектория движения, точное местоположение в пространстве и др.). Следовательно, микрообъекты, в том числе и электрон, обладают одновременно корпускулярными и волновыми свойствами. Поскольку у движущегося электрона в атоме отсутствует траектория, то для описания такого движения используется вероятностный подход. Математически определяется не точное положение электрона в атоме, а вероятность его нахождения в той или иной области около ядерного пространства. Состояние (в квантовой механике синоним слова движение) электрона в атоме описывается с помощью квантово-механической модели — электронного облака (рис. 8). Электрон движется возле ядра с огромной скоростью, при которой его отрицательный заряд как бы «размазывается» в пространстве. Получается, что ядро окружено трёхмерным электронным облаком. Плотность такого электронного облака оказывается различной в разных местах. В тех местах, где чаще находится электрон, образуется зона большей электронной плотности. Поскольку существует вероятность нахождения электрона даже на относительно большом расстоянии от ядра, электронное облако не имеет определённых границ. Поэтому обычно его ограничивают условной поверхностью, которая охватывает примерно 90 % электронного облака. Такую область околоядерного пространства называют атомной электронной орбиталью или просто орбиталью. Орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона. Орбитали, в зависимости от энергии электронов, имеют различные формы и размеры. Так, орбиталь единственного электрона атома водорода имеет сферическую (шарообразную) форму. Такие орбитали, имеющие шарообразную форму, обозначаются буквой s, а электроны, которые занимают эти орбитали, называются s-электронами (рис. 9). Чем выше энергия электрона в атоме, тем слабее он притягивается к ядру, тем больше по размеру его орбиталь (электронное облако). Электронная плотность с увеличением размера орбитали уменьшается. Орбитали в многоэлектронных атомах могут иметь и другие формы, например форму гантели («объёмной восьмёрки») (рис. 10). Такие орбитали обозначают буквой р, а электроны, которым они соответствуют, называют р-электронами. Три р-орбитали располагаются (ориентируются) в околоядерном пространстве взаимно перпендикулярно вдоль каждой из трёх осей системы координат (рис. 11). Более сложную форму имеют орбитали d-типа и f-типа. Графически орбиталь изображают в виде клеточки (квантовой ячейки), а электрон — в виде стрелки. Так, орбиталь атома водорода с его единственным электроном можно изобразить следующим образом: Кроме движения вокруг ядра, каждый электрон характеризуется собственным моментом движения, который называется спином. Упрощённо спин (от англ, spin — вращение) можно представить как вращение электрона вокруг собственной оси. Спиновое вращение электрона возможно только по часовой или против часовой стрелки. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины. В этом случае два электрона называются спаренными: Такое их состояние в атоме энергетически выгодно, в отличие от состояния с одинаковыми спинами:
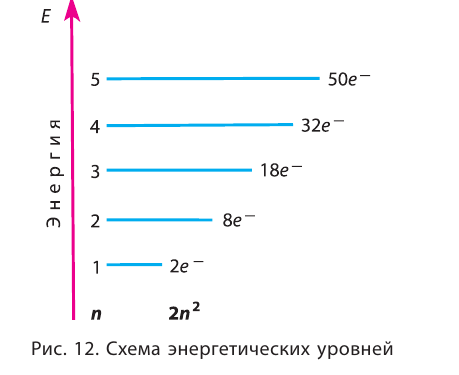
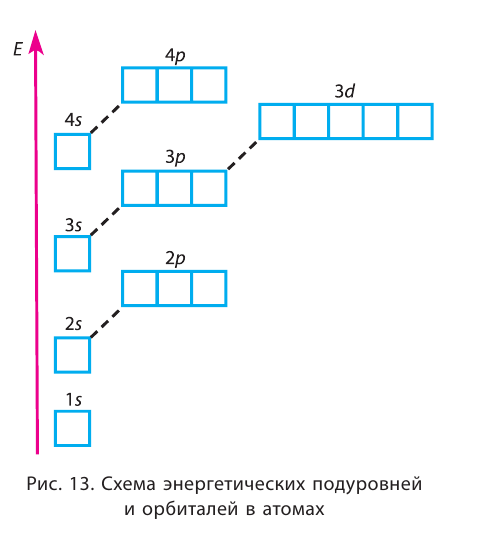
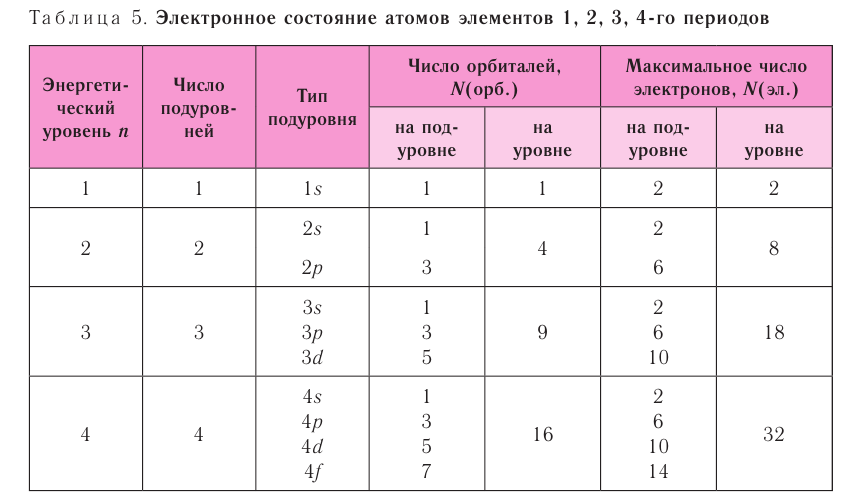
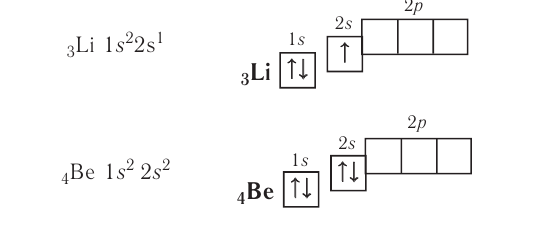
Энергетические уровниЭлектроны в атоме различаются своей энергией. Чем выше энергия электрона в атоме, тем дальше он находится от ядра, следовательно, тем больше размер электронного облака (орбитали). И наоборот, электроны, обладающие относительно небольшой энергией, находятся большую часть времени вблизи ядра, заслоняя (экранируя) его от других электронов, которые притягиваются к ядру слабее и находятся на большем удалении от него. Так образуются как бы оболочки из электронов с близкими значениями энергии. Можно сказать, что электроны с близкими значениями энергии составляют в атоме единый электронный слой, или энергетический уровень. Энергетический уровень (электронный слой, электронная оболочка) — это совокупность электронов с близкими значениями энергий. Число орбиталей На рисунке 12 приведена схема энергетических уровней и их электронной ёмкости. Энергетические подуровниПервый энергетический уровень (n = 1) состоит из одного подуровня (s), второй (n = 2) — из двух (s, р), третий (п = 3) — из трёх (s, р, d) и т. д. Каждый подуровень, в свою очередь, состоит из определённого числа атомных орбиталей. Так, s-подуровень состоит из одной орбитали, р-подуровень — из трёх, d-подуровень — из пяти орбиталей (рис. 13). Из приведённой схемы видно, что s-подуровень каждого энергетического уровня обладает наименьшим запасом энергии: Для того чтобы различать энергетические подуровни и орбитали разных энергетических уровней, их обозначают двумя знаками: 1s, 2р, 3s, 3d. Цифра соответствует номеру энергетического уровня, а буква — типу энергетического подуровня. Обобщим сведения об электронном состоянии атомов элементов первых четырёх периодов в виде таблицы 5. Движущемуся электрону в атоме присуща двойственная природа: он является частицей, имеющей волновой характер движения. Электронное облако — это квантово-механическая модель движения электрона вокруг ядра. Атомная орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины. Совокупность электронов с близкими значениями энергий называется энергетическим уровнем (или, что то же самое, электронным слоем, электронной оболочкой). Электронные конфигурации атомовОбщее число электронов в атоме определяется зарядом его ядра, т. е. протонным числом. Оно равно атомному номеру элемента. Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определённого числа орбиталей. Распределение электронов выражается с помощью электронных конфигураций атома. Например, у водорода, элемента с атомным номером 1, электронная конфигурация — Схематически электронное строение атома изображается с помощью электронно-графической схемы, в которой орбитали представляются в виде клеточек, а электроны — в виде стрелок. Электронно-графическая схема атома водорода изображается так: При составлении формул электронных конфигураций атомов необходимо соблюдать следующие правила. Поэтому орбитали в атомах элементов первых трёх периодов заполняются электронами в порядке увеличения их энергии: Правило: На каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами. Таким образом, у следующего за водородом гелия У атомов элементов второго периода заполняется второй энергетический уровень, на котором может находиться не более 8 электронов. Сначала электроны заполняют 2s-орбиталь (у атомов лития и бериллия): Поскольку 2.s-орбиталь заполнена, то пятый электрон у атома бора В занимает одну из трёх 2р-орбиталей. Электронная конфигурация атома бора —
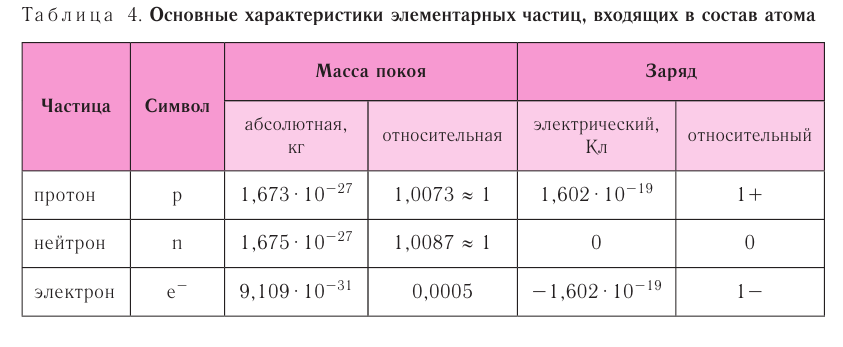
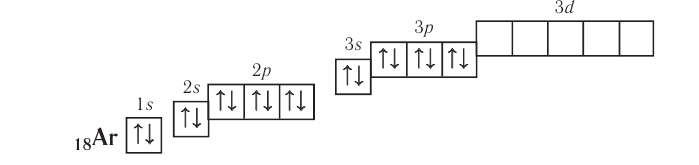
Правило: Оно устанавливает порядок заполнения орбиталей одного подуровня. Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два. Следовательно, электронные конфигурации атомов углерода и азота: Электронная конфигурация внешнего слоя 2.S2 2р6 соответствует его полному заполнению и поэтому является весьма устойчивой. Электронно-графические схемы атомов этих элементов: Электронная конфигурация внешнего слоя В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами s-подуровень у натрия и магния: а затем /7-подуровень у алюминия, кремния, хлора и аргона: Электронно-графическая схема атома аргона: В атоме аргона на внешнем электронном слое находится 8 электронов. Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более 8 электронов. Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой Только после этого начнёт заполняться электронами d-подуровень третьего, теперь уже предвнешнего, энергетического уровня. Кроме электронных конфигураций и электронно-графических схем иногда используют и электронные схемы атомов, в которых указывают только число электронов на каждом энергетическом уровне (электронном слое): С такими схемами вы познакомились ещё в 8-м классе. Электронное строение атома определяется зарядом его ядра, который равен атомному номеру элемента в периодической системе. Распределение электронов по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем, а также электронных схем атомов. На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов. Периодический закон и периодическая система химических элементовВот уже четвёртый год вы изучаете химию и всё это время пользуетесь таблицей химических элементов, которая представляет собой графическое изображение периодической системы элементов. Периодическая система, в свою очередь, является выражением периодического закона, открытого русским химиком Д. И. Менделеевым в 1869 году. С тех пор периодический закон — основа современной химии. Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы. Согласно этой теории главной характеристикой атома является положительный заряд ядра. Заряд ядра определяет число электронов в атоме, его электронное строение и, следовательно, все свойства атомов данного элемента и его положение в периодической системе. Поэтому современная формулировка периодического закона такова: Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ, находятся в периодической зависимости от зарядов атомных ядер. Структура периодической системыСо структурой периодической системы в общих чертах вы уже знакомы. Все химические элементы в ней располагаются в порядке возрастания атомного номера, который поэтому имеет ещё одно название — порядковый номер. Численная величина атомного номера равна положительному заряду ядра атома соответствующего элемента. В таблице семь горизонтальных рядов элементов, которые называются периодами, а также восемнадцать вертикальных столбцов — групп. Таким образом, каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе. Известно около 700 форм графического изображения периодической системы. Но принципиальный подход к построению таблиц единый — элементы располагаются в порядке возрастания зарядов ядер их атомов. По мере увеличения атомного номера происходит постепенная застройка электронной структуры атомов элементов в соответствии с принципами заполнения. Таким образом, структура периодической системы связана с электронной структурой элементов. В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре типа (семейства) элементов: ПериодыПериодом в периодической системе называется последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от Таблица 6. Последовательность заполнения энергетических подуровней у элементов различных периодов При этом номер периода совпадает с номером п внешнего энергетического уровня. Другими словами, номер периода указывает на число энергетических уровней, на которых находятся электроны в атомах данного элемента. В этом заключается физический смысл номера периода. Каждый из периодов (исключая первый) начинается типичным металлом (металл щелочной группы) и заканчивается благородным газом, которому предшествует неметалл, т. е. в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне. Первые три периода содержат только s- и p-элементы. Четвёртый, пятый и последующие периоды включают в свой состав также элементы, у атомов которых происходит заполнение d-подуровня предвнешнего энергетического уровня. У элементов шестого и седьмого периодов, помимо S-, р- и d-подуровней заполняются и f-подуровни третьего снаружи электронного слоя. f-Элементы объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы), которые вынесены за пределы таблицы (см. форзац 1). ГруппыВ вертикальных колонках, называемых группами, объединены элементы, атомы которых имеют сходное электронное строение. Всего в таблице 18 групп, пронумерованных арабскими цифрами. Кроме того, группы имеют традиционную нумерацию римскими цифрами от I до VIII с добавлением букв А или В. У атомов элементов групп А последними заполняются s- и р-подуровни внешних энергетических уровней (табл. 7). Элементы, у которых последними заполняются d-подуровни второго снаружи или f-подуровни третьего снаружи энергетического уровня, составляют группы В. Атомы элементов групп А и В различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в группы с одинаковыми римскими номерами (I, II и т. д.). Номер группы (римскими цифрами), как правило, указывает число электронов в атоме, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. Электроны, которые принимают участие в образовании химических связей, называются валентными. У элементов групп А валентными являются электроны внешнего энергетического уровня, а у элементов групп В — ещё и электроны предпоследних уровней. Это основное различие между элементами групп А и В. Сейчас мы можем дать более точное определение понятия группа. Группа — вертикальный столбец элементов с одинаковым числом валентных электронов в атомах. Таким образом, строгая периодичность расположения химических элементов в периодической системе полностью объясняется последовательным характером заполнения энергетических уровней и подуровней их атомов. Главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе. Горизонтальный ряд элементов, расположенных в порядке возрастания их атомных номеров, начинающийся щелочным металлом и заканчивающийся благородным газом, называется периодом. Вертикальный столбец элементов, атомы которых имеют одинаковое строение внешних электронных слоев, называется группой. Периодичность изменения свойств атомов химических элементов и их соединенийПоскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все их свойства, определяемые электронным строением, закономерно изменяются по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные характеристики атомов: атомные и ионные радиусы, электроотрицательность, степень окисления и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами-аналогами. Атомные и ионные радиусыС точки зрения квантовой механики атом не имеет строго определённых границ, так как орбитали, на которых расположены его электроны, также не имеют точных размеров. О размерах атомов и ионов судят по экспериментальным данным о расстояниях между соседними атомами в молекулах или кристаллах. Условно форму атома или иона считают шарообразной, поэтому количественной характеристикой их размера служит радиус. Различают атомные радиусы и ионные радиусы. При этом радиусы положительных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так как они образованы в результате отдачи электронов. Радиусы отрицательных ионов (анионов) больше радиусов атомов, поскольку они образовались путём присоединения дополнительных электронов. Например, радиус атома натрия Na — 189 пм, а иона натрия Как изменяются радиусы атомов в группе и в периоде с ростом атомного номера элементов? У элементов, находящихся в одной группе, при переходе сверху вниз от одного элемента к другому увеличивается число электронных слоёв и, следовательно, увеличивается радиус как атомов, так и ионов. Например, в группе щелочных металлов радиусы атомов: Li — 155 пм, Na — 189 пм, К — 236 пм, а ионов: В периодах периодической системы по мере увеличения заряда ядра атомов увеличивается притяжение к нему электронов, находящихся на одном и том же электронном слое, что приводит к уменьшению радиуса атомов. Например, у элементов третьего периода атомные радиусы уменьшаются от натрия до хлора — от 189 пм до 99 пм. ЭлектроотрицательностьПроявление металлических или неметаллических свойств у атомов данного элемента связано прежде всего с их способностью терять или приобретать электроны. Отдача или присоединение электронов атомами обычно происходит в процессе их химического взаимодействия. Характеристикой атома, учитывающей его способность смещать к себе валентные электроны, является электроотрицательность. Она обозначается буквой греческого алфавита X (хи). Электроотрицательность атома — условная величина, характеризующая его способность в химических соединениях смещать к себе электроны от других атомов. Для практической оценки этой способности атомов введена условная относительная шкала электроотрицательностей. По этой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор F (X = 4,1), а наименее электроотрицательным — франций Fr (X = 0,86). У элементов групп А в периодах с ростом атомного номера элементов электроотрицательность возрастает, а в группах, как правило, убывает. По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы обычно имеют значение электроотрицательности больше двух. Они располагаются в правой верхней части периодической таблицы. У металлов значение электроотрицательности меньше двух. Несколько элементов (В, Si, Ge, As,Те) со значением электроотрицательности, близким к 2, располагаются вдоль диагонали от бора В к астату At. Атомы этих элементов проявляют промежуточные свойства, поэтому их часто называют полуметаллами (рис. 14). Периодичность изменения свойств соединений Периодический характер изменения строения, физических и химических свойств присущ также простым и сложным веществам. Рассмотрим в качестве примера закономерности изменения некоторых свойств атомов и соединений элементов 3-го периода (табл. 8). Таблица 8. Изменение свойств атомов элементов 3-го периода и их соединений Как следует из таблицы, в периоде при переходе слева направо от одного элемента к другому происходит увеличение высшей степени окисления и понижение (по абсолютной величине) низшей степени окисления. Периоды начинаются щелочными металлами, которые образуют растворимые в воде основные оксиды и гидроксиды. При переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов. Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек атомов и поэтому их атомы проявляют сходные химические свойства. Такой характер изменения свойств в основном повторяется во всех периодах (кроме первого), следовательно, такое изменение свойств называется периодическим. Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация внешних электронных оболочек и, как следствие, периодически повторяются химические свойства атомов элементов и их соединений. В этом заключается физический смысл периодического закона. Атомные и ионные радиусы атомов элементов с ростом атомного номера уменьшаются в периодах слева направо и увеличиваются в группах сверху вниз. С увеличением атомного номера в пределах каждого периода электроотрицательность возрастает, а в группе — уменьшается, т. е. металлические свойства атомов элементов в периоде ослабевают, а в группе — усиливаются. Периодическое изменение свойств атомов химических элементов при увеличении положительного заряда ядер объясняется тем, что периодически повторяется строение внешних электронных слоёв атомов. Характеристика химического элемента по его положению в периодической системе и строению атомаПериодический закон и отражающая его периодическая система элементов представляют собой как бы краткое обобщение химии элементов и их соединений. Таблица периодической системы содержит сведения, позволяющие описать строение атомов химических элементов, предсказать состав, строение и свойства образованных ими простых веществ и наиболее характерных соединений: оксидов, соответствующих им гидроксидов, солей, летучих водородных соединений и т. д. Именно поэтому таблица периодической системы является непременной составляющей любого учебного и справочного пособия по химии. В описании любого элемента особую роль играет его атомный номер Z, с которым связано положение элемента в периодической системе. Атомный номер даёт возможность знать не только порядковый номер элемента в периодической системе, но и его место в периоде и группе, а также электронное строение его атомов. Описание любого химического элемента необходимо проводить по определённому алгоритму, т. е. соблюдая строгую последовательность действий. В этой последовательности главными этапами являются следующие: Составим более детальный алгоритм такого описания химического элемента. 1. Общие сведения об элементе: 2. Положение химического элемента в периодической системе: 3. Состав атома: 4. Электронное строение атомов элемента: 5. Состав и свойства простого вещества: 6. Степени окисления элемента в высших оксидах и летучих водородных соединениях. Электроотрицательность. 7. Формулы оксидов и соответствующих им гидроксидов. Характеристика кислотно-основных свойств этих соединений. 8. Формула летучего водородного соединения. Охарактеризуем, согласно приведённому алгоритму, два химических элемента — натрий и фосфор. Натрий 1. Название химического элемента — натрий, химический знак — Na, относительная атомная масса — 23. 2. Натрий — элемент с атомным номером 11, находится в 3-м периоде, в группе IA. 3. Заряд ядра атома натрия 11+, следовательно, в ядре находится 11 протонов, общее число электронов также 11. В ядре нуклида натрия Кратко состав этого атома выражается так: 4. Электронная схема атома натрия:
Электронная конфигурация внешнего энергетического уровня: 5. Так как на внешнем энергетическом уровне у натрия находится 1 электрон, то этот элемент относится к группе металлов. Простое вещество при обычных условиях — твёрдый металл. Формула простого вещества — Na. 6. Степень окисления в высшем оксиде +1. Летучих водородных соединений не образует. Электроотрицательность натрия 7. Формула высшего оксида — 8. Летучего водородного соединения не образует. Фосфор 1. Фосфор 2. Z = 15. Положение в периодической системе: 3. Состав атома (нуклида 4. Электронная схема: Электронная конфигурация: Электронная конфигурация внешнего энергетического уровня: 5. Фосфор — неметалл. При обычных условиях — твёрдое вещество; молекулярная формула — 6. Степени окисления: а) в высших оксидах — +5; б) в летучих водородных соединениях — —3. Электроотрицательность: 7. Формула высшего оксида — 8. Летучее водородное соединение — Периодический закон Д. И. Менделеева — один из наиболее общих и фундаментальных законов природы. Он является основой развития не только химии, но и всего естествознания в целом, позволяет раскрывать новые закономерности природы и проникать в их суть. Периодическая система химических элементов представляет собой естественно-научную классификацию элементов по электронному строению их атомов, на основе которой строится изучение химии и решение её практических задач. При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи Сайт пишется, поддерживается и управляется коллективом преподавателей Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC. Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
|










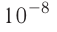

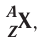 , например:
, например: 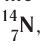
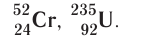
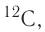 кислород-17, или
кислород-17, или 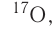 хлор-35, или
хлор-35, или 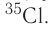
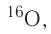 имеет нуклиды с числом нейтронов 9 и 10 —
имеет нуклиды с числом нейтронов 9 и 10 — 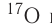 и
и 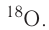 Такие нуклиды являются изотопами (от греч. изос — равный, топос — место), т. е. «занимающими одно место» в таблице периодической системы.
Такие нуклиды являются изотопами (от греч. изос — равный, топос — место), т. е. «занимающими одно место» в таблице периодической системы.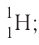 дейтерий — D, или
дейтерий — D, или 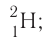 тритий — Т, или
тритий — Т, или 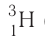 (рис. 6).
(рис. 6).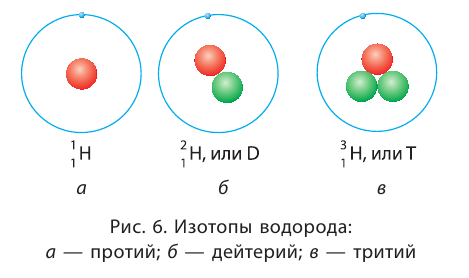
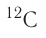 (его доля в природной смеси равна 0,9889) и
(его доля в природной смеси равна 0,9889) и 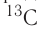 (доля которого равна 0,0111). Относительная атомная масса этого элемента составляет:
(доля которого равна 0,0111). Относительная атомная масса этого элемента составляет: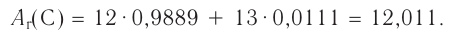
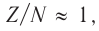 для тяжёлых — около 0,6. При нарушении протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.
для тяжёлых — около 0,6. При нарушении протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.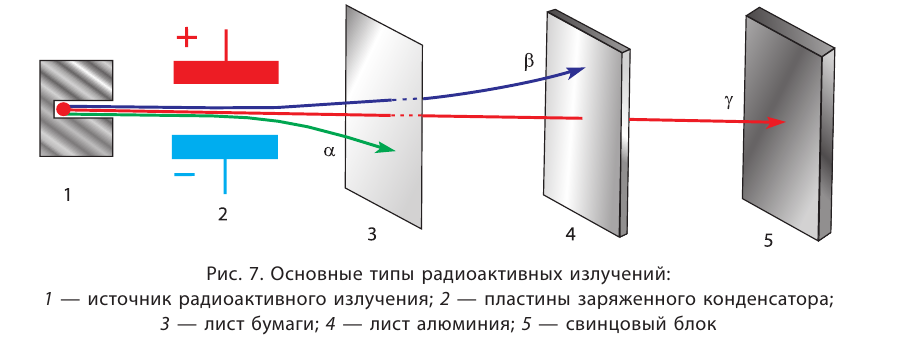
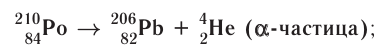
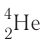 с положительным зарядом 2 + ;
с положительным зарядом 2 + ;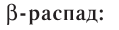 :
: 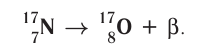
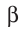 частица является фактически электроном, образующимся в ядре атома в результате превращения нейтрона в протон:
частица является фактически электроном, образующимся в ядре атома в результате превращения нейтрона в протон: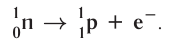
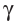 —лучей — потока квантов жёсткого электромагнитного излучения, не имеющих заряда (см. рис. 7).
—лучей — потока квантов жёсткого электромагнитного излучения, не имеющих заряда (см. рис. 7).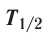 — временем, за которое число ядер уменьшается в результате распада вдвое. Для разных радионуклидов оно колеблется от долей секунды до миллиардов лет. Так, для
— временем, за которое число ядер уменьшается в результате распада вдвое. Для разных радионуклидов оно колеблется от долей секунды до миллиардов лет. Так, для 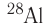 период полураспада равен 2,2 минуты, для
период полураспада равен 2,2 минуты, для 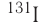 — 8 суток, для
— 8 суток, для 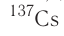 — 30,17 года, а для
— 30,17 года, а для 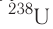 — почти 4,5 млрд лет.
— почти 4,5 млрд лет.
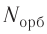 на данном энергетическом уровне равно:
на данном энергетическом уровне равно: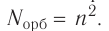 Так как на каждой орбитали не может быть больше двух электронов, то максимальное число электронов
Так как на каждой орбитали не может быть больше двух электронов, то максимальное число электронов 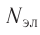 на энергетическом уровне равно удвоенному квадрату номера уровня:
на энергетическом уровне равно удвоенному квадрату номера уровня: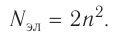
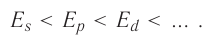
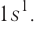 В этой формуле цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
В этой формуле цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.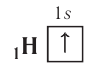
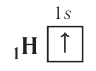 . Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.
. Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.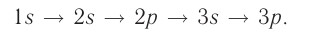
 электронная конфигурация —
электронная конфигурация — 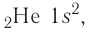 а электронно-графическая схема:
а электронно-графическая схема: 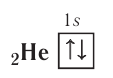
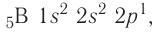 а электронно-графическая схема:
а электронно-графическая схема: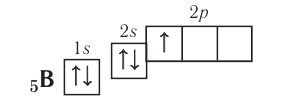

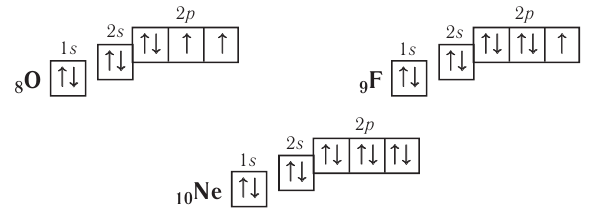
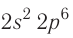 соответствует его полному заполнению и поэтому является весьма устойчивой.
соответствует его полному заполнению и поэтому является весьма устойчивой.
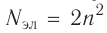 максимально на нём может находиться 18 электронов: 8 на s- и р-подуровнях и 10 — на d-подуровне. Этот подуровень будет формироваться у элементов четвёртого периода. Но сначала у первых двух элементов четвёртого периода — калия и кальция — появляется четвёртый электронный слой, который открывается s-подуровнем (энергия подуровня 4s несколько меньше, чем подуровня 3d, см. рис. 13):
максимально на нём может находиться 18 электронов: 8 на s- и р-подуровнях и 10 — на d-подуровне. Этот подуровень будет формироваться у элементов четвёртого периода. Но сначала у первых двух элементов четвёртого периода — калия и кальция — появляется четвёртый электронный слой, который открывается s-подуровнем (энергия подуровня 4s несколько меньше, чем подуровня 3d, см. рис. 13):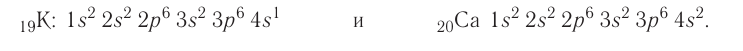
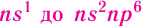 (для первого периода
(для первого периода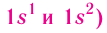 (табл. 6).
(табл. 6).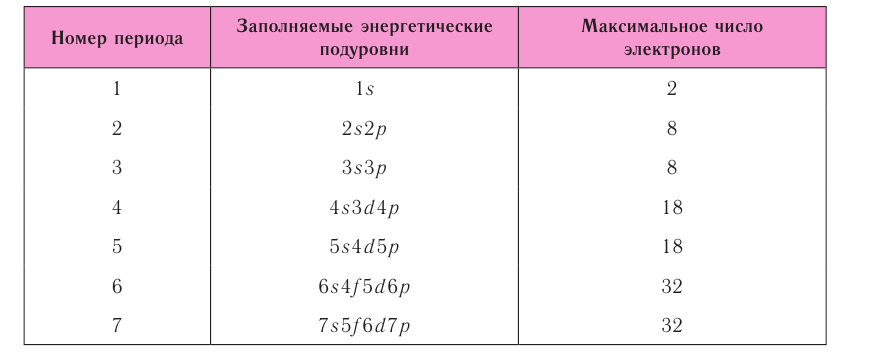
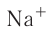 — 99 пм, радиус атома хлора С1 — 99 пм, а его иона
— 99 пм, радиус атома хлора С1 — 99 пм, а его иона 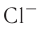 — 181 пм (1 пм (пикометр) =
— 181 пм (1 пм (пикометр) = 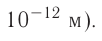
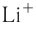 — 68 пм,
— 68 пм, 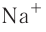 — 99 пм,
— 99 пм, 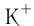 — 138 пм.
— 138 пм.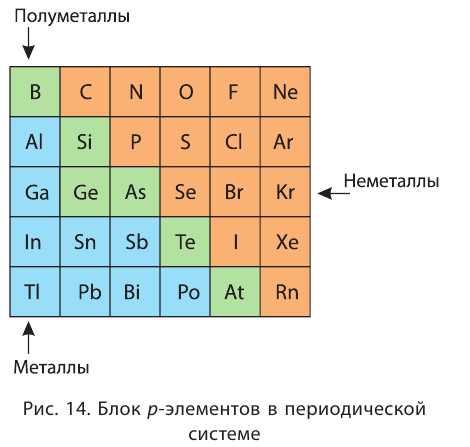
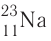 содержатся ещё 12 нейтронов.
содержатся ещё 12 нейтронов.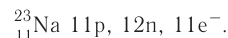
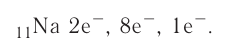
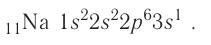
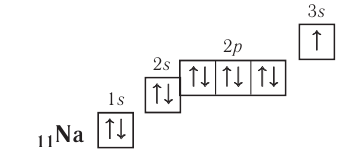
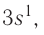 следовательно, это s-элемент.
следовательно, это s-элемент. = 1,01.
= 1,01.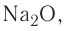 он имеет основный характер. Гидроксид, соответствующий ему, представляет собой основание NaOH, растворимое в воде, т. е. щёлочь.
он имеет основный характер. Гидроксид, соответствующий ему, представляет собой основание NaOH, растворимое в воде, т. е. щёлочь.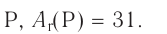
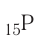 — 3-й период, группа VA.
— 3-й период, группа VA.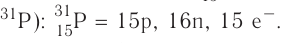
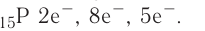
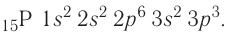 Электронно-графическая схема:
Электронно-графическая схема: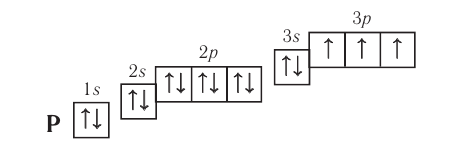
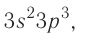 р-элемент.
р-элемент.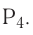
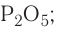 кислотный. Формула высшего гидроксида —
кислотный. Формула высшего гидроксида — 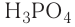 (фосфорная кислота).
(фосфорная кислота).