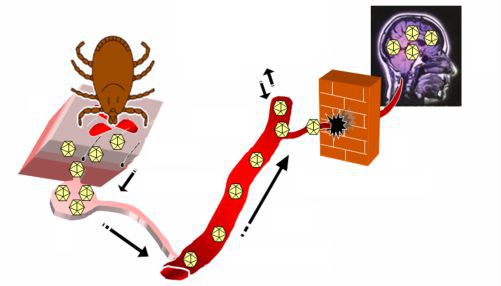
Чем опасно заболевание клещевым энцефалитом для человека
Что такое энцефалит клещевой? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Клещевой энцефалит — это острое и хроническое природно-очаговое инфекционное заболевание, вызываемое вирусом клещевого энцефалита, который приводит к остролихорадочному состоянию, поражению различных отделов нервной системы в виде вялых парезов и параличей. Как правило, является трансмиссивным, т. е. передаётся кровососущими насекомыми.
Основные признаки признаки клещевого энцефалита: слабость, тяжесть в голове, головные боли, повышение температуры тела до 38-39 °C, боли в мышцах и суставах, тошнота, рвота и нарушение координации.
Краткое содержание статьи — в видео:
Этиология
Вирус клещевого энцефалита впервые выделен в 1937 году Л. Зильбером.
Род — Flavivirus (группа В)
Вид — вирус клещевого энцефалита, который делится на шесть генотипов (наиболее значимы дальневосточный, урало-сибирский и западный).
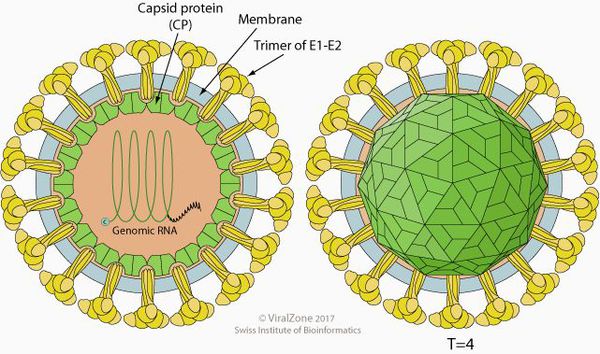
Клещевой энцефалит представляет собой РНК-вирус, который локализуется в нервной ткани. Он имеет сферическую форму 40-50 нм в диаметре. Содержит нуклеокапсид, окружённый наружной липопротеидной оболочкой со встроенными в него шипиками гликопротеида (способны склеивать эритроциты).
Эпидемиология
Природно-очаговое заболевание. Ареал распространения охватывает Сибирь, Дальний Восток, Урал, Европейскую часть России, а также Европу.
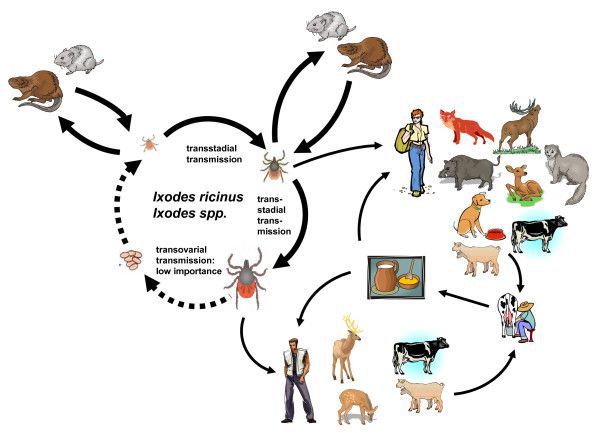
Основные резервуары инфекции — иксодовые клещи Ixodes persulcatus (таёжные клещи) и Ixodes ricinus (собачьи клещи), иногда другие представители иксодовых клещей.
Второстепенный резервуар вируса в природе — теплокровные млекопитающие (зайцы, белки, бурундуки, мыши, лисы, волки, козы и другие) и птицы (дрозд, снегирь, теререв и другие).
Самки клещей способны передавать приобретённые возбудители вируса потомству, что обеспечивает постоянный уровень заразности данных членистоногих и циркуляцию возбудителя.
В одном клеще может содержаться до 10 10 вирусных частиц, а попадание всего 1:1000000 доли в организм человека вполне может привести к развитию заболевания. Чем упитаннее клещ, тем больше в нём концентрация вируса.
Основной круг циркуляции вируса: клещи — прокормители (животные и птицы) — клещи. При заражении человека цикл прерывается, так как после попадания вируса в организм человека он прекращает своё распространение (биологический тупик).
Для заболевания характерна осенне-летне-весенняя сезонность в средней полосе, обусловленная пиками активности клещей в зависимости от природно-климатических условий. Иногда регистрируются случаи активизации клещей и заболеваний в зимнее время при оттепелях.
Места обитания клещей — лиственные и смешанные лиственно-хвойные леса с выраженным кустарниковым и травяным покровом, а также тропинками животных, являющихся прокормителями клещей.
Пути заражения
Заражение происходит при нападении клещей на людей в пригородной зоне, полях, лесах, дачных участках во время отдыха, сбора грибов. Нередко случаи заражения регистрируются и в самих городах: в парковых зонах, области газонов. Возможен механический перенос клещей на одежде, вещах, продуктах и их переползание на людей, не бывающих на природе.
Механизмы передачи:
Действия при укусе клеща
При обнаружении присосавшегося клеща не следует отрывать клеща, уничтожать его или раздавливать. Необходимо незамедлительно обратиться в травматологическое отделение (если это возможно в короткие сроки), где клеща извлекут и отправят на исследование — это поможет оценить риски и принять решение о необходимости профилактического лечения и наблюдения.
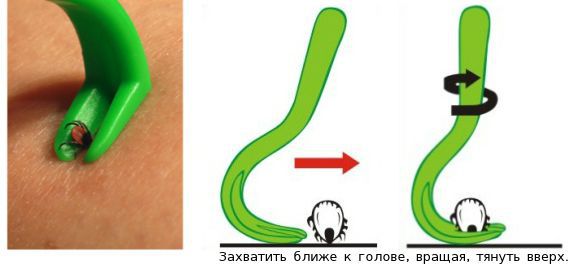
Если нет возможности своевременно посетить травматологическое отделение, то следует самостоятельно удалить клеща при помощи специального устройства или обычным пинцетом с острым концом.
При удалении клеща пинцетом необходимо захватить паразита как можно ближе к голове и медленно равномерно потянуть вверх. Нельзя дёргать или перекручивать клеща, поскольку это может привести к отрыву частей его рта. После извлечения следует проверить целый ли клещ — если части насекомого осталась в коже, то нужно постараться аккуратно извлечь их пинцетом или иглой. Если это не удаётся, то нужно оставить их в покое, обработать место укуса и руки антисептиком (спиртом или водой с мылом) и обратиться в травматологическое отделение, где специалисты извлекут остатки клеща.
Клеща следует оставить живым, поместив в баночку, бутылёк, пакет или другие ёмкости, из которых он не сможет выбраться — это нужно для анализа.
Не следует использовать народные методы извлечения — смазывание клеща маслом, лаком, вазелином, прижигание.
Также параллельно необходимо обратиться к врачу-инфекционисту для наблюдения, обследования и получения рекомендаций по профилактической терапии. Это нужно сделать, не дожидаясь результатов исследования клеща. Врача-инфекциониста следует посетить также и в том случае, если в течение одного месяца появляются характерные для клещевой инфекции симптомы.
Симптомы клещевого энцефалита
Клиническая картина заболевания может различаться в зависимости от серотипа вируса: как правило, более тяжело протекает Дальневосточный и Сибирский варианты; течение болезни в Европейской части РФ и Европе отмечается более мягким и благоприятным течением.
Инкубационный период — от 1 до 35 дней (в среднем 2-3 недели), чёткой зависимости тяжести болезни и срока инкубации нет.
Схематично течение болезни в остром периоде можно разделить на шесть стадий:
Первые признаки клещевого энцефалита
Чаще всего заболевание протекает в скрытой или лёгкой форме, проявляющейся небольшим повышением температуры тела, слабой головной болью без чёткой локализации, общим недомоганием и нарушениями сна (до 90% всех случаев).
Иногда в случаях более выраженного течения болезнь начинается выраженных с продромальных явлений в виде познабливания, слабости, тяжести в голове, диффузных головных болей слабой интенсивности в течение 1-2 дней.
Развитие заболевания
Затем заболевание манифестирует резким повышением температуры тела до 38-39°C, резкого озноба, потливости, выраженных головных болей распирающего характера, нередко сопровождающихся тошнотой, рвотой и нарушением координации. Больной заторможен, апатичен, вяло реагирует на внешние раздражители. Его лицо, шея и грудь гиперемированы. Возможно появление болей в различных участках тела, мышцах и суставах, иногда возникают фасцикулярные подёргивания. В дальнейшем нарастает слабость, повышение потливости, колебания (лабильность) артериального давления, парестезии (онемения) отдельных участков тела без нарушения двигательных функций. Появляются симптомы поражения мозговых оболочек, таких как ригидность затылочных мышц, симптомы Кернига и Брудзинского.
При алиментарном заражении (через пищу) возможны боли в животе, диарея, появление плотного белого налёта на языке, а также двухволновая лихорадочная реакция:
При благоприятном течении указанные признаки постепенно регрессируют, иногда оставляя после себя резидуальные (остаточные) явления различно выраженности и продолжительности.
В отдельных случаях симптоматика нарастает и проявляется в виде выраженного токсикоза, появления очаговой симптоматики, парезов, нарушения сознания, дыхания и деятельности сердечно-сосудистой системы. Прогноз в таких случаях серьёзен.
При хроническом течении болезни возможен широкий полиморфизм клинических проявлений, однако чаще наблюдаются следующие признаки:
Патогенез клещевого энцефалита
Входные ворота — поврежденная клещом кожа, слизистые оболочки кишечника, желудка, редко конъюнктива глаза (при размазывании клеща и не помытых руках).
Вирусемия — попадание вируса в кровь и его распространение в организме — проходит два этапа.
Гематогенным путём вирус попадает в головной мозг, где активно размножается, попутно, более медленно продвигаясь по лимфатическим путям, сенсибилизирует (повышает чувствительность) сегментарные участки тканей — часто в этих местах выявляются более значимые неврологические изменения.
После фазы размножения в нервной ткани вирус снова попадает в кровь и вызывает повторную сенсибилизацию уже предварительно сенсибилизированных тканей. Это ведёт к специфической аллергической реакции, альтерации (функциональному повреждению) нервных клеток и нарушению микроциркуляции. В различных отделах нервной системы образуются очаги микронекроза, поддерживаемые генерализованным воспалительным процессом в нервной ткани (с преимущественным вовлечением центральных отделов), что и определяет выраженность симптомов заболевания.
Благодаря цитопатическому действию вируса клещевого энцефалита (дегенеративному изменению) происходит депрессия выработки и снижение содержания циркулирующих Т-лимфоцитов, а также запоздалая реакция пролиферации В-лимфоцитов (иногда только к трём месяцам), т. е. развивается иммунодефицитное состояние, поддерживающее развитие патологических изменений головного мозга. Развивающийся иммунный ответ дезактивирует вирусные частицы вначале в межклеточном пространстве, затем при присоединении системы комплемента разрушает инфицированные клетки.
В некоторых случаях вирус запускает механизмы уклонения от иммунного ответа (особенности отдельных штаммов вируса, антигенный дрейф, индивидуальные особенности иммунологической реактивности человека и другое), что обуславливает возможность его длительного нахождения в организме и формирования хронических форм.
Классификация и стадии развития клещевого энцефалита
Заболевание классифицируют по клиническим формам, длительности, степени тяжести.
Формы клещевого энцефалита
Выделяют острый и хронический клещевой энцефалит. Острый энцефалит подразделяется на инапарантную, лихорадочную, менингеальную, менингоэнцефалитическую, полиоэнцефалитическую, полиоэнцефаломиелическую, полиомиелитическую и двухволновую формы.
Инапарантная (скрытая) форма — выявление специфических маркеров инфекции в крови при отсутствии или минимальной выраженности клинических проявлений.
Лихорадочная форма — внезапное повышение температуры тела до 38-39 °C, тошнота, иногда рвота, повышенный тонус затылочных мышц без изменений состава ликвора (менингизм), общая слабость, потливость продолжительностью около недели. Как правило, заканчивается благоприятно, после возможен средней продолжительности астеновегетативный синдром.
Менингеальная форма (наиболее частая манифестная форма) — возникновение всех проявлений лихорадочной формы с добавлением патологических симптомов раздражения мозговых оболочек, выраженного токсикоза. Иногда при присоединении преходящей рассеянной неврологической симптоматики происходит изменение сухожильных рефлексов, анизорефлексия (неодинаковость рефлексов), асимметрия лица и другое. Изменения ликвора характеризуются повышением внутричерепного давления до 300 мм вод. ст., выявляется лимфоцитарный плеоцитоз до 300-900 клеток в 1 мкл, повышается уровень белка до 0,6 г/л, содержание сахара не изменяется. В целом продолжительность болезни — около 20 дней, чаще протекает благоприятно, возможны остаточные явления в виде внутричерепной гипертензии, головных болей, субфебрилитета до 2-3 месяцев.
Менингоэнцефалитическая (очаговая и диффузная) форма — тяжёлая, жизнеугрожающая форма заболевания. При диффузном поражении на первый план выходят токсические и общемозговые симптомы, развитие судорог, нарушения сознания различной выраженности, иногда до комы. При очаговом поражении на фоне общемозговой и токсической симптоматики развиваются двигательные нарушения — центральные парезы (как правило, полностью обратимые).
Полиоэнцефалитическая форма — нарушения глотания, питья, речи, различные нарушения зрения, иногда подёргивания языка, при попытке пить вода выливается через нос, возможен парез мягкого нёба. Характерными проявлениями являются нарушения дыхания центрального типа, сосудистый коллапс и паралич сердца, что ведёт к летальному исходу. При благоприятном течении характерен длительный (иногда более года) астенический синдром.
Полиоэнцефаломиелическая форма — крайне тяжёлое течение, характеризуется поражением черепных нервов, параличом сердца и дыхания с летальностью до 30%. В остальных случаях — высокая вероятность параличей и перехода заболевания в хроническую форму
Полиомиелитическая форма — вялые параличами мышц шеи, плечевого пояса и верхних конечностей, периодические нарушения чувствительности этих областей, атония. Очень показателен т. н. синдром «свислой головы», когда больной не может удержать голову в вертикальном положении. Иногда вследствие поражения диафрагмы страдает дыхание, что достаточно опасно. Течение данной формы длительное, восстановление функции поражённых отделов не всегда проиходит в полном объёме.
Двухволновое течение с указанием формы второй волны — первая волна лихорадки в течение недели с комплексом общемозговых и интоксикационных нарушений, затем период мнимого благополучия продолжительностью 1-2 недели, и наступление второй волны повышения температуры тела, сопровождающейся развитием менингеальной и очаговой симптоматики, как правило, без тяжёлых последствий.
Хронический клещевой энцефалит
По течению
Степени тяжести клещевого энцефалита
Хронический клещевой энцефалит обусловлен длительным нахождением в организме вируса клещевого энцефалита. Чаще он развивается в детском и молодом возрасте. Выделяют четыре формы:
Осложнения клещевого энцефалита
Клещевой энцефалит сам по себе является серьёзным заболеванием, которое иногда приводит к смерти человека. Однако на фоне его протекания возможны дополнительные осложнения, значительно усугубляющие прогноз:
Диагностика клещевого энцефалита
Лабораторная диагностика
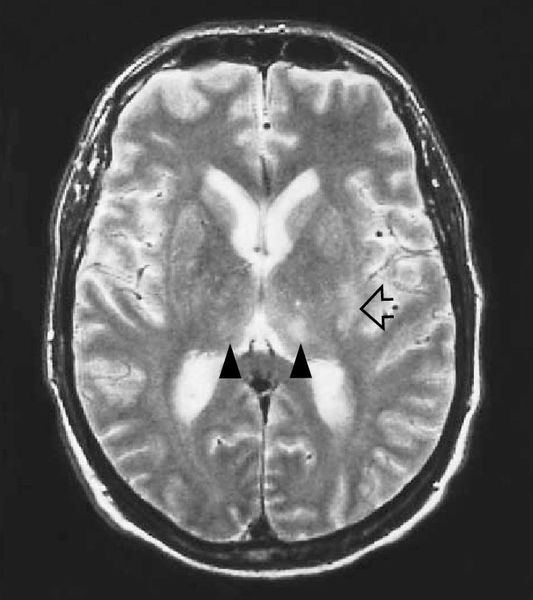
МРТ головного мозга — очаги глиоза и нейродегенерации.
Дифференциальная диагностика
Лечение клещевого энцефалита
При развитии заболевания специфического высокоэффективного этиотропного лечения не существует.
В остром периоде показан покой со строгим постельным режимом, дезинтоксикационная терапия, рациональное питание, применение витаминов, средств улучшения мозгового кровообращения, гормонотерапия. При необходимости пациента могут перевести в палату интенсивной терапии, назначить применение спазмолитических и расслабляющих препаратов.
Симптоматическая и патогенетическая терапия
В качестве мер симптоматической и патогенетической терапии в остром периоде применяют:
Иногда на практике используются средства иммунотерапии, специфические иммуноглобулины, гамма-глобулины — их применение в какой-то мере может снизить выраженность проявлений клещевого энцефалита и тяжесть отдалённых последствий, однако кардинально на исход заболевания эти препараты повлиять не могут.
Восстановительное лечение
В подострый и отдалённый период для ускорения выздоровления и восстановления нарушенных функций применяются (преимущественно в странах СНГ и РФ):
В хроническую фазу болезни возможно применение иммуностимулирующей и витаминной терапии, антигипоксантов и адаптагенов.
Прогноз. Профилактика
При инапарантных, лёгких формах заболевания прогноз, как правило, благоприятный. При развитии более серьёзных форм болезни не исключено формирование достаточно длительных, иногда пожизненных остаточных явлений, сопровождающихся астено-невротическими проявлениями, головными болями различной интенсивности, снижением умственной и физической работоспособности. При тяжёлых формах прогноз неблагоприятен.
Вакцинация против клещевого энцефалита является наиболее эффективной профилактической мерой, позволяющей предупредить развитие заболевания. Проводится с применением любой зарегистрированной вакцины от клещевого энцефалита. Как правило, выполняется сначала осенью, потом весной, затем следующей весной через год, после чего показана последующая ревакцинация раз в три года (возможно определение уровня защитных антител и коррекция графика). Такая схема даёт практически гарантированную защиту от развития болезни при заражении. Имеются экстренные схемы вакцинации, однако их эффективность ниже основных.
При укусе инфицированным клещом невакцинированного человека в России прибегают к введению иммуноглобулина, однако его эффективность и безопасность стоят под сомнением.
Экстренная вакцинация
Экстренная вакцинация проводится, если человек в прошлом не болел клещевым энцефалитом и не был вакцинирован. Назначается лицам, планирующим выезд в местность, эндемичную по клещевому энцефалиту (туристам, геологам, студентам и др.) за 1-2 месяца до выезда. Вакцину, как правило, делают дважды с интервалом в 1-2 месяца. После укуса клеща введение вакцины не рекомендуется.
Экстренная профилактика специфическим иммуноглобулином против клещевого энцефалита проводиться только в СНГ и РФ до укуса клеща (предэкспозиционная профилактика) и в течение 96 часов после укуса. Защитное действие развивается в течение суток и продолжается до одного месяца, после чего необходимо повторное вакцинирование.
Подобная профилактика имеет множество противопоказаний, например возможно развитие шокового состояния. Кроме того, она не гарантирует 100 % защиты. Во время первого триместра беременности введение иммуноглобулина противопоказано, во 2-3 триместре беременности его применение возможно по жизненным показаниям после консилиума и информированного согласия беременной о возможных рисках.
Меры неспецифической профилактики аналогичны профилактике клещевого боррелиоза:
Клещевой энцефалит: характер нордический, к людям беспощаден
Иксодовые клещи широко известны как переносчики возбудителей многих природно-очаговых инфекций, которые могут передаваться человеку при укусе. Избавиться от клещевой угрозы полностью невозможно по ряду причин, а радикально решить проблему защиты от переносимых ими инфекционных агентов пока не получается. Самым опасным из этих патогенов является вирус клещевого энцефалита: это заболевание особенно актуально для нашей страны, где распространены наиболее тяжелые формы болезни, которые в некоторых случаях заканчиваются летальным исходом. По этой причине специалисты продолжают активно изучать возбудителя болезни, что открывает потенциальные возможности создания средств ранней диагностики, профилактики и специфической терапии этой грозной инфекции, переносимой клещами.
Об авторах
Сергей Евгеньевич Ткачев — кандидат биологических наук, научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), старший научный сотрудник лаборатории экстремальной биологии Института фундаментальной медицины и биологии Казанского федерального университета. Автор и соавтор более 120 научных работ.
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, научный руководитель Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), заведующий кафедрой молекулярной биологии и биотехнологии Новосибирского государственного университета. Лауреат Государственной премии РФ (1999). Автор и соавтор более 500 научных работ и 30 патентов.
Вирусный клещевой энцефалит является заболеванием, вызывающим у человека поражение центральной нервной системы, и относится к так называемым природно-очаговым инфекциям. Это означает, что его возбудитель циркулирует в природе среди диких животных: в данном случае основным природным резервуаром вируса служат мелкие млекопитающие, в организме которых вирус может сохраняться и размножаться даже без видимых признаков болезни.
В подавляющем большинстве случаев вирусный клещевой энцефалит передается трансмиссивным (т. е. с помощью переносчика) путем. В нашей стране основными переносчиками и «хранителями» вируса являются иксодовые клещи, в первую очередь таежный и лесной: область их распространения в основном совпадает с территорией, где фиксируются случаи клещевого энцефалита. Однако описаны и альтернативные случаи заражения: через употребление некипяченого козьего и овечьего молока или молочных продуктов на их основе, а также (очень редко) через коровье молоко (Ruzek et al., 2019; Коренберг и др., 2013). Теоретически не исключена возможность и инфицирования в результате раздавливания клеща, когда вирус попадает на слизистые оболочки или поврежденную кожу.
Самка таежного клеща, самого распространенного иксодового клеща на территории России, подстерегает свою добычу. Сидя в «засаде», голодный клещ совершает колебательные движения вытянутой вперед первой парой ног, пока не войдет в контакт с жертвой. Фото В. Панова
Переносчиками вируса клещевого энцефалита являются иксодовые клещи: в первую очередь европейский лесной (Ixodes ricinus) и таежный (I. persulcatus), а также луговые клещи (род Dermacentor) и другие, более редко встречающиеся. В некоторых очагах, где ведется активная хозяйственная деятельность, в циркуляцию вируса вовлечены клещи Павловского (I. pavlovskyi) (Rar et al., 2017). Всего же спонтанная зараженность вирусом клещевого энцефалита описана для 18 видов иксодовых клещей (Коренберг и др., 2013).
Взрослая особь европейского лесного клеща — переносчика вируса клещевого энцефалита. Оптическая микроскопия. © Doc. RNDr. Josef Reischig, CSc, CC BY SA 3.0
Ареал таежного клеща почти целиком находится в пределах территории России и охватывает среднюю и южную тайгу, хвойно-широколиственные, широколиственные леса и лесостепь. Ареал европейского лесного клеща простирается почти через всю Западную и Центральную Европу; он также ограниченно встречается в Африке, Крыму и на Ближнем Востоке (Медико-географический атлас России, 2015). На значительной территории европейской части России могут одновременно встречаться оба вида клещей.
Области распространения на территории Евразии вируса клещевого энцефалита, а также его основных переносчиков — иксодовых клещей: лесного, или собачьего (Ixodes ricinus), и таежного (I. persulcatus). По: (Коренберг и др., 2013)
В РФ клещи ежегодно кусают около полумиллиона человек, из которых более 2 тыс. заболевают клещевым энцефалитом. Без своевременного лечения смертность может достигать 20–25%, при этом считается, что в любом случае у 10–20% заболевших могут возникнуть пожизненные неврологические осложнения.
Клещевой энцефалит — от легкого до летального
Течение клещевого энцефалита может протекать по-разному: от бессимптомной или легкой формы до тяжелой, вплоть до летального исхода. Инкубационный период обычно длится одну-две недели, но известны случаи как скоротечного (2–3 дня), так и «отложенного» (вплоть до 1 месяца) начала развития заболевания.

Схема жизненного цикла вируса клещевого энцефалита в зараженной клетке: Вирусные частицы связываются со специфическими рецепторами на поверхности клетки (1) и проникают внутрь в составе мембранного пузырька (эндосомы) (2). Низкий уровень pH в эндосомах запускает конформационные изменения белка E и последующее слияние вирусной оболочки с мембраной эндосомы: вирусная частица «раздевается» и ее генетический материал в виде молекулы РНК попадает в цитоплазму клетки (4). Размножение вируса происходит за счет синтеза антисмысловых (–) РНК, служащих шаблоном для синтеза геномных РНК вируса. Этот процесс идет внутри эндоплазматического ретикулума — внутриклеточного мембранного комплекса (5). Готовые нуклеокапсиды «одеваются» в белково-липидную оболочку (6), а затем созревают при прохождении через еще одну мембранную структуру клетки — аппарат Гольджи (7). Гладкие зрелые вирусные частицы выходят в цитоплазму и транспортируются к поверхности клетки, где высвобождаются во внеклеточное пространство (8). По: (Ruzek et al., 2019)
У этой инфекции обычно выделяют две стадии. Сначала идет системное распространение вируса по организму, что сопровождается лихорадкой и такими симптомами, как головная боль, усталость, боль в мышцах, тошнота и/или рвота. У «счастливчиков», у которых вирус не проникает в центральную нервную систему, дело этим и ограничивается. У остальных начинается вторая, неврологическая стадия болезни, для которой характерны нарушения сознания, вялые параличи (падение мышечного тонуса) и парезы шейно-плечевой мускулатуры.
Некоторые больные демонстрируют признаки, которые описываются как хронический клещевой энцефалит. Такая форма заболевания зарегистрирована только в России, где достигает 1–3% от всех случаев клещевого энцефалита, при том что в Европе она практически отсутствует. Очаговые поражения центральной нервной системы у таких больных наблюдаются в более поздние сроки, через недели и месяцы после снижения температуры до нормального уровня, которое обычно служит признаком выздоровления.
С помощью многофункционального органа Геллера клещи способны воспринимать изменение концентрации углекислого газа, специфические компоненты запаха потенциального хозяина и его тепловое излучение на расстоянии до 10 м. На фото — орган Геллера у нимфы европейского лесного клеща. Электронная микроскопия. © TickJD, CC BY-SA 4.0
Трансмембранный белок Е оболочки вируса клещевого энцефалита играет ключевую роль в начальных этапах инфекции, опосредуя взаимодействие с рецепторами клетки-мишени. Анализ последовательности гена E используется для выявления генетической разнородности среди штаммов вируса клещевого энцефалита. Вверху — общий вид димера выступающей части «шипа» белка Е. © Starless
Хроническая инфекция, протекающая в скрытой форме, может проявляться спустя многие месяцы и даже годы при таких обстоятельствах, как переохлаждение, травмы, тяжелый физический труд, алкогольное опьянение, аборт или роды, и даже после физиотерапии. В других случаях она проявляется как в виде непрерывно прогрессирующих очаговых поражений центральной нервной системы, что заканчивается летальным исходом.
Ранним признаком хронической инфекции служит головная боль, интенсивность которой усиливается по мере развития болезни. Продолжительность течения хронической формы болезни составляет 1–20 лет и более. При этом в 17% случаев болезнь приводит к смерти.
Как правило, хроническая инфекция возникает после заражения пациентов дальневосточным и, как считается, особенно сибирским субтипами вируса (Погодина, 2005). При этом сравнение коллекционных штаммов вируса клещевого энцефалита, выделенных от больных с острой и хронической формой болезни, не выявило каких-то однозначных различий в их геномах (Gritsun et al., 2003; Погодина и др., 2004; Соболев и др., 2010).
По соседству с клещами
Мелкие млекопитающие — грызуны и в меньшей степени насекомоядные — служат основными прокормителями для «молоди» иксодовых клещей, личинок и нимф. Они же являются и резервуарными хозяевами для вируса клещевого энцефалита.
Другие дикие млекопитающие, в том числе парнокопытные (косули, олени, лоси, кабаны), лисы и зайцы, дают «стол и кров» как нимфам, так и взрослым клещам. На некоторых особях находят огромное количество клещей, в том числе и зараженных вирусом клещевого энцефалита, а в крови — специфические антитела.
Ряд видов иксодовых клещей нападает и на птиц; более того, мигрирующие птицы могут переносить клещей на большие расстояния. В крови птиц, пораженных клещами, обнаруживают как сам вирус, так и антитела против него. Похоже, что во время своих миграций птицы обеспечивают «пошаговую» (через стоянки) передачу инфицированных клещей, что приводит к образованию локальных очагов инфекции.
При этом важно отметить, что у всех этих диких млекопитающих и птиц не было описано ни одного достоверного случая клинических проявлений клещевого энцефалита.
Знакомьтесь: ВКЭ
А теперь пришла пора поближе познакомиться с нашим главным героем — вирусом клещевого энцефалита (ВКЭ). Несмотря на миф о том, что вирус клещевого энцефалита возник недавно и чуть ли не в секретных военных лабораториях, как и возбудитель клещевого боррелиоза (Власов, 2020), с помощью сначала молекулярно-биологических, а потом и биоинформатических методов удалось показать, что возраст предковых вариантов этого возбудителя насчитывает тысячи лет (Grard et al., 2007; Tkachev et al., 2019).
Вирионы вируса клещевого энцефалита имеют форму сферы с диаметром около 40–60 нм. Внутри частицы находится нуклеокапсид в виде двадцатигранника, представляющий собой комплекс белка C с одноцепочечной РНК, окруженной белково-липидной оболочкой (Knipe, Howley, 2013). В состав оболочки, помимо липидной мембраны, входят белки М и гликопротеины Е, закрепленные в мембране с помощью гидрофобных участков-«якорей». Слева — реконструкция поверхности зрелой вирусной частицы ВКЭ. С сайта NCBI. Вверху — ВКЭ после инкубации при pH = 8,0. Электронная микроскопия. По: (Stiasny et al., 2007) © CC BY 2.5
Уже в записях приходских книг XVIII в. с Аландских островов (Финляндия) имеются описания заболевания, по симптомам очень похожего на клещевой энцефалит (Kunz, Heinz, 2003). Однако вопрос о природе возбудителя этой болезни оставался без ответа до первой половины прошлого века, и пальма первенства в его изучении принадлежит российским ученым.
Вирус клещевого энцефалита был открыт в 1937 г. на Дальнем Востоке экспедицией Наркомздрава СССР под руководством известного вирусолога Л. А. Зильбера, направленной в район эпидемии неизвестной болезни. Специалисты определили ее переносчиков, выделили несколько штаммов возбудителя и получили к нему антитела. А спустя полвека благодаря новым технологиям секвенирования нуклеиновых кислот и исследования белков удалось выяснить, как устроен вирус, и разработать эффективные средства его обнаружения. Что касается расшифровки вирусного генома, то это было сделано специалистами из Сибирского отделения АН СССР и их австрийскими коллегами (Плетнев и др., 1989, Mandl et al., 1989; Pletnev et al., 1990).
Различают две формы вирионов: незрелую и зрелую. В гликопротеидные шипы незрелой формы входит предшественник белка M — белок prM и M, который протеолитически расщепляется в процессе созревания вирионов. По: (Füzik et al., 2018)
Возбудитель клещевого энцефалита относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), куда входят и такие известные патогены, как вирус желтой лихорадки, японского энцефалита, лихорадки Денге, гепатита C и др.
Вирионы вируса клещевого энцефалита представляют собой сферические частицы диаметром 50 нм. Их «сердцевина», где скрывается наследственный материал вируса — одноцепочечная РНК, окружена белково-липидной оболочкой. Различают две формы вирионов: незрелую и зрелую, которые отличаются между собой одним из белков, входящих в оболочку. Как у всех флавивирусов, процесс внутриклеточного развития вируса клещевого энцефалита протекает в цитоплазме зараженных клеток, с участием вирусных и клеточных ферментов.
Сибиряки — первые на финише
В 1987 г. М. А. Грачев принял приглашение академика В. А. Коптюга возглавить Лимнологический институт — ведущий по проблемам оз. Байкал. Февраль 1989 г. Фото В. Короткоручко
В Сибирском отделении Академии наук работы по изучению вируса клещевого энцефалита молекулярно-биологическими методами, включая проект по расшифровке генома, были инициированы М. А. Грачевым, будущим академиком, который в 1984–1987 гг. заведовал лабораторией в Новосибирском институте биоорганической химии СО АН СССР (ныне Институт химической биологии и фундаментальной медицины СО РАН).
Основная работа велась в НИБОХ, где группа сотрудников лаборатории Грачева под руководством А. Г. Плетнева освоила методы секвенирования. Наработка материала для исследований (самого вируса и ДНК-копий вирусного генома) велась в Институте полиомиелита и вирусных энцефалитов АМН СССР (ныне Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М. П. Чумакова РАН). Структуру вирусных белков удалось исследовать с помощью технологий, разработанных в московском Институте биоорганической химии и СКБ аналитического приборостроения АН СССР.
В результате исследователям удалось в сжатые сроки расшифровать геном вируса клещевого энцефалита, опередив конкурентов — австрийских ученых, работавших над аналогичным проектом. В ходе пионерских исследований ученым пришлось преодолеть немало трудностей. В частности, один из участников работы, Е. К. Прессман, занимавшийся выделением вирусных частиц, заболел клещевым энцефалитом, к счастью, не в самой тяжелой форме.
Расшифровка генома вируса клещевого энцефалита стала первым успешным российским проектом по установлению строения вирусных геномов. Один из его важных практических результатов — создание быстрого метода обнаружения вируса с помощью гибридизации нуклеиновых кислот с радиоактивными ДНК-зондами.
Кто и где живет
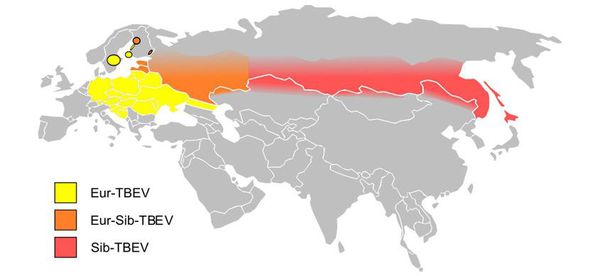
На сегодняшний день официально выделяют три субтипа вируса: европейский, сибирский и дальневосточный. Эти названия условны и связаны с регионом, где были первоначально выделены штаммы-прототипы, и в одном и том же регионе могут обнаруживаться штаммы, относящиеся к разным субтипам.
Европейский субтип вируса клещевого энцефалита встречается преимущественно на территории Западной и Восточной Европы, а также европейской части России. Однако его ареал шире и простирается от Франции и Нидерландов на западе до Южной Кореи на востоке. При этом, хотя в Прибалтике к этому субтипу относится более 80% выявленных штаммов, остальные являются «сибиряками» (Dobler, Tkachev, 2019).
В Западной и Восточной Сибири описаны единичные штаммы и изоляты европейского субтипа вируса, немного отличающиеся от исходного варианта, как и упоминавшиеся выше южнокорейские «европейцы» (Demina et al., 2017; Rar et al., 2017; Kim et al., 2008). Все эти штаммы тем не менее демонстрируют высокое сходство с протипом из Европы, что кажется удивительным, так как их разделяет расстояние свыше 4 тыс. км, а в промежуточных регионах (в частности, на Урале) европейский субтип вируса не был обнаружен. Одна из возможных причин возникновения этих вирусных очагов в Сибири и на Дальнем Востоке — сезонная миграция птиц, переносящих на себе зараженных клещей, а также преднамеренная интродукция тех или иных животных, которые могли быть переносчиками.
В наши дни вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии, от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия его ареал неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. К примеру, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для мелких млекопитающих и, соответственно, связанных с ними клещей.
Родословные связи европейского субтипа вируса, оцененные на основе результатов разных исследований, неясны и запутанны. Есть предположение, что, хотя он отделился от предковой формы и мигрировал на запад довольно давно, все известные в настоящее время центральноевропейские штаммы сформировались всего около 300–400 лет назад (!). Похоже, что на территории Европы прошло несколько миграционных волн распространения этого возбудителя, и анализ генетических последовательностей разных штаммов демонстрирует своего рода географическую кластеризацию разных вариантов, хотя это правило работает не всегда. Возможно, причиной этого были изменения в составе отдельных популяций и экосистем в целом.
Геном вируса клещевого энцефалита представляет собой линейную молекулу РНК длиной 10,5–11 тыс. нуклеотидов, с короткими некодирующими областями на концах. Кодирующая область содержит гены структурных белков, входящих в состав самих вирусных частиц, а также белков, необходимых для размножения вируса в клетках хозяина. Кодирующая область имеет одну открытую рамку считывания, т. е. в цитоплазме зараженной клетки она считывается целиком и служит матрицей для синтеза одного протяженного полипротеина (Knipe, Howley, 2013). Затем эта большая белковая молекула расщепляется вирусными и клеточными ферментами-протеазами на три структурных и семь неструктурных вирусных белков
Но главное, обычному человеку (не генетику) надо знать, что европейский субтип вируса клещевого энцефалита, как упоминалось выше, не вызывает хронических форм заболевания. Течение болезни в этом случае имеет типичный двухфазный характер, а уровень смертности не превышает 1–2%. При этом риск летального исхода наиболее высок у пожилых пациентов, а причиной смерти нередко становится присоединившаяся бактериальная суперинфекция или неврологические поражения, такие как паралич дыхательных мышц.
Генетические данные, полученные за последнее десятилетие, позволили реконструировать историю распространения вируса на территории Евразии. Предполагается, что он отделился от других флавивирусов около 30 тыс. лет назад в Центральной Африке. Оттуда эта предковая форма с помощью переносчиков-клещей мигрировала на восток и проникла в Центральную Сибирь около 7,5 тыс. лет назад, где впоследствии разделилась на западную и восточную ветви.
В рамках восточной ветви примерно за 3 тыс. лет сформировались сибирский и дальневосточный подтипы, а также, вероятно, два новых: байкальский и 178–79. Представители западной ветви распространились в Центральной Европе и далее на Британских островах. «Попутно» от них отделились близкородственные вирусы испанского энцефалита овец (на Пиренейском полуострове) и шотландского энцефаломиелита овец (Heinze et al., 2012; Tkachev et al., 2020).
Сибиряки и дальневосточники
Дальневосточный субтип вируса клещевого энцефалита преимущественно обнаруживается на территории соответствующей части Евразии, однако известны его находки в других регионах, включая Прибалтику, Крым, Беларусь, европейскую часть РФ, а также Урал и Сибирь. На некоторых территориях этот возбудитель чаще встречается в городских и пригородных районах. Дальневосточный субтип вируса, считающийся одним из самых патогенных, может вызывать различные формы заболевания: от субклинических до острых, в том числе летальных (Tkachev et al., 2008; Leonova et al., 2013).
Внутри субтипа выделяется как минимум четыре генетические линии. Штаммы одной из них аналогичны штамму Софьин, который был выделен в Хабаровском крае из мозга пациента еще в 1937 г. (Зильбер, 1939). Сегодня эта линия включает в себя штаммы с Дальнего Востока России, из Японии, Китая, Латвии и европейской части России. Штаммы из остальных линий были выделены на территории Японии, в том числе на о. Хоккайдо, Китая и Крымского полуострова.
Внутри этой группы есть уникальные и к тому же более опасные варианты. Так, в 1999 г. на юго-востоке Новосибирской области (Западная Сибирь) были зарегистрированы случаи геморрагических форм клещевого энцефалита с летальными исходами (Ternovoi et al., 1999). Ранее они не встречались, хотя известно, что другие флавивирусы, переносимые клещами, например вирус омской геморрагической лихорадки, могут вызывать такой синдром, связанный с повышенной кровоточивостью слизистых оболочек.
«Расшифровка» фрагмента гена, кодирующего гликопротеин Е вирусной оболочки, указала на то, что этот высокопатогенный вирус относится к дальневосточному субтипу, но ряд обнаруженных в нем мутаций ранее не был описан. Появление такого атипичного вируса может свидетельствовать о продолжающейся эволюции этой группы флавивирусов.
Есть и другой пример. В 2004 г. в Приморском крае из мозга умершего от клещевого энцефалита был выделен штамм Глубинное/2004. Оказалось, что он хоть и относится к дальневосточному субтипу вируса, но имеет более полусотни замен в аминокислотной последовательности белка Е по сравнению с известными дальневосточными штаммами, причем 14 из них являются уникальными (Сафронов и др., 1991; Goto et al., 2002; Ternovoi et al., 2007). Кроме того, на ранних стадиях инфекции в клеточных культурах этот штамм продуцирует больше вирусных частиц.
Самым распространенным субтипом является сибирский: его обнаруживают почти повсеместно по всему ареалу вируса клещевого энцефалита. Считается, что он вызывает более легкие формы клещевого энцефалита по сравнению с дальневосточным. Однако по сравнению с европейским субтипом заражение им чаще приводит к развитию хронических форм болезни, сопровождающихся неврологическими и/или нейропсихиатрическими симптомами.
Сибирский субтип является наиболее разнородным, с уровнем сходства нуклеотидных последовательностей кодирующей части генома внутри субтипа от 88% и выше. До недавнего времени внутри субтипа выделяли три генетические линии, но исследования последних лет позволили выделить еще две: Обскую и Боснийскую. При этом оказалось, что Обская линия является наиболее древней среди всех «сибиряков»: ее предки появились около 4 тыс. лет назад (Tkachev et al., 2017, 2020).
Области распространения различных генетических линий сибирского субтипа вируса клещевого энцефалита. Места находок отмечены значками
Все генетические линии сибирского субтипа имеют различное географическое распределение в Евразии. Наиболее высокое генетическое разнообразие характерно для южной части Западной Сибири: здесь не встречаются только штаммы, принадлежащие Боснийской линии. Вероятно, именно этим можно частично объяснить высокий показатель распространенности клещевого энцефалита в этом регионе.
В последние годы были выделены еще три потенциальных субтипа вируса. Один из них — байкальский — включает группу изолятов и штаммов, обнаруженных в Бурятии, Иркутской и Читинской областях Восточной Сибири и на севере Монголии (Demina et al., 2010; Kozlova et al., 2018). На эволюционном древе эта группа штаммов образует независимый кластер, а по своей генетической структуре они существенно отличаются от других субтипов.
Исследования показали, что эти штаммы обладают высокой вирулентностью и термостабильностью. В 2010 г. в Монголии умер пациент с менингоэнцефалитом, вызванным штаммом предположительно байкальского субтипа. Пациент был госпитализирован на 11-й день после укуса клеща и умер в тот же день. В мозге погибшего были обнаружены повреждения, типичные для наиболее тяжелых форм острого клещевого энцефалита (Хаснатинов и др., 2010). Единичный изолят этого субтипа был обнаружен и в Западной Сибири в клещах Павловского (Rar et al., 2017).
Еще два потенциальных субтипа — 178–79 из Восточной Сибири и гималайский с плато Цинхай-Тибет в Китае — по своей генетической последовательности отличаются от всех других субтипов на 10–18% (Demina et al., 2010 Dai et al., 2018). Но они представлены единичными находками, так что вопрос об их статусе остается открытым.
Осторожно: непастеризованное молоко!
Клещевой энцефалит долгое время связывали исключительно с домашними жвачными животными (крупным рогатым скотом, козами и овцами) из-за того, что вирус мог передаваться через молоко и другие продукты из непастеризованного молока.
После заражения у этих животных не развиваются клинические симптомы, однако в крови обнаруживается вирус в период до 19 дней. Так, в одном из регионов Польши вирус клещевого энцефалита был найден в молоке овец (22%), коз (15%) и коров (11%) (Dobler et al., 2019). Потребление таких продуктов может привести к заражению целых групп населения, что периодически и наблюдается в странах Восточной Европы, Германии и России. К тому же тенденция к потреблению натуральных продуктов без термической обработки в последние годы растет.
Первый лабораторно подтвержденный случай клещевого энцефалита у лошадей был описан более чем 35 лет назад. С тех пор появились единичные публикации, в которых у лошадей в Швейцарии, Австрии и Германии описаны клинические признаки неврологического расстройства, предположительно вызванные вирусом клещевого энцефалита. А серологические исследования в Австрии показали, что около четверти всех лошадей имеют соответствующие антитела.
Диагностика и профилактика
Главная опасность клещевого энцефалита заключается в том, что для него не существует специфического лечения. Терапия, как и при любых других вирусных заболеваниях, направлена на борьбу с внешними проявлениями болезни и активацию противовирусного иммунитета, а дальше организм должен сам справляться с инфекцией. Вирус опасен и тем, что может вызывать развитие хронической формы болезни, последствием которой могут быть параличи и инвалидность. По этой причине важнейшим делом является разработка методов диагностики и профилактики этого заболевания.
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител — специфических защитных белков, или вирусных частиц, а также молекулярно-биологические, основанные преимущественно на методе полимеразной цепной реакции (ПЦР), позволяющей диагностировать даже ничтожные количества патогена.
Наиболее эффективными мерами профилактики при посещении районов, где велика встреча с зараженными клещами, служит, во-первых, комплекс защитных мер по предотвращению укусов клещей, включая защитную одежду и химические препараты, отпугивающие (репелленты) либо убивающие (акарициды) этих членистоногих. Во-вторых, вакцинация, которая на сегодняшний день является единственным действенным методом против клещевого энцефалита.
Так, среди пациентов с клещевым энцефалитом, поступивших в эпидемиологический сезон 2017–2018 гг. в Городскую инфекционную клиническую больницу № 1 (Новосибирск), все больные с тяжелой формой течения болезни оказались невакцинированными.
Первая вакцина против клещевого энцефалита была разработана в СССР и представляла собой инактивированную формальдегидом суспензию мозгов мышей, зараженных вирусом штамма Софьин. В 1939 г. ее клинические испытания были успешно завешены. С 1958 г. модифицированный вариант этой вакцины стали применять во всех регионах, где встречался клещевой энцефалит. К концу 1980-х гг. была создана вакцина на основе инактивированного высокоочищенного концентрированного вируса, наработанного на клеточных культурах. Сейчас в РФ производятся три вакцины, в том числе варианты для детей, начиная с раннего возраста.
Все российские вакцины, созданные на основе высокопатогенного дальневосточного субтипа возбудителя, надежно защищают от заражения либо способствуют более легкому течению болезни. Две европейские вакцины, которые производятся в Австрии и Германии, изготавливаются на основе инактивированного вируса европейского субтипа, который вызывает болезнь, обычно протекающую в мягкой форме.
В случае укуса зараженного клеща для экстренной профилактики невакцинированного пациента используют препараты противоклещевого иммуноглобулина, которые представляют собой концентрированный раствор очищенной фракции иммунных белков (антител), выделенных из плазмы или сыворотки крови доноров, имеющих иммунитет к этому заболеванию. Считается, что его введение в первые три дня после присасывания клеща снижает вероятность развития инфекции.
Однако этот метод, с одной стороны, намного менее эффективен по сравнению с вакцинацией. С другой стороны, существует риск негативных побочных эффектов от введения препарата, получаемого из донорской крови. Так, в странах Европейского союза уже отказались от использования противоклещевого иммуноглобулина из-за возможного развития так называемого антителозависимого усиления инфекции — этот феномен еще требует дальнейшего изучения (Ruzek et al., 2019).
Однако в нашей стране использование противоклещевого иммуноглобулина оправданно, так как в Сибири и на Дальнем Востоке распространены самые опасные штаммы возбудителя. Но есть и хорошая новость: отказаться от использования компонентов донорской крови человека или животных позволяет разработка новосибирского Института химической биологии и фундаментальной медицины СО РАН.
Ученые встроили фрагмент антитела мыши, прочно связывающий вирусную частицу, в антитело человека, получив в результате белок, эффективно нейтрализующий патоген. Такие гибридные антитела можно производить с помощью стандартных биотехнологических методов. Доклинические испытания нового биотехнологического препарата успешно закончены: чистые «антитела» благополучно защитили зараженных лабораторных мышей от вирусов клещевого энцефалита, принадлежащих к дальневосточному, сибирскому и европейскому субтипам. Так что есть шанс, что уже в ближайшем будущем заболевание клещевым энцефалитом станет не таким опасным для жизни.
Несмотря на то что исследования клещевого энцефалита проводятся уже много десятилетий, заболеваемость им в ряде регионов, в частности в Сибирском, остается по-прежнему одной из самой высоких на территории России. Клещевой энцефалит и сегодня является в нашей стране одной из наиболее социально значимых природно-очаговых вирусных инфекций, учитывая, что именно у нас распространены особо патогенные штаммы вируса.
Исследования последних лет выявили новые генетические варианты вируса, которые вызывают тяжелые формы заболевания у человека и могут не выявляться современными диагностическими тест-системами. По этой причине крайне важно продолжать исследования генетического разнообразия возбудителей, чтобы улучшать существующие и разрабатывать новые системы диагностики, позволяющие выявлять широкий спектр генетических модификаций вируса. Кроме того, обнаружение участков в вирусном геноме, ответственных за патогенные свойства, может позволить в будущем создавать диагностические средства для прогнозирования тяжести заболевания у человека, который подвергся укусу зараженного клеща.
На основе результатов генетических исследований вируса клещевого энцефалита уже сейчас можно проводить мониторинговые исследования, чтобы выявлять территории с высоким риском заражения людей и заранее оценивать тяжесть заболевания на тех или иных территориях.
Кроме того, на сегодня единственным надежным способом предотвращения клещевого энцефалита является вакцинация. При этом в настоящее время все чаще поднимается вопрос, насколько штаммы, на основе которых создаются все современные вакцины против вирусов, соответствуют реальным генетическим вариантам возбудителей. И только регулярный генетический мониторинг способен на него ответить, что сегодня наглядно демонстрирует ситуация с новым коронавирусом.
Собаки тоже болеют
Собаки часто инфицируются вирусом клещевого энцефалита. К примеру, доля собак, в крови которых циркулируют антитела против клещевого энцефалита, в Германии и Финляндии достигает 40% и выше (Dobler et al., 2019). Основным переносчиком в этом случае считают лугового клеща.
Чаще всего собаки заражаются клещевым энцефалитом в результате укуса лугового клеща (Dermacentor reticulatus). На фото — самец лугового клеща. Польша. © Krzysztof Ziarnek, Kenraiz, CC BY-SA
При этом у большинства собак выраженные клинические признаки болезни не развиваются. Однако если они все же появляются, то в 16–50% случаев наблюдается летальный исход уже в течение первой недели болезни. Чаще всего встречается острая форма, заканчивающаяся полной ремиссией за одну-две недели; реже — длительное течение болезни: такие животные потом часто страдают от пареза, атрофии мышц, эпилептических припадков или слепоты.
Клещевой энцефалит описан в основном у взрослых собак средних и крупных пород, таких как ротвейлеры и хаски, но нет данных, которые позволяли бы заранее оценить предрасположенность животного к этой инфекции. Специфического метода лечения клещевого энцефалита у собак также не существует, как и лицензированной профилактической вакцины. Но известно, что в ответ на введение «человеческой» вакцины у них вырабатываются специфические антитела.
Важной профилактической мерой служит защита собак от иксодовых клещей (которые, также служат переносчиками опасных для этих животных возбудителей клещевого боррелиоза и, особенно, пироплазмоза), заключающаяся в основном в регулярной акарицидной обработке и немедленном удалении всех обнаруженных клещей.
Литература
1. Вотяков В. И., Злобин В. И., Мишаева Н. П. Клещевые энцефалиты Евразии (вопросы экологии, молекулярной эпидемиологии, нозологии, эволюции). Новосибирск: Наука, 2002. 438 с.
2. Зильбер Л. Весенний (весенне-летний) эпидемический клещевой энцефалит // Архив биол. наук. 1939. Т. 56(2).
3. Злобин В. И., Беликов С. И., Джиоев Ю. П. и др. Молекулярная эпидемиология клещевого энцефалита. Иркутск: РИО ВСНЦ СО РАМН, 2003. 272 с.
4. Иерусалимский А. П. Клещевой энцефалит. Руководство для врачей. Новосибирск, 2001. 258 с.
5. Коренберг Э. И., Помелова В. Г., Осин Н. С. Природноочаговые инфекции, передающиеся иксодовыми клещами. М.: ООО «Комментарий», 2013. 464 с.
6. Погодина В. В., Фролова М. П., Ерман Б. А. Хронический клещевой энцефалит. Этиология, иммунология, патогенез. Новосибирск: Наука, 1986. 231 с.
7. Сомова Л. М., Фролова М. П., Погодина В. В. и др. Патология нейроинфекций, вызываемых вирусами комплекса клещевого энцефалита: монография-атлас. М.: ООО «СИНТЕРИЯ», 2018. 360 с.
8. Якименко В. В., Малькова М. Г., Тюлбко Ж. С. и др. Трансмиссивные вирусные инфекции Западной Сибири (региональные аспекты эпидемиологии, экологии возбудителей и вопросы микроэволюции). Омск: Издательский центр «КАН», 2019. 312 с.
9. Dobler G., Erber W., Bröker M., Schmitt H. J., eds. The TBE Book. 2nd ed. Singapore: Global Health Press, 2019. DOI: 10.33442/978-981-14-0914-1_11.