Чем опасен нейротоксин для человека
Нейротоксичность лекарств
Полный текст:
Аннотация
Ключевые слова
##article.ConflictsofInterestDisclosure##:
##article.articleInfo##:
Депонировано (дата): 16.05.2018
##article.reviewInfo##:
##article.editorialComment##:
Для цитирования:
Постников С.С., Костылева М.Н., Грацианская А.Н., Ермилин А.Е., Строк А.Б., Шатунов С.М. Нейротоксичность лекарств. Качественная Клиническая Практика. 2017;(4):68-72. https://doi.org/ 10.24411/2588-0519-2017-00032
For citation:
Postnikov S.S., Kostyleva M.N., Gratsianskaya A.N., Ermilin A.E., Strok A.B., Shatunov S.M. Neurotoxicity of drugs. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2017;(4):68-72. (In Russ.) https://doi.org/ 10.24411/2588-0519-2017-00032
Введение
История изучения нейротоксичности лекарственных средств (ЛС) началась в ранние 90-е годы XX века, когда Turner описал побочный эффект бромидов в виде седации, снижения когнитивности и аффективных проявлений.
С тех пор внимание к этой проблеме только усилилось, во-первых, ввиду её важности, а, во-вторых, в связи с колоссальным ростом лекарственного рынка и многочисленности лекарственных средств, у которых был отмечен нейротоксический эффект — антибиотики, глюкокортикостероиды, противовирусные средства, статины, антипсихотики, антиконвульсанты, анестетики [1—4].
Общей встречаемости нейротоксичности лекарств, вероятно, быть не может ввиду огромного разрыва между описанием отдельных случаев, например, от генерализованных судорог при передозировке лидокаина [5], до значительной частоты депрессивных расстройств (40%) и суицидальных мыслей (47%) у антиконвульсантов [6]. Мешает общей статистике и разнообразие проявлений нейротоксичности лекарственных средств: изменение вкуса, поражение зрительного нерва, делирий, психотические реакции и достаточно высокий уровень смертности (12—26%) от неврологических осложнений пациентов после трансплантации костного мозга, большая часть которых (64,7%) вызвана кровоизлияниями или ишемией мозга [7, 8].
Предрасполагающие факторы
Прежде всего это способность лекарственных средств проникать и накапливаться в ЦНС, определяемое состоянием гемато-энцефалического барьера (ГЭБ), в частности, экспрессией (генетическим полиморфизмом) транспортёра органических анионов (ОАТ 1,3 и 1А2); липофильностью препарата (соотношением концентрации СМЖ:плазма) и эффективностью работы эвакуаторных систем ЦНС. Последних несколько: Р-гликопротеин; белок, определяющий резистентность к раку груди (BCRP) и протеин-2, связанный с множественной лекарственной устойчивостью (MRP-2).
Усиливает вероятность нейротоксичности лекарственных средств почечная и (или) печёночная недостаточность с нарушением элиминации, отягощённый анамнез по нейропсихическим заболеваниям и фоновые структурные аномалии головного мозга. При этом особо отмечается склероз гиппокампа. Кроме того, поскольку влияние лекарственных средств на мозг может начаться ещё антенатально и продолжиться в период кормления грудью, то будут иметь значение такие фармакокинетические характеристики лекарственных препаратов, как их способность пересекать плаценту, а в последующем накапливаться в грудном молоке.
Но, главным предрасполагающим фактором нейротоксичности лекарственных средств у детей является их незрелый, но интенсивно развивающийся мозг, с наиболее ранимым периодом — от 6 мес гестации до первых нескольких лет постнатальной жизни [9].
Рассмотрим, прежде всего, нейротоксические последствия применения тех лекарственных средств, которые и предназначены для воздействия на ЦНС — антиконвульсанты и анестетики.
Антиконвульсанты (АК)
Несмотря на длительную историю применения фенобарбитала (>100 лет), фенитоина (>75 лет) и газовых анестетиков — галотан, изофлюран (>50 лет), их влияние на развитие мозга всё ещё плохо изучено. По этой причине применение этих и других нейроактивных лекарственных веществ во время беременности и в младенчестве является одной из острых проблем неонатологии, неврологии и клинической фармакологии [10].
Это особенно актуально с учётом роста за последние 10 лет числа беременных женщин, больных эпилепсией, и увеличения количества АК. Только в США ежегодно рожают детей более 30 000 больных эпилепсией женщин. При этом надо учесть и то, что АК применяются у беременных для лечения не только эпилепсии, но и других заболеваний — нейропатической боли, мигрени, биполярных психических расстройств [11].
Все АК тератогенны в той или иной степени. Однако их тератогенность связывается, прежде всего, с большими (старыми) препаратами (фенобарбитал, фенитоин, карбамазепин и, особенно, вальпроаты), значительно сокращаясь или вовсе убывая у более новых АК — леветирацетам, ламотриджин, топирамат [12].
В целом частота пороков развития (включая ЦНС) у детей, рождённых от матерей, принимавших АК, составляет примерно 4—6% против 2—4% у не принимавших эти препараты.
Хотелось бы отметить при этом, что принятое в литературе посиндромное деление пороков в привязке к какому-нибудь антиконвульсанту (фенитоиновый, фенобарбиталовый, карбамазепиновый и т.п. синдромы) нам кажется (как и Schmidt D., 1992 г.) не вполне оправданным ввиду недостаточной их специфичности. Во всех случаях это набор одних и тех же (в разных сочетаниях) стигм дисэмбриогенеза и поэтому более уместным мы бы считали название «фетальный антиконвульсантный синдром» [13].
Риск тератогенности АК (категория D по классификации FDA), помимо упомянутых в начале статьи факторов, во многом определяется особенностями фармакокинетики лекарственных средств у беременной и плода. И здесь надо выделить фетонегативные и фетопротективные факторы (табл. 1).
В условиях приёма беременной лекарственных средств плацента является элиминирующим органом, а плод становится невольным восприемником, объектом лечения, но его развивающийся мозг мало приспособлен для противодействия лекарственным препаратам.
Но существуют у беременной и внутриутробного ребёнка также контрнегативные, фетопротективные механизмы по отношению к принимаемым лекарственным средствам и их немало.
Допустимо, что названные фетопротективные механизмы и умелые действия врача в состоянии в большинстве случаев предотвратить или ослабить тератогенное действие АК. Предполагается также существование генотипа, особо чувствительного к тератогенному влиянию АК [15]. Так, по данным [11], только 6% беременных женщин с эпилепсией, лечившихся несколькими АК, рожают детей с большими пороками (включая микроцефалию и дефект нервной трубки) и 3,7% женщин, получавших монотерапию. Помимо оказания тератогенного эффекта у фенобарбитала, были описаны также отдельные случаи абстинентного синдрома у новорождённых. Неонатальный синдром отмены, кроме того, встречался у новорождённых, чьи матери во время беременности принимали антидепрессанты циталопрам или флуоксетин — селективные ингибиторы обратного захвата серотонина (СИОЗС).
Однако не все изменения очевидны при рождении и в этом смысле представляет интерес катамнез детей в возрасте 3 и 4,5 лет, подвергшихся внутриутробно воздействию АК и не имевших при рождении больших пороков. И тут мнения, как это часто бывает, разделились.
По данным, приводимым Gedzelman E. [15], монотерапия фенобарбиталом, фенитоином, карбамазепином, ламотриджином, леветирацетамом не влекла за собой существенных изменений IQ. Более низкие показатели IQ (в том числе снижение оперативной памяти) были выявлены у вальпроатов и имели дозозависимый характер. Эти дети нуждались в дополнительном обучении.
Однако в цитируемых Nie Q. [11] результатах отсроченных исследований говорится о том, что все АК (кроме карбамазепина) влияют на интеллектуальные способности детей, а Turski C. [16] не делает исключения и для карбамазепина.
Понятным образом когнитивные способности (поведенческий тератогенез) выглядели хуже у детей после политерапии АК беременных.
Ведущая гипотеза объясняет эти нарушения возникающим под влиянием АК апоптоза нейронов и дисфункцией выживших нейроклеток [15]. Подтверждение этой гипотезе было найдено при проведении МРТ головного мозга у молодых взрослых, подвергшихся пренатально воздействию АК. Были выявлены минимальные морфологические изменения в сером веществе (в сравнении с контрольной группой здоровых того же возраста) в базальных ганглиях и гипоталамусе [16].
Представляет интерес и такой отсроченный эффект АК (фенитоина), также связанный с нервной системой (на этот раз периферической), как развитие нейробластомы у детей с признаками гидантоинового синдрома [17].
Лактация и АК, психотропные препараты (антидепрессанты, антипсихотики). Практически все АК в той или иной степени проникают в грудное молоко, если кормящая мать постоянно их принимает. Однако выраженная нейротоксичность связывается только с барбитуратами и проявляется седативным эффектом: повышенная сонливость, вялое сосание, мышечная гипотония, плохая прибавка в массе тела. Рекомендуемый в таких случаях отказ от грудного вскармливания может сопровождаться развитием у ребёнка абстинентного синдрома: резкая возбудимость, бессонница, тремор, постоянный крик [12].
Антидепрессанты
1. Селективные ингибиторы обратного захвата серотонина (СИОЗС). Препаратом первого выбора рекомендуют пароксетин или сертралин, создающий низкие концентрации в грудном молоке и сыворотке ребёнка и ассоциирующиеся с минимальным количеством побочных эффектов — повышенная раздражительность, беспокойство, нарушение сна. Флуоксетин не рассматривается в качестве препарата выбора при лактации из-за длительного периода полувыведения (особенно активного метаболита) и способности накапливаться в крови новорождённого с угрозой развития тяжёлых неврологических осложнений (кома у ребенка, мать которого принимала препарат во время беременности и в период кормления грудью).
2. Трициклические антидепрессанты (ТЦА). В группе ТЦА наиболее изученными и безопасными препаратами считаются нортриптилин и имипрамин, создающие ничтожные концентрации в крови грудного ребёнка. Кормящей грудью женщине не рекомендуется принимать доксепин из-за наличия у него метаболита длительного действия и способного вызвать у ребёнка выраженный седативный эффект и угнетение дыхания.
Антипсихотики
2) Атипичные антипсихотики. Рисперидон (из-за повышенного риска экстрапирамидных расстройств), а клозапин (из-за способности накапливаться в грудном молоке при длительном приёме и вызывать повышенную сонливость, отставание в речевом развитии и даже судороги) не рекомендуется женщинам в период кормления грудью.
Сведения об оланзапине противоречивы, хотя считается, что риск от его применения в период лактации может превышать пользу.
Достаточно безопасным считается кветиапин (в монотерапии), создающий низкие концентрации в молоке и соответственно в крови ребёнка, что и обуславливает его хорошую переносимость [13].
Анестетики
При проведении общего обезболивания роженицы в случае патологических родов у новорождённого может развиться синдром угнетения ЦНС («анестезированный ребёнок»). При использовании в/в препаратов для обезболивания (пропофол, кетамин) их элиминация зависит от биотрансформации в печени и экскреции через почки. Поскольку обе функции у новорождённых (особенно недоношенных) не полностью развиты, то время, требуемое для выведения этих анестетиков (и соответственно выхода из состояния анестезии) может быть более длительным, чем в случае применения ингаляционных средств — закись азота, севофлуран, галотан [14].
Вместе с тем однократное и непродолжительное (менее часа) воздействие как в/в, так и ингаляционных анестетиков, скорее всего, не способны вызвать серьёзных нейротоксических последствий.
Однако FDA предупреждает, что седация или общее обезболивание, длящееся более 3 ч или осуществляемое многократно в критический период развития мозга (последний триместр беременности и первые три года постнатального периода) ассоциировано в последующем с нарушением когнитивных функций (долговременная память, обучаемость) у ребёнка, что обусловлено гибелью нейроклеток [18].
Поскольку нейрогенез в отдельных областях моз- га продолжается всю жизнь, то с окончанием критического периода в развитии мозга не заканчивается негативное влияние на него лекарственных средств. Так, по данным [19], клиническая картина злоупотребления психоактивными веществами у детей школьного возраста в 76,2% случаев характеризуется снижением интеллектуально-мнестических функций. Более широким спектром нейропсихических нарушений обладают антиконвульсанты и здесь выделяется фенобарбитал. Подавляя эпилептиформную активность, АК воздействуют также на области мозга, вовлечённые в процессы памяти, обучения и регуляции эмоциональных реакций через ГАМК, — серотонин, — и антиглютаматергические механизмы [12].
К сожалению, нейротоксичность не ограничивается приёмом только нейроактивных препаратов. Лекарств, чьими побочными эффектами является поражение (той или иной степени и вида) центральной или периферической нервной системы, достаточно длинный список.
Остановимся на некоторых группах из этого списка более подробно. По данным итальянских авторов [20], большинство нежелательных реакций (в том числе нейротоксических) развивалось при применении антибиотиков. Возможно это — не случайно, ведь многие из них, например, β-лактамы и фторхинолоны используются для лечения менингита, а значит должны хорошо проникать через ГЭБ и накапливаться в СМЖ и мозге.
β-лактамы
Нейротоксичность, ассоциированная с этой группой антибиотиков, разнообразна: энцефалопатия, нарушение ментального статуса, миоклонус, судороги, порхающий тремор, неконвульсивный статус эпилептикус.
Фторхинолоны
Спектр нейропсихических нарушений при применении этой группы антибиотиков также достаточно широк: транзиторные психозы, инсомния, тревожность, депрессия, головная боль, очень редко (0,9—2%) встречаются судорожные реакции, главным образом у лиц с судорожной готовностью или как следствие неблагоприятного взаимодействия с другими лекарственными средствами (эуфиллин, имипенем, метронидазол).
Механизм этих осложнений видится в противодействии фторхинолонов связыванию γ-аминомасляной кислоты со своим рецептором.
Отмечается, что способность фторхинолонов проникать в ЦНС не всегда коррелирует с потенциальной эпилептогенностью. Так, например, офлоксацин, чья концентрация в СМЖ составляет 50% от сывороточной, менее нейротоксичен, чем ципрофлоксацин, у которого этот показатель вполовину меньше [23—25].
И последнее. Уже говорилось выше о значении генетических факторов, возраста и дозы лекарственных средств в возникновении нейротоксичности. Несколько примеров-напоминаний о препаратах из других терапевтических групп.
Нафазолин (Нафтизин) — средство для лечения ринита — противопоказан детям до 1 года в концентрации 0,05% и до 18 лет в концентрации 0,1%. Вследствие резорбции из носовой полости (из-за ошибочного применения у детей первого года жизни) оказывает выраженный нейротоксический эффект — тяжёлое угнетение ЦНС (собственные неопубликованные данные).
Пропофол — наркозное неингаляционное средство для поддержания анестезии и обеспечения седации у больных, находящихся на ИВЛ. Вследствие быстрого (через 30—60 с) наступления эффекта и поддержания седации в течение всего периода инфузии считается идеальным средством в анестезиологии. Однако превышение дозы выше 4 мг/кг/ч и длительности инфузии более 48 ч сопровождается рабдомиолизом, почечной недостаточностью и утратой сознания вплоть до глубокой комы [26].
Винкристин — противоопухолевый препарат растительного происхождения. К особенностям его фармакокинетики относится активная биотрансформация в печени с участием ферментов системы цитохрома Р450 — CYP3А4 и CYP3А5. У кавказских народов наблюдается высокая частота (80%) полиморфизма CYP3А5 с резким снижением метаболизма винкристина в случае его применения и развитием висцеральной нейропатии — паралитической кишечной непроходимости [27].
Таким образом, нейротоксичность нередкое явление при применении лекарственных средств многих терапевтических классов, варьируя от ототоксичности, висцеральной нейропатии и нейромышечной блокады до нарушения сознания, неспецифической энцефалопатии, судорог и неконвульсивного эпилептического статуса.
Популяционный риск нейротоксичности, ассоциированной с различными классами лекарственных средств, включает полярные возрастные группы, тяжесть заболевания, этногенетические особенности, печеночную или почечную недостаточность, фоновые нейропсихические заболевания.
Учёт этих обстоятельств поможет хотя бы в ряде случаев избежать или смягчить возникновение такого нередко тяжёлого побочного эффекта лекарственных средств, как нейротоксичность.
Список литературы
1. Mira Harrison-Woolrich, Juan Garcia-Quiroga, Jahella Ashton and Peter Herbison “Safety and Usage of Atypical Antipsychotic Medicines in Children” Drug Safety. 2007; 30 (7): 569-79.
2. Tuccori M., Lapi F., Testi A.et al. Statin-Associated Psychiatric Adverse Events. Drug Safety. 2008; 31 (12): 1115-23.
3. Toovey S., Rayner C., Prinssen E.et al. Assessment of Neuropsychiatric Adverse Events in Influenza Patients Treated with Oseltamivir: A Comprehensive Review. Drug Safety. 2008; 31 (12): 1097-1114.
5. Rezvani M., Finkelstein Y., Verjee Z., Railton C., Koren G. Generalized seizures following topical lidocaine administration during circumcision: establishing causation. Paediatric drugs. 2007; 9 (2): 125-127.
6. Mula M., Sander J. W. Negative Effects of Antiepileptic Drugs on Mood in Patients with Epilepsy. Drug Safety. July 2007; 30: 7: 555-567.
7. James E. Tisdale, Douglas A. Miller Drug induced diseases. American Society of Health-system Pharmacists. Bethesda. 2010; 179-316.
8. Bleggi-Torres L.F., de Medeiros B.C., Werner B. Neuropathological findings after bone marrow transplantation: an autopsy study of 180 cases. Bone Marrow Transplant. 2000; 25 (3): 301.
9. Ikonomidou C.1., Bittigau P., Ishimaru M.J. et al. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 2000 Feb 11; 287 (5455): 1056-60.
10. Forcelli P.A. Short- and Long-Term Neurological and Psychiatric Sequelae of Developmental Exposure to Antiepileptic and Anesthetic Drugs. Front Neurol. 2015; 6: 41.
11. Nie Q., Su B., Wei J. et al. Neurological teratogenic effects of antiepileptic drugs during pregnancy. Exp Ther Med. 2016 Oct; 12 (4): 2400-2404. Epub 2016; Aug 29.
12. Пылаева О.А., Мухин К.Ю., Петрухин А.С. Побочные эффекты антиэпилептической терапии. Издательство «Гарант», 2016.
13. Ушкалова Л.В., Ушкалова Е.А. Безопасность психотропных препаратов в период грудного вскармливания. Фарматека. 2013; 1: 55-63.
14. Schmidt D. Anticonvulsants. In: Meylers side-effects of drugs (Dukes M.N.G., ed.). 12th ed. New York: Elsevier Science Publishers BV 1992; 122-43.
15. Клиническая фармакология при беременности. Под редакцией Х.П. Кьюмерле и К. Брендела. «Медицина», 1987; 1: 193-216
16. Gedzelman E., Meador K. Neurological and psychiatric sequelae of developmental exposure to antiepileptic drugs. Front Neurol. 2012; 3: 182. doi: 10.3389/fneur.2012.00182.
17. Turski C.A., Ikonomidou C. Neuropathological sequelae of developmental exposure to antiepileptic and anesthetic drugs. Front Neurol. 2012; 3: 120. doi: 10.3389/fneur.2012.00120.
18. Hanson J. W. Teratogen update: fetal hydantoin effects. Teratology. 1986; 33: 3: 349-353.
19. Bosnjak Z.J., Logan S., Liu Y. Recent Insights Into Molecular Mechanisms of Propofol-Induced Developmental Neurotoxicity: Implications for the Protective Strategies. Anesthesia and analgesia. August 2016; 123 (5): 1286-1296.
20. Каширская Е.И. Клинико-биохимическая оценка и прогнозирование здоровья детей, развивающихся под воздействием психоактивных веществ. Автореферат докторской диссертации. Астрахань, 2010.
21. Ferrajolo C., Capuano A., Trifiro G. Pediatric drug safety surveillance in Italian pharmacovigilance network: an overview of adverse drug reactions in the years 2001- 2012. Expert opinion on drug safety. 2014; 13: Suppl 1: S9-20. Epub2014/08/30.doi: 10.1517/14740338.2014.939581PMID: 25171155.
22. Durand-Maugard C., Lemaire-Hurtel A.-S., Gras-Champel V. Blood and CSF monitoring of cefepime-induced neurotoxicity: Nine case reports. Journal of Antimicrobial Chemotherapy. 2012; 67 (5): 1297-9.
23. Bae Kim K.B., Moon Kim S., Park W. et al. Ceftiaxone-Induced Neurotoxicity: Case Report, Pharmacokinetic Considerations, and Literature Review. Journal of Korean medical science. 2012; 27 (9): 1120-3.
24. Падейская Е.Н., Яковлев С.В. Антимикробные препараты группы фторхинолонов в клинической практике». Логета». М.: 1998.
25. Яковлев В.П., Падейская Е.Н., Яковлев С.В. Ципрофлоксацин в клинической практике. М.: 2000.
26. Rama K Maganti. Neurotoxic effects associated with antibiotic use: Management considerations. British Journal of Clinical Pharmacology. 2011; 72 (3): 381-93.
27. Постников С.С., Костылева М.Н., Брюсов Г.П. Случай синдрома инфузии пропофола у ребенка 10 лет. Безопасность и риск фармакотерапии. 2016; 4: 5-10.
Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов
Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов
Потенциал-чувствительный натриевый канал имеет форму диафрагмы фотоаппарата, где пóровая часть одного домена канала взаимодействует с потенциал-чувствительной частью другого домена. α-Нейротоксины, по-видимому, отражают это строение в своей модульной архитектуре.
Авторы
Редакторы
Биологическая эволюция — общая форма существования живой материи. При детальном рассмотрении оказывается, что виды почти никогда не эволюционируют поодиночке: обычно в этом принимают участие их экологические партнеры, и изменение происходит в парах паразит—хозяин или хищник—жертва. Более того, коэволюцию часто можно проследить на молекулярном уровне, когда один вид совершенствует систему нападения, а второй вслед за ним — систему защиты (и наоборот). Параллель с холодной войной здесь настолько очевидна, что соответствующий феномен даже получил название эволюционной «гонки вооружений». Примером наиболее эффективных и элегантных систем нападения служат животные яды, содержащие в своем составе нейротоксины — вещества, воздействующие на нервную систему и мышцы жертвы.
Несмотря на детальную проработку теории эволюции профессионалами и многочисленные примеры, вошедшие в учебники и популярную литературу [1], воплощение эволюционного процесса зачастую настолько причудливо, что исследование изменений в живых организмах может быть интересно далеко не только ученым-теоретикам. Известно, что у эволюции нет воли и цели: живые организмы меняются, чтобы оставить максимальное потомство, а не чтобы достигнуть абстрактного совершенства [2]. Так, эволюционно прогрессивным признаком считается то, что позволяет лучше приспособиться к окружающим условиям в данный момент, а не красота или сложность устройства сами по себе.
Например, антарктическая ледяная рыба утратила гены гемоглобина из-за того, что условия ее обитания — нулевая или даже отрицательная (!) температура воды, растворимость кислорода в которой достаточно высокая, чтобы обеспечивать ткани этим газом просто за счет диффузии и усиления кровотока. Можно сказать, что в этом случае рыба «экономит» на гемоглобине [3]. Другие рыбы, которые живут в пещерах и никогда не выплывают на белый свет или обитают на очень больших глубинах, почти всегда за ненадобностью теряют зрение. Степень упрощения паразитических организмов вообще поражает воображение, причем в случае бактерий это приводит к кардинальному упрощению всего генетического аппарата: например, геном микоплазмы содержит всего около 500 генов, а у облигатного внутриклеточного симбионта Candidatus Carsonella ruddii и вовсе около 180 генов [4]. И всё перечисленное — прогрессивные признаки, поскольку они позволили упомянутым организмам максимально адаптироваться к обстановке, в которой они обитают. Более известный (и более «благородный») пример — эволюция человека, где развитие пошло по пути усложнения нервной системы и способности к коммуникации, а также к становлению богатой культуры, современное состояние которой мы имеем удовольствие ежедневно наблюдать вокруг. Одновременно возросла роль полового отбора и образования семей [5], — и все это тоже проделки эволюции [6].
В нашей статье речь пойдет об особой разновидности эволюционного процесса, которую можно назвать «гонкой вооружений» и в которой участвуют две стороны: нападающая и обороняющаяся (или «догоняющая» и «убегающая»). Чрезвычайно любопытно наблюдать «гонку» на молекулярном уровне. Поскольку изменение одной стороны согласовано с изменением второй, то и гонку вооружений иногда можно довольно подробно проследить по «молекулярной летописи» процессов, происходящих внутри живых организмов.
Уроки холодной войны
Вторая половина XX века, кроме замечательных открытий в молекулярной биологии, была ознаменована холодной войной — глобальной конфронтацией между социалистическим и капиталистическим строями. Это противостояние породило эффект гонки вооружений — процесс борьбы за военное превосходство с положительной обратной связью, вызвавший гипертрофию военно-промышленных комплексов СССР и США.
Похожий эффект наблюдается и в процессе коэволюции двух видов, связанных друг с другом в системе «хищник—жертва» или «паразит—хозяин»: изменение одного из видов неизбежно влечет изменение второго для сохранения паритета или получения превосходства. Хорошо известный пример эволюционной гонки вооружений — газель и гепард, каждому из которых приходится бегать из поколения в поколение все быстрее и быстрее, чтобы одному ускользнуть из пасти, а другому — остаться сытому.
Эволюционная гонка вооружений, или принцип Черной королевы
Подчеркивая параллель с холодной войной, биологи ввели понятие эволюционной гонки вооружений (англ. evolutionary arms race), приписывая этому процессу роль важнейшей движущей силы эволюции [7]. Более строго это понятие сформулировано в форме «принципа Черной Королевы», утверждающего, что в коэволюционных отношениях каждому из видов приходится «бежать со всех ног, чтобы только остаться на том же месте» (эта цитата из «Алисы в Зазеркалье» удачно передает суть принципа). Прямое экспериментальное подтверждение принципа Черной королевы получено на микроскопических рачках дафниях и их паразитических бактериях: «воскресив» из донного ила несколько поколений тех и других, биологи показали, что самые опасные для дафний паразиты — современные им, тогда как «прошлые» и «будущие» популяции бактерий заражали рачков с меньшей эффективностью [8].
Око за око, ген за ген
Хорошим примером эволюционной гонки вооружений являются растения с их паразитами. Во многих случаях наблюдается строгое соответствие системы устойчивости растения системе вирулентности его паразита. Более того, это соответствие сводится всего лишь к двум генам: гену растения, позволяющему противостоять заражению (гену резистентности, R) и гену паразита, необходимому для инфекции (гену авирулентности, Avr). Такие межвидовые отношения получили название «ген за ген» (англ. gene-for-gene) [9]. Растения, содержащие ген R, оказываются устойчивыми по отношению к паразитам с соответствующим геном Avr. Как правило, гены резистентности растений кодируют белки-рецепторы, регистрирующие появление паразита. Теперь паразит стремится изменить свой Avr-ген так, чтобы ускользнуть от узнавания рецептором растения. И наоборот, растение изменяет свой R-ген, чтобы по-прежнему детектировать заражение.
Вариация фаз
Одно из наиболее прогрессивных эволюционных приобретений высших позвоночных — развитая иммунная система, основанная на принципе комбинаторики и позволяющая противостоять практически любому чужеродному организму [10], [11]. Однако бактерии и вирусы на сдаются, им тоже есть что предъявить из своего арсенала. Хорошо известный пример — постоянно мутирующий вирус гриппа, к которому необходимо получать всё новые и новые вакцины [12]. Другой, не менее поразительный, пример — явление «смены фаз» у бактерий, заключающееся в случайном изменении фенотипа с высокой частотой, намного превышающей частоту обычных мутаций. Так, сальмонеллы используют этот прием для замены белка флагеллина, из которого построены бактериальные жгутики и который служит сигналом для запуска иммунологических реакций. Только у хозяина разовьется иммунный ответ, как сальмонелла меняет тип флагеллина и ускользает [13]!
Ядовитый арсенал
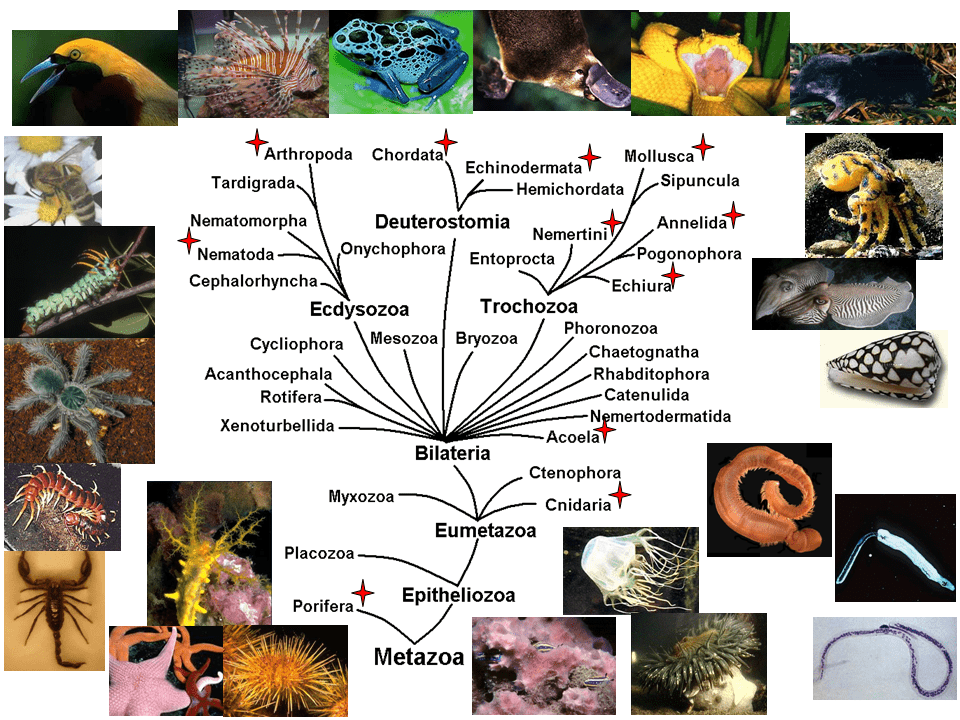
Пожалуй, самым эффективным средством как нападения, так и защиты служат яды, которые в процессе эволюции научились вырабатывать разнообразнейшие животные: многие кишечнополостные, членистоногие, моллюски, хордовые и другие (рис. 1). Присутствующие в ядах молекулы называют токсинами, а в том частном (но распространенном) случае, когда мишенью их действия служит нервная система и/или мышцы, — нейротоксинами.
Рисунок 1. Разнообразие ядовитых животных. На филогенетическом дереве многоклеточных отмечены типы животных, среди представителей которых встречаются ядовитые. Вокруг дерева расположены фотографии ядовитых животных (сверху — позвоночных, слева — членистоногих, слева внизу — иглокожих, справа вверху — моллюсков, справа внизу — губок, кишечнополостных и некоторых червей).
Состав яда животных различен: если, допустим, в яде пчелы присутствуют всего два основных компонента — мембраноактивный пептид мелиттин и гидролизующий липиды фермент фосфолипаза A2, — то в яде пауков, скорпионов, морских анемон и конусов, а также змей содержатся десятки, а иногда сотни или даже тысячи компонентов различной химической природы. Наблюдаемое в ядах разнообразие компонентов одного структурного типа сегодня принято описывать термином «эволюционно отредактированная комбинаторная библиотека» [14]. Эти молекулы обладают различной эффективностью и специфичностью в отношении разных рецепторов, а результирующая смесь токсинов эффективна в отношении широкого круга мишеней.
Эволюционное преимущество богатого арсенала — способность «следовать» за жертвой: если мишень действия основного компонента яда начнет ускользать (например, рецептор мутирует), в яде с большой вероятностью обнаружится слабо представленный, но более активный по отношению к новой форме рецептора токсин, и теперь уже ему суждено будет стать основой «вооружения» у будущих поколений ядовитых хищников.
«Всенепременнейше захватите телеграф!»
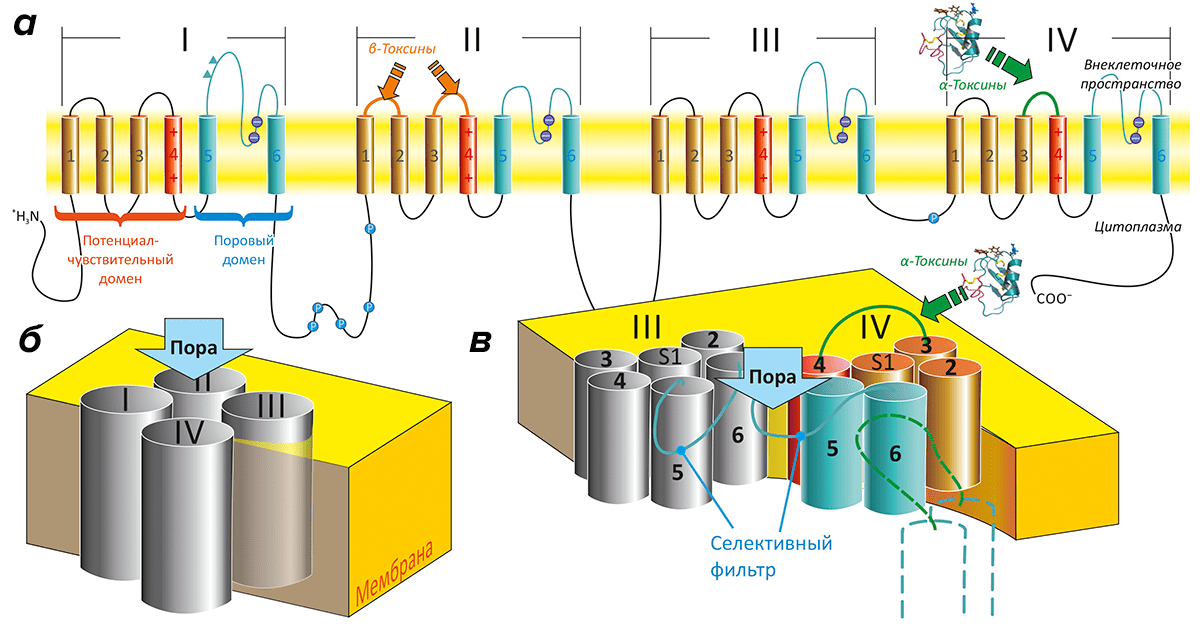
Каждый ПЧНК состоит из очень длинной полипептидной цепи (около двух тысяч остатков аминокислот), которая представлена четырьмя похожими повторами (рис. 2). При этом в пространстве канал составлен из пяти частей (или доменов). В образовании единственного порового домена (ПД) участвуют все повторы полипептидной цепи; в его центре формируется селективная для ионов Na + пора. Четыре — по одному от каждого повтора — потенциал-чувствительных домена (ПЧД) расположены вокруг центрального ПД [16]. Функция ПЧД — реагировать на изменение мембранного потенциала и передавать команду на открытие поры.
Рисунок 3. Некоторые природные нейротоксины, воздействующие на ПЧНК. Изображена модель пространственной организации канала; показан центральный ПД и два ПЧД (II и IV). Представлены фотографии ядовитых животных, служащих источником «классических» нейротоксинов. Тетродотоксин из рыбы фугу блокирует пору ПЧНК, связываясь с внеклеточной стороны. Батрахотоксин из кожи колумбийской лягушки проникает через мембрану и встраивается внутрь поры канала, вызывая его активацию. α-Токсины скорпионов связываются с ПЧД-IV и подавляют процесс естественной инактивации каналов. β-Токсины скорпионов связываются с ПЧД-II и активируют ПЧНК.
Но не все токсины блокируют канал: есть и такие, которые его активируют, то есть увеличивают время, когда канал находится в открытом состоянии. Примером таких молекул является батрахотоксин, содержащийся в секрете кожных желез некоторых Южноамериканских лягушек-листолазов. Распространенные инсектициды пиретроиды также относятся к активаторам ПЧНК.
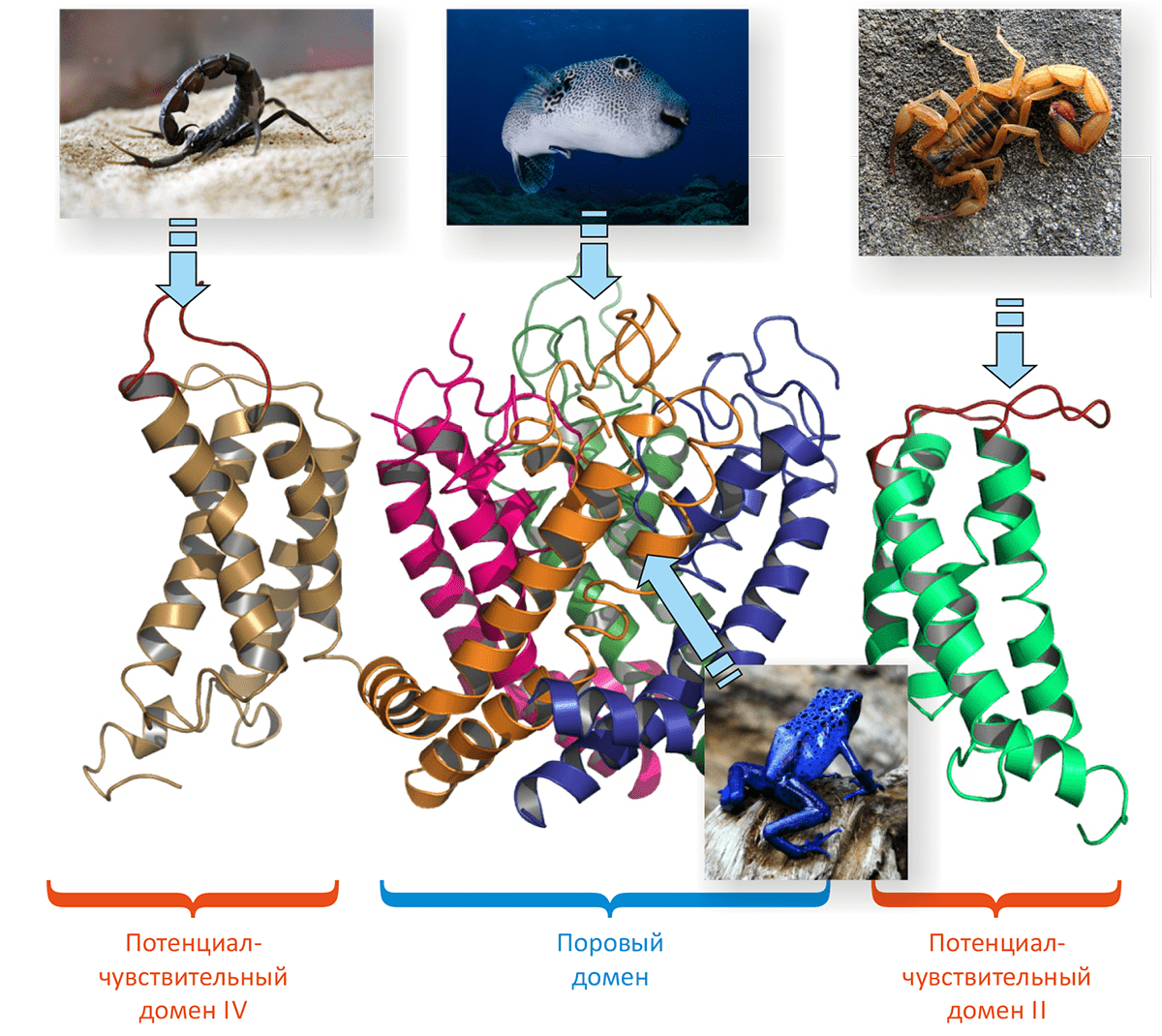
α- и β-токсины из яда скорпионов представляют собой небольшие белки (
60—70 аминокислотных остатков), в структуре которых присутствует β-лист из трех тяжей и короткая α-спираль, скрепленные четырьмя дисульфидными связями (рис. 4). Хотя и те, и другие токсины, по сути, активируют канал, делают они это по-разному. α-Токсины мешают каналу закрыться, а β-токсины — помогают ему открыться. Соответственно и места взаимодействия с ПЧНК у этих токсинов разные: те и другие связываются с ПЧД, но для α-токсинов это ПЧД-IV, а для β-токсинов — ПЧД-II.
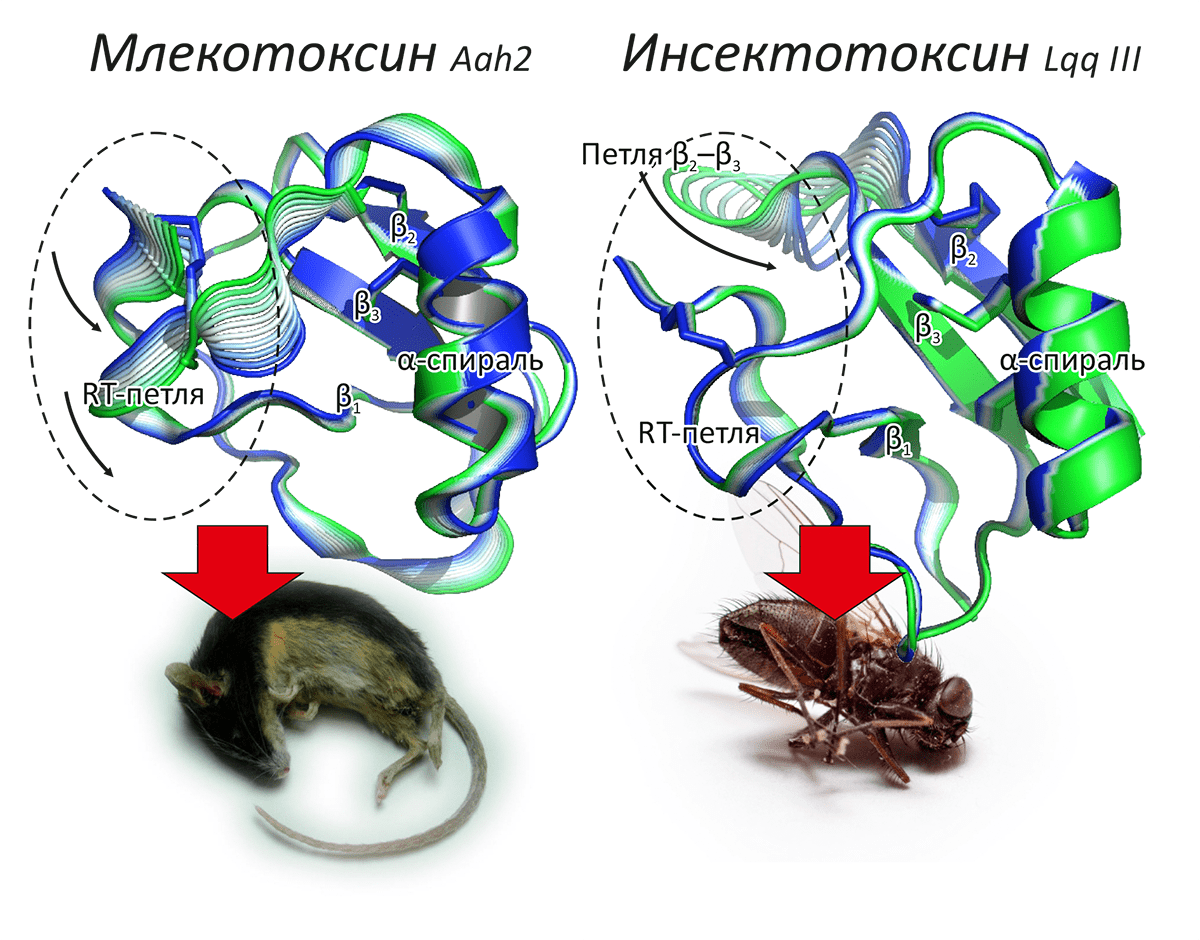
Рисунок 4. Модульная структура α-токсинов скорпионов. Эти токсины — небольшие белки, составленные из β-листа и α-спирали, скрепленных дисульфидными связями. Такая жесткая и эволюционно консервативная структура образует «сердцевину» молекулы, а две петли и C-конец образуют динамически подвижный «модуль специфичности» (показан пунктирным овалом), отличающийся у млеко- (слева) и инсектотоксинов (справа). Рисунок показывает результаты анализа характерных внутренних движений по данным молекулярной динамики. Цветной спектр конформаций изображает динамическую подвижность каждой из молекул.
Остановимся теперь подробнее на α-токсинах и их «взаимоотношениях» с ПЧНК. Дело в том, что в яде скорпионов присутствуют молекулы, обладающие токсическим действием по отношению к насекомым или млекопитающим (назовем соответствующие α-токсины инсектотоксинами и млекотоксинами). И те, и другие связываются с ПЧД-IV, но только у разных каналов. У насекомых это свой канал, называемый Para [18], а у млекопитающих есть целых девять разновидностей каналов, обозначаемых Nav1.1—1.9 [19]. Разные ПЧНК млекопитающих выполняют разные функции. Например, Nav1.2 характерен для центральной нервной системы, Nav1.4 — для скелетной мускулатуры, Nav1.5 — для сердца [20]. А дальше в ход идет упомянутая «комбинаторная библиотека» яда скорпионов, в которой может найтись молекула, активная по отношению к выбранной мишени. Если это происходит, «владелец» такого яда получает эволюционное преимущество по сравнению с другими, и та часть его генома, которая отвечает за состав ядовитой библиотеки, широко распространяется в будущих поколениях скорпионов.
Присутствующие в яде скорпионов нейротоксины отличаются разнообразием: некоторые из них могут быть направлены исключительно на каналы насекомых (инсектотоксины), тогда как другие действуют на каналы млекопитающих (млекотоксины). Есть также молекулы, действующие сразу и на те, и на другие ПЧНК. Что лежит в основе молекулярной эволюции этих токсинов, позволяющей им угнаться сразу за множеством ускользающих мишеней? Попробуем ответить на этот вопрос.
Компьютерный анализ выявляет «молекулярную гонку вооружений»
В Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН было проведено исследование, направленное на выявление особенностей млеко- и инсектотоксинов из яда скорпионов, определяющих их селективное взаимодействие с соответствующими ПЧНК. Работа состояла из двух частей:
Компьютерное моделирование было основано на методе молекулярной динамики (МД) [21]. Установлено, что молекулы α-токсинов, несмотря на свой небольшой размер и жесткую структуру, состоят из двух динамических модулей. Анализ характерных движений показал, что один из этих модулей достаточно «жесткий», а другой конформационно «пластичный». Более того, движения «пластичного» модуля различаются у млеко- и инсектотоксинов (рис. 4).
Идентифицированные с помощью МД части молекул получили название «сердцевины» и «модуля специфичности». Сердцевина α-токсинов оказывается эволюционно консервативным (очень сходно устроенным у инсекто- и млекотоксинов), а модуль специфичности — вариабельным, соответствующим конкретной мишени действия. Сердцевина, таким образом, отвечает за распознавание ПЧНК «вообще», а быстро изменяющийся в эволюции модуль специфичности позволяет токсину «настраиваться» на конкретный тип канала.
Было также обнаружено, что модуль специфичности млекотоксинов существенно более гидрофильный, чем у инсектотоксинов. Эта особенность, предположительно, отражает структурные детерминанты, позволяющие токсинам селективно распознавать свои мишени. Что интересно, анализ свойств ПЧНК показал ту же тенденцию для внеклеточной части S5—S6 повтора I: у каналов млекопитающих эти области более гидрофильны, а у каналов насекомых — гидрофобны. Сопоставление результатов анализа с накопленными биохимическими данными позволило предложить любопытный характер связывания α-токсинов с ПЧНК. Сердцевинный модуль, по-видимому, взаимодействует с ПЧД-IV, в то время как модуль специфичности связывается с петлей S5—S6 повтора I. Интересно, что данные области в структуре ПЧНК сближены, что также было показано в независимых экспериментах. Идея соответствия модульной организации токсинов доменной структуре каналов имеет интересный эволюционный смысл, позволяющий нам разглядеть гонку вооружений в противостоянии ядовитых животных и их жертв. Модульная структура предположительно позволяет токсинам гибко адаптироваться к изменяющейся мишени.
Компьютерный анализ может быть использован для предсказания активности токсинов с неизученными свойствами. В частности, для токсина M9 из яда Среднеазиатского скорпиона Mesobuthus eupeus, ставшего первым α-нейротоксином из скорпионьего яда, для которого была установлена пространственная структура (кстати, это тоже было сделано в ИБХ [22]), была предсказана активность в отношении каналов как млекопитающих, так и насекомых. Биоинженерный синтез и тестирование активности этого токсина на рекомбинантных ПЧНК подтвердили высказанное предположение. Результаты представленной работы были опубликованы в журнале Journal of Biological Chemistry [23]. Эволюционное обособление модулей α-токсинов, похоже, вызвано требованиями гонки вооружений — необходимостью оперативно адаптироваться вслед за изменяющимися условиями среды: появлением новых мишеней и изменением старых. Вряд ли этот подход является универсальным, но в данном случае он позволил с новой стороны взглянуть на взаимосвязь структура—функция для биологически активных пептидов.
Биоинженерия и нейробиология
Исследования молекулярных основ эволюционной гонки вооружений имеет не только фундаментальное значение. Например, заново созданные «дизайнерские» молекулы — аналоги нейротоксинов с заданной исследователями активностью — являются идеальными инструментами исследования нервной системы. Такие молекулы позволили бы прицельно регулировать работу ионных каналов и модифицировать нервный ответ желаемым образом.
Придание нейротоксинам желаемой селективности и видоспецифичности позволит, например, создать инсектицид нового поколения. Биоинженерно изготовленный или даже внедренный в геном растений инсектотоксин позволит эффективно бороться с насекомыми-вредителями. А можно представить себе возможность создания идеально селективного инсектотоксина, действующего на вредителей и не токсичного для полезных насекомых (например, пчел).
Наконец, идеально селективные нейротоксины — уже не яды, а точно настраиваемые нейрорегуляторы — нашли бы применение в молекулярной медицине для лечения заболеваний, связанных с дисфункцией ионных каналов и называемых каналопатиями. Среди них — различные неврологические и психические расстройства, а также к патологии скелетной и сердечной мускулатуры [24].
Статья поддержана грантом РФФИ д_с-13-04-11520 и первоначально опубликована в «Науке и жизни» [25]. См. также видеозапись «ядовитого» семинара, организованного Советом молодых ученых ИБХ РАН осенью 2013 года.
Видео 1. Доклад А.А. Василевского «Что-то. про паучков», сделанный на «ядовитом» семинаре Совета молодых ученых ИБХ РАН осенью 2013 года. В этом докладе также рассказывается о непростых взаимоотношениях нейротоксинов с их молекулярными мишенями.