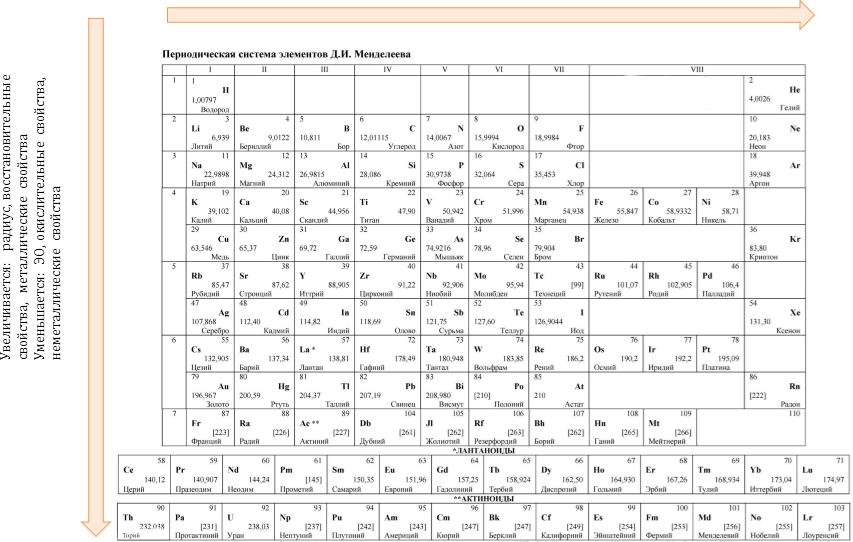
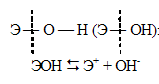Чем объясняются некоторые общие свойства элементов одной главной подгруппы
Изменения свойств в таблице Менделеева
Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства.
Атомы элементов одного периода имеют одинаковое число энергетических уровней.
Периодический закон: «свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома».
Закономерности изменения свойств элементов по группам и периодам:
Увеличивается: заряд, ЭО, окислительные свойства, неметаллические свойства.
Уменьшается: радиус, восстановительные свойства, металлические свойства.
Изменение некоторых характеристик элементов в периодах слева направо :
( Неметалличность – это способность атомов элемента присоединять электроны ). Изменение некоторых характеристик элементов в группе сверху вниз:
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т. к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
Электроотрицательностью элемента характеризуется способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Закономерности изменения химических свойств элементов. Характеристика элементов
Теория к заданию 2 из ЕГЭ по химии
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
— металлические свойства уменьшаются;
— неметаллические свойства усиливаются;
— оксиды от основных через амфотерные сменяются кислотными оксидами;
— гидроксиды от щелочей через амфотерные сменяются кислотами.
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, — аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т.е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы — металлы
Все металлы, кроме ртути, в обычном состоянии — твердые вещества и имеют ряд общих свойств.
Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
Атомы элементов-металлов отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Вы уже знаете, что в Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат ($Be, Al, Ti, Ge, Nb, Sb$), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Особенности строения металлов главных подгрупп I–III групп.
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т.е. сверху вниз в Периодической таблице). Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями. В реакциях с водой они образуют растворимые в воде основания (щелочи).
Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Большинство элементов-металлов находится в побочных группах Периодической системы.
Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы – неметаллы
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не утратила своей значимости и в настоящее время.
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Свойства атомов элементов – неметаллов
У атомов неметаллов преобладают окислительные свойства, т.е. способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, т.е. проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя.
| В периоде: — заряд ядра увеличивается; — радиус атома уменьшается; — число электронов на внешнем слое увеличивается; — электроотрицательность увеличивается; — окислительные свойства усиливаются; — неметаллические свойства усиливаются. | В главной подгруппе: — заряд ядра увеличивается; — радиус атома увеличивается; — число электронов на внешнем слое не изменяется; — электроотрицательность уменьшается; — окислительные свойства ослабевают; — неметаллические свойства ослабевают. |
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Характеристика элементов главной и побочной подгрупп I группы
Задача 970.
Как и почему изменяются основные свойства в ряду LiOH — CsOH?
Решение:
В ряду LiOH — CsOH основные свойства увеличиваются (сила оснований возрастает). Объясняется это тем, что с возрастанием порядкового номера элемента увеличивается радиус иона щелочного металла, что приводит к ослаблению связей Э — О. С ростом заряда ядра атома увеличивается полярность связи. Всё это приводит к тому, что характер диссоциации гидроксидов ЭОН может протекать только по связи Э — О, а не О — Н. При чём степень диссоциации будет возрастать в ряду LiOH — CsOH:
При одинаковых зарядах и К+ и Сu + различие в их поляризующем действии определяется особенностями их электронного строения. Ион Сu + имеет 18-электронную внешнюю оболочку – 3s 2 3p 6 3d 10 и сравнительно небольшой радиус (0,98 A 0 ), обладает более сильным поляризующим действием, чем ион К + с благородногазовой электронной структурой – 3s 2 3p 6 , а его радиус составляет (1,3 3 A 0 ) ; поэтому он оказывает более слабое поляризующее действие.
Таким образом, при одном и том же заряде катионов:
Задание № 1(5 баллов)
Государственное бюджетное образовательное учреждение
образования для детей»
350000 г. Краснодар,
КРАЕВЫЕ ЗАОЧНЫЕ КУРСЫ
ответы и критерии оценки заданий к работе № 4, уч. год
Задание № 1(5 баллов)
Определите положение элементов в периодической системе (период, группа, подгруппа) по электронным формулам:
б) 1s2 2s2 2p6 3s2 3p3
а) В атоме два электронных слоя, значит, элемент находится во II периоде. Последним в атоме заполняется p-подуровень, следовательно, это элемент главной подгруппы. На внешнем электронном слое атома находятся три электрона, поэтому это элемент II группы бор.
б) В атоме три электронных слоя, значит, элемент находится в III периоде. Последним в атоме заполняется p-подуровень, следовательно, это элемент главной подгруппы. На внешнем электронном слое атома находятся пять электронов, поэтому это элемент III фосфор.
Чем отличается электронное облако, которое характеризуется n = 5, l = 0, m = 0, от электронного облака, которое характеризуется n = 4, l = 0, m = 0?
Данные электронные облака отличаются главным квантовым числом, значит, они имеют различные энергию и размер.
Задание № 3(6 баллов)
Чем объясняются некоторые общие свойства элементов одной главной подгруппы?
Главная подгруппа — это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем электронной слое. Это число равно номеру группы.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, так как они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются одинаковым строением внешнего электронного слоя.
В атоме какого элемента — рубидия или натрия — связь валентного электрона с ядром сильнее? Объясните, почему.
Рубидий и натрий находятся в одном периоде, при этом у натрия валентный электрон ближе к ядру (3 уровень), чем у рубидия (5 уровень), значит, у атома натрия связь валентного электрона с ядром сильнее.
Расположение элементов в периодической системе определяется зарядом ядра. Как правило, при увеличении заряда ядра возрастает и относительная атомная масса. В данном случае имеет место исключение. У калия два стабильных изотопа: 
с распространенностью в природе 93,3% и 6,7% соответственно; аргон
имеет три стабильных изотопа: 
Задание № 6(5 баллов)
Напишите электронную конфигурацию атома рубидия в первом возбужденном состоянии.
Электронная конфигурация атома рубидия в основном состоянии — 1s22s22p63s23p64s23d104p65s1. Первое возбужденное состояние получается при переходе одного электрона с высшей занятой орбитали (5s) на низшую свободную орбиталь (4d). Электронная конфигурация атома рубидия в первом возбужденном состоянии — 1s22s22p63s23p64s23d104p64d1.
Задание № 7(6 баллов)
Какова электронная конфигурация атома сурьмы в основном состоянии? Сколько электронных пар имеется в атоме сурьмы и какие орбитали они занимают? Сколько в атоме неспаренных электронов и какие орбитали они занимают?
Электронная конфигурация атома имеет структуру 1s22s22p63s23p64s23d104p65s24d105p3. Изображая эту конфигурацию при помощи квантовых ячеек можно заметить, что в атоме сурьмы содержатся двадцать четыре электронных пары (занимают 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d). В соответствии с правилом Гунда неспаренных электрона три, они занимают три 5p орбитали.
Задание № 8(8 баллов)
I период № 1 
Первый период состоял бы из двух элементов, второй — из шести, третий — из шести или двенадцати. Наибольшую электроотрицательность имел бы элемент № 7, а элемент № 10 являлся бы металлом с конфигурацией 1s22s22p43s2. Этот элемент образовывал бы соединения с неметаллами и проявлял бы восстановительные свойства.
Задание № 9(6 баллов)
Химический элемент состоит из двух изотопов. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. В ядре второго изотопа нейтронов на 2 больше. На 9 атомов более легкого изотопа приходится один атом более тяжелого изотопа. Вычислите среднюю атомную массу элемента.
Аr(1) = 10 + 10 = 20 а. е.м.
Аr(2) = 20 + 2 = 22 а. е.м.
Аr(средняя) = 20∙0,9 + 22∙0,1 = 20,2 а. е.м.
Задание № 10(10 баллов)
1000 г вещества содержат 0,3227 г электронов. Определите формулу вещества. (Масса электрона равна 1/1823 а. е.м.).
ν(электронов) = 0,3227(1/1823) = 588,7 моль.
Пусть n – число электронов в одной молекуле. Тогда число молей электронов в n раз превышает число молей вещества:
n = ν(электронов)/ν(в-ва) = 588:(1000/М)
Предположим, что молярная масса выражается целым числом, тогда n кратно 10. При n =10 имеем М =17 г/моль. Этой молярной массе соответствует аммиак NН3, его молекула содержит как раз 10 электронов.
Итого максимальное количество 48 баллов
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.