Чем объясняется устойчивость белковых растворов
Чем обусловлена устойчивость белка в растворе? Факторы устойчивости.



Белки устойчивы в растворе, т.к. имеют заряд и гидратную оболочку. Они называются факторами устойчивости белка.
Осадить белок из раствора можно, если удалить даже один из факторов устойчивости.
16. Реакции осаждения. Как можно осадить белок из раствора? Значение этих реакций в медицине
При снятии заряда белки теряют гидратную оболочку, растворимость их падает и они выпадают в осадок, т.е. белки осаждаются, если они теряют оба или хотя бы один из факторов устойчивости.
Веществами, которые могут снять заряд белковой молекулы, являются соли тяжелых металлов, алкалоидные реактивы. Концентрированные кислоты обладают дегидратирующим свойством. Осадить белки из растворов можно и нейтральными солями. Этот процесс называется высаливанием. Высаливающее действие ионов зависит от их способности отнимать воду у белков, а также от способности ионов адсорбироваться на белковых молекулах и нейтрализовать их заряд. По силе высаливающего действия ионы образуют следующий ряд:
Литий обладает наибольшей плотностью электрического заряда, сильно притягивает воду, следовательно, хорошо снимает гидратную оболочку, но плохо адсорбируется. Цезий, наоборот, лучше адсорбируется на поверхности белка. Высаливание используется для фракционирования и очистки белков.
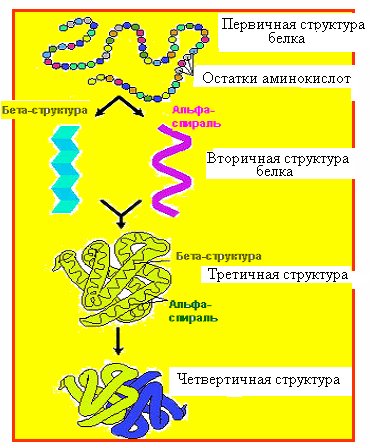
17. Структурная организация белков. Зависимость биологических свойств белка от первичной структуры.
В каждой цепи различают две концевые аминокислоты: N-концевая имеет свободную аминогруппу и считается первой, С-концевая имеет свободную карбоксильную группу и считается последней. Последовательность аминокислот в полипептидной цепи обуславливает расстановку по ее длине различных
Скелет полипептидной цепи образован аминогруппой, α-углеродом и карбоксильной группой. Боковые цепи (радикалы) аминокислот располагаются ниже или выше остова цепи. Каждый белок характеризуется уникальной первичной структурой, ее изменения ведут к нарушениям физико-химических и функциональных свойств белков. Белки различных видов животных, одинаковые в функциональном отношении, отличаются природой входящих в их состав аминокислот, т. е. белкам присуща специфичность, обусловленная их первичной структурой.
От первичной структуры зависят и антигенные свойства белка, обуславливающие выработку иммунной системой специфического белка (антитела) при введении в организм чужеродных белковых молекул. Антитела, соединяясь с антигеном, выводят его из метаболического круга, способствуя его осаждению, растворению и т. д. Часть белка, участвующая в образовании комплекса с антителом, называется антигенной детерминантой
Вторичная структура. Знание первичной структуры недостаточно для точного представления о строении белка и его функции. Вторичная структура — это способ свертывания, скручивания полипептидной цепи в спиральную или какую-либо иную конформацию. Возникает в результате образования большого числа водородных связей между карбонильными кислородами одной пептидной связи и азотом иминогрупп, расположенных на четыре аминокислотных остатка выше предыдущей аминокислоты (рис. 4). Таким образом, все кислородные атомы карбонильных групп и атомы азота в пептидных связях соединены водородными связями, каждая из которых является весьма слабой, но вместе они формируют достаточно стабильную спиралевидную структуру.
Различают два вида вторичной структуры: α-спираль и β-структура.

Третичная структура является высшей для молекул с одной полипептидной цепью.
Наличие четвертичной структуры имеет большой биологический смысл:
1. Синтезируются небольшие полипептидные цепи, из которых собираются макромолекулы, что уменьшает количество ошибок при синтезе.
2. Экономит генетический материал, т. к. одинаковые цепи синтезируются на одной м-РНК с использованием большого числа рибосом.
3. Обуславливает возможность регуляторных воздействий. Мономерные единицы, участвующие в образовании четвертичной структуры, взаимодействуют между собой гидрофобными участками, не имеющими активных функциональных групп. Поэтому их соединение непрочное и субъединицы легко смещаются по отношению друг к другу при малейших воздействиях.
18. Денатурация белков, денатурирующие агенты, их действие.
При образовании третичной структуры возникает неповторимая высоко специфическая форма индивидуальных белков, малейшее изменение которой сопровождается нарушением биологической активности белка, изменением его физико-химических свойств. Происходит денатурация белка. Таким образом, денатурация наблюдается в тех случаях, когда из-за разрыва связей, стабилизирующих определенные структуры, четвертичная, третичная, вторичная структуры разрушаются. Денатурацию могут вызвать следующие денатурирующие агенты:
1. Повышение температуры выше 42°С, вызывающее разрыв водородных и гидрофобных связей.
2. Кислоты и основания, изменяющие заряд и действующие на полярные связи.
3. Органические растворители, влияющие на гидрофобное взаимодействие.
4. Мочевина и гуанидин, образующие с белками многочисленные водородные связи, вследствие чего происходит дезорганизация их структуры, при этом воздействии возможна денатурация.
5. Соли тяжелых металлов, изменяющие заряд белковой молекулы и разрывающие ионные связи.
6. Ультрафиолетовое облучение.
7. Тиоловые соединения, вызывающие восстановительный разрыв дисульфидных мостиков.
Денатурирующие агенты нарушают связи, стабилизирующие третичную и даже вторичную структуру. Денатурированные белки легче расщепляются ферментами, т.к. увеличивается площадь соприкосновения фермента с пептидными связями. Денатурация может быть в некоторых случаях обратимой (при действии нейтральных солей), когда после удаления денатурирующего агента или уменьшения его концентрации, белок может восстановить свою структуру, т.е. произойдет ренатурация.
19. Классификация белков. Простые, сложные белки, определение, представители. Белки по строению делятся на две группы: простые – протеины и сложные – протеиды. Протеины состоят только из остатков аминокислот. Протеиды состоят из простого белка и простетической (небелковой) группы. Представителями простых белков являются альбумины, глобулины, гистоны, протамины, склеропротеины.
Чем объясняется устойчивость белковых растворов
Белки имеют высокую молекулярную массу, некоторые растворимы в воде, способны к набуханию, характеризуются оптической активностью, подвижностью в электрическом поле и некоторыми другими свойствами.
Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуется пептидная, водородная дисульфидная и другие виды связей. К радикалам аминокислот, а следовательно и белков, могут присоединяться различные соединения и ионы, что обеспечивает их транспорт по крови.
Определение молекулярной массы проводится различными методами: осмометрическим, гельфильтрационным, оптическим и др. однако наиболее точным является метод седиментации, предложенный Т. Сведбергом. Он основан на том, что при ультрацентрифугировании ускорением до 900 000 g скорость осаждения белков зависит от их молекулярной массы.
Водные растворы белков имеют свои особенности. Во-первых, белки обладают большим сродством к воде, т.е. они гидрофильны. Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок. Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже, и гидратная оболочка и них меньше. Таким образом, устойчивость водного раствора белка определяется двумя факторами: наличием заряда белковой молекулы и находящейся вокруг нее водной оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоидными частицами, которые в воде образуют коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полупроницаемые мембраны.
Вязкость раствора зависит от молекулярной массы и концентрации растворенного вещества. Чем выше молекулярная масса, тем раствор более вязкий. Белки как высокомолекулярные соединения образуют вязкие растворы. Например, раствор яичного белка в воде.
Чем объясняется устойчивость белковых растворов
§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Молекулярные характеристики некоторых белков
Относитель-ная молекулярная масса
Число аминокислотных остатков
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
Растворимость белков
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
Растворимость белков.
Не смотря на большой размер молекул (1-100 нм[1]), белки хорошо растворяются в воде и их растворы близки по свойствам к коллоидным растворам. Высокая стабильность белковых растворов обеспечивается факторами устойчивости.
Один из них – это наличие у белковых молекул заряда. Как выше отмечалось, только при одном строго определенном значении рН, равном изоэлектрической точке, белок нейтрален, при всех остальных значениях рН белковые молекулы имеют какой-то заряд. Благодаря наличию заряду при столкновениях молекулы белка отталкиваются друг от друга, и их объединения в более крупные частицы не происходит.
1.1.3.4. Высаливание белков.
Высаливание – это выпадение белка в осадок под действием водоотнимающих средств, к которым, в первую, очередь, относятся соли (Na2SO4,, (NH4)2SO4 и др.). Ионы солей, подобно белкам, также хорошо связывают воду. При высоких концентрациях вследствие низкой молекулярной массы солей количество их ионов огромно по сравнению с макромолекулами белков. В результате бóльшая часть воды связывается с ионами солей, что приводит значительному уменьшению гидратных оболочек у белков, снижению их растворимости и выпадением в осадок.
Наиболее эффективно высаливание при рН, равном изоэлектрической точке осаждаемого белка. В этом случае белок не только теряет гидратную оболочку, но и лишается заряда, что приводит к его полному осаждению.
Процесс высаливания не затрагивает структуру белковых молекул, и поэтому в осадок выпадает белок, сохраняющий свою нативность, т.е. свои биологические свойства.
Высаливание – процесс обратимый. При удалении водоотнимающего средства или при добавлении воды осадок белка растворяется и образуется полноценный раствор белка.
IV. Белок в растворе
Практически все глобулярные протеины прекрасно растворимы в воде. Факторы, удерживающие белок в растворе:
а) Заряд белковой молекулы. Одноименно заряженные молекулы протеина, отталкиваясь друг от друга, не могут слипаться вместе и выпадать в осадок, что способствует их нахождению в растворе.
б) Гидратная оболочка. Как уже говорилось, поверхность глобулярного белка усеяна растворимыми радикалами, поэтому вокруг таких глобул образуется плотная водная оболочка, препятствующая слипанию и осаждению белка.
Осаждение белка в водных растворах, как правило протекает в две стадии: агрегация белковых молекул и их выпадение в осадок. Этот процесс называют коагуляцией.
Различные виды осаждения можно разделить на:
1. Необратимое. Чаще всего это денатурация – это необратимое разворачивание белка в первичную нить. Он теряет четвертичную, третичную и вторичную структуры. Понятно, что при этом белок лишается не только формы, но и всех своих функций и растворимости, но сохраняет аминокислотный состав. Причинами денатурации могут быть как физические (нагревание, радиация и др.) и химические (воздействие кислот, щелочей, солей тяжелых металлов, спиртов, эфиров, и т. д.).
2. Обратимое осаждение (коагуляция) характерно для:
а) Изоэлектрического состояния – когда рН (кислотность) раствора нейтрализует заряд молекул белка, что неизбежно приводит к осаждению. При изменении кислотности в любом направлении растворимость протеина вновь восстанавливается за счет приобретения заряда.
б) Высаливание – осаждение белка при добавлении солей щелочных металлов. Ионы солей стягивают гидратные оболочки белка и нейтрализуют его заряд. Оба фактора, удерживающих белок в растворе, исчезают, что приводит к обратимой коагуляции.
Адсорбционная пептизация – вторичное растворение осажденного белка в избытке солей тяжелых металлов.
Соотношение процессов денатурации и коагуляции белка неоднозначно. Возможны три варианта:
– Денатурация с коагуляцией – возникают при кипячении в нейтральной, слабокислой или слабощелочной среде;
– Денатурация без коагуляции – происходит в сильнокислой или сильнощелочной среде:
– Коагуляция без денатурации – характерна для высаливания или изоэлектрического состояния.
Данный текст является ознакомительным фрагментом.