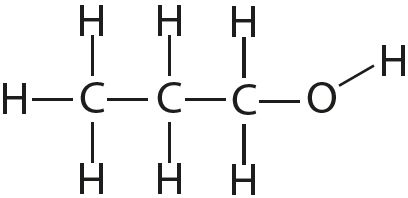
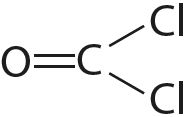
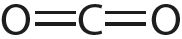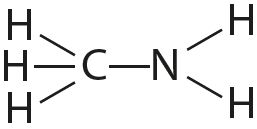Чем объясняется направленность ковалентной связи
Статья на тему «Ковалентная связь»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
I. Химическая связь. 2
II. Ковалентная связь.
1. Методы изучения ковалентной связи. 2
B. Метод валентных связей. 3
C. Метод молекулярных орбиталей. 5
1. Свойства ковалентной связи. 7
2.1. Длина связи. 7
2.2. Энергия связи. 9
2.3. Кратность ковалентной связи. 11
2.4. Насыщаемость ковалентной связи. 13
2.5. Направленность ковалентной связи. 14
2.6. Полярность и поляризуемость ковалентной связи. 16
2.7. Гибридизация. 18
3. Донорно-акцепторный механизм образования ковалентной связи. 20
Химическую связь можно определить как взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая многоатомная микросистема (молекула, кристалл, комплекс и др.).
Учение о связи занимает центральное место в современной химии, поскольку химия как таковая начинается там, где кончается изолированный атом и начинается молекула. В сущности, все свойства веществ обусловлены особенностями связей в них. Главное отличие химической связи от других видов взаимодействия между атомами заключается в том, что ее образование определяется изменением состояния электронов в молекуле по сравнению с исходными атомами. Теория связи должна дать ответы на ряд вопросов. Почему образуются молекулы? Почему одни атомы вступают во взаимодействие, а другие – нет? Почему атомы соединяются в определенных соотношениях? Почему атомы располагаются в пространстве определенным образом? И наконец, надо рассчитать энергию связи, ее длину и другие количественные характеристики.
Методы изучения ковалентной связи.
В настоящее время для изучения химической связи в основном используют два метода:
1) валентных связей;
2) молекулярных орбиталей.
1.1. Метод валентных связей.
В рамках первого метода рассматривают индивидуальные атомы, вступающие во взаимодействие, исходя из принципа завершенности электронной оболочки (правило октета). Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары. Рассмотрим квантово-механическую модель ковалентной связи по методу валентных связей на примере молекулы водорода. В 1927 г. уравнение Шрёдингера было решено для молекулы водорода немецкими физиками В.Гейтлером и Ф.Лондоном. Это была первая удачная попытка применения квантовой механики к решению проблем связи. Их работа заложила основы метода валентных связей, или валентных схем. 
Рис.1 Фото. Ф. Лондон. Рис.2. Фото. В.Гейтлер.

Рис. 3. Зависимость сил взаимодействия атомов (а) и энергии системы (б)
от расстояния между ядрами атомов в молекуле Н 2
При сближении двух атомов водорода, содержащих электроны с параллельными спинами, энергия системы постоянно увеличивается ( рис. 3, б, кривая V) и связь не образуется.
Таким образом, квантово-механический расчет дал количественное объяснение связи. При наличии у пары электронов противоположных спинов электроны двигаются в поле обоих ядер. Между ядрами появляется область с высокой плотностью электронного облака – избыточного отрицательного заряда, который стягивает положительно заряженные ядра. Из квантово-механического расчета следуют положения, являющиеся основой метода валентных связей:
Причиной связи является электростатическое взаимодействие ядер и электронов.
2. Связь образуется электронной парой с антипараллельными спинами.
3. Насыщаемость связи обусловлена образованием электронных пар.
4. Прочность связи пропорциональна степени перекрывания электронных облаков.
5. Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
Простой метод валентных связей для химика наиболее понятен, удобен и нагляден, лучше всего отвечает целям первичного обучения. Недостаток метода валентных связей состоит в том, что в его рамках нельзя объяснить некоторые экспериментальные данные.
Метод молекулярных орибиталей.
Большей эффективностью обладает метод молекулярных орбиталей, в котором рассматриваются электроны, находящиеся в поле притяжения, созданном всеми атомными ядрами молекулы. С точки зрения метода молекулярных орбиталей в молекуле нет атомов как таковых, а есть взаимно отталкивающиеся ядра и взаимодействующие с ними и между собой электроны.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1. При сближении атомов до расстояний химических связей из атомных орбиталей образуются молекулярные.
2. Число полученных молекулярных орбиталей равно числу исходных атомных.
4. При перекрывании атомных орбиталей возможно образование и 

6. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода
Рис. 4 Энергетическая диаграмма несвязанных атомов водорода.
Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше) (рис. 5).
Рис. 5 Диаграмма уровней энергии АО атомов H и МО молекулы H 2
III. Свойства ковалентной связи.
Свойства ковалентной связи: энергия, длина, полярность, насыщаемость, направленность, гибридизация, кратность.
2.1.Длина химической связи.
r (A−B) r (A) + r (B). Радиус атома водорода составляет 0,053 нм, атома фтора – 0,071 нм, а расстояние между ядрами атомов в молекуле HF равно 0,092 нм:
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Длины некоторых простых и кратных связей.
2.2. Энергия связи . Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия. Количество энергии, выделяющейся при образовании химической связи, называется энергией связи E СВ (кДж/моль).
Энергия связи является мерой прочности связи. Чем больше выделяется энергии при образовании молекулы, тем больше энергии надо затратить на разрыв, т.е. тем молекула прочнее.
Химическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r 0 ) эта энергия минимальна.
Рис. 6. Энергия химической связи.
Н 2 = 2Н; 432 кДж/моль
О 2 = 2О; 494 кДж/моль
Учитывая, что в двух молекулах воды содержится 4 связи, энергия связи кислород-водород равна:
В молекулах состава AB n последовательный отрыв атомов В сопровождается определенными (не всегда одинаковыми) затратами энергии. Например, значения энергии (кДж/моль) последовательного отщепления атомов водорода от молекулы метана существенно различаются:
При этом энергия связи А−В определяется как средняя величина затраченной энергии на всех стадиях:
СН 4 = С + 4Н; 1649 кДж/моль
Е (С−Н) = 1649 / 4 = 412 кДж/моль
Энергии некоторых простых и кратных связей.
Кратность ковалентной связи.
Рис. 7. Схема образования связей в молекуле азота: а) σ — связей; б) π – связей.

Рис. 8. Примеры σ -связей

Рис. 9. Примеры π –связей
Атом не может образовать бесконечное число ковалентных связей, оно вполне определенное. Максимальное число связей, которое может образовать атом, определяется числом его валентных электронных орбиталей. Это и определяет насыщаемость ковалентной связи. Благодаря насыщаемости связей молекулы имеют определенный состав. Численное значение валентности в методе валентных связей определяется числом ковалентных связей, которые атом образует с другими атомами. Рассмотренный для молекулы Н 2 механизм образования связи парой электронов с антипараллельными спинами, принадлежавших до образования связи разным атомам, называется обменным. Если учитывать только обменный механизм, валентность атома определяется числом его неспаренных электронов.
Очевидно, что число ковалентных связей не может превышать числа образующих связи электронных пар. Однако насыщаемость как свойство ковалентной связи означает также, что если атом имеет некоторое количество неспаренных электронов, то все они должны участвовать в образовании ковалентных связей. Это свойство объясняется принципом наименьшей энергии. При образовании каждой дополнительной связи выделяется дополнительная энергия. Поэтому все валентные возможности реализуются полностью. Действительно, устойчива молекула Н 2 S, а не НS•, где имеется нереализованная связь (неспаренный электрон обозначают точкой). Частицы, содержащие неспаренные электроны, называют свободными радикалами. Они чрезвычайно реакционноспособны и вступают в реакции с образованием соединений, содержащих насыщенные связи.
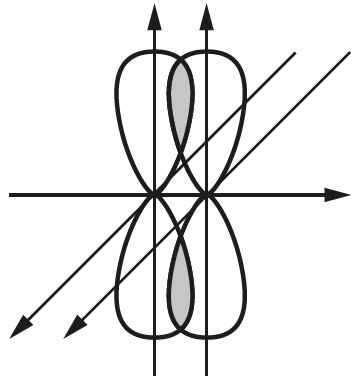
Направленность ковалентной связи.
В молекуле фтора F 2 связь образована 2р-орбиталями атомов фтора:

Рис. 10. Образование молекулы F 2

Рис. 11. Образование молекулы НF
Более сложные d- и f-орбитали также характеризуются направлениями максимальной электронной плотности вдоль осей их симметрии.
Направленность связи хорошо иллюстрирует пример молекулы сероводорода Н 2 S:
Поскольку оси симметрии валентных 3р-орбиталей атома серы взаимно перпендикулярны, то следует ожидать, что молекула Н 2 S должна иметь уголковую структуру с углом между связями S–Н 90° (рис. 12). Действительно, угол близок к расчетному и равен 92°.

Рис. 12. Образование молекулы Н 2 S
Таким образом, направленность – одно из основных свойств ковалентной связи.
Полярность и поляризуемость ковалентной связи.
Рис.13. Ковалентная неполярная связь.
Рис.14. Ковалентная полярная связь.
Гибридизация ковалентной связи .
3.Донорно-акцепторный механизм образования ковалентной связи
Все рассмотренные нами выше молекулы веществ образованы по обменному механизму. Однако нельзя забывать о еще одном способе образования ковалентной связи – донорно-акцепторном.
Пара электронов с антипараллельными спинами, образующая связь, может быть получена не только по обменному механизму, предусматривающему участие электронов обоих атомов, но и по иному механизму, называемому донорно-акцепторным: один атом (донор) предоставляет для образования связи неподеленную пару электронов, а другой (акцептор) – вакантную квантовую ячейку:
Рис. 18. Механизмы образования ковалентной связи.
Результат по обоим механизмам получается одинаковый. Часто образование связи можно объяснить и тем, и другим механизмом. Например, молекулу НF можно получить не только в газовой фазе из атомов по обменному механизму, как показано выше ( рис. 18 ), но и в водном растворе из ионов Н + и F – по донорно-акцепторному механизму:
Вне сомнений, молекулы, полученные по разным механизмам, неразличимы; связи совершенно равноценны. Поэтому правильнее не выделять донорно-акцепторное взаимодействие в особый вид связи, а считать его лишь особым механизмом образования ковалентной связи.
Когда хотят подчеркнуть механизм образования связи именно по донорно-акцепторному механизму, ее обозначают в структурных формулах стрелкой от донора к акцептору (D®А). В других случаях такую связь не выделяют и обозначают черточкой, как и по обменному механизму: D–А.
выражаются следующей схемой:
Структурную формулу NН 4 + можно представить как

Вторая форма записи предпочтительней, поскольку отражает экспериментально установленную равноценность всех четырех связей.
Образование химической связи по донорно-акцепторному механизму расширяет валентные возможности атомов: валентность определяется не только числом неспаренных электронов, но и числом неподеленных электронных пар и вакантных квантовых ячеек, участвующих в образовании связей. Так, в приведенном примере валентность азота равна четырем.
Донорно-акцепторный механизм успешно используется для описания связи в комплексных соединениях по методу ВС.
§ 14. Свойства химических связей
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 14. Свойства химических связей |
| Напечатано:: | Гость |
| Дата: | Суббота, 11 Декабрь 2021, 02:31 |
Оглавление
Свойства веществ определяются не только их элементным составом, но и особенностями химических связей между атомами.
Свойства ковалентной связи
Ковалентная связь характеризуется длиной, энергией, кратностью, насыщаемостью, направленностью и полярностью.
Длина ковалентной связи — это расстояние между ядрами химически связанных атомов ( рис. 27 ). Длина ковалентной связи обычно немного отличается от суммы атомных радиусов из-за перераспределения электронной плотности и перекрывания электронных облаков ( рис. 27–29 ). Чем больше радиусы связанных атомов, тем больше длина связи ( табл. 12 ).
Таблица 12. Характеристика ковалентных связей в молекулах водорода и галогеноводородов
| Элемент | Радиус атома, нм | Молекула | Длина связи, нм | Eсвязи, кДж/моль | Δχ | Модель молекулы |
| Н | 0,037 | H2 | 0,074 | 436 | 0 |  |
| F | 0,071 | HF | 0,092 | 565 | 1,8 | 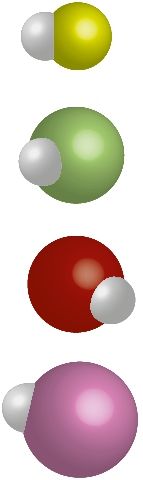 |
| Cl | 0,099 | HCl | 0,128 | 431 | 0,8 | |
| Br | 0,114 | HBr | 0,141 | 364 | 0,6 | |
| I | 0,133 | HI | 0,161 | 297 | 298 |
Энергия химической связи (Eсвязи) — это энергия, которую необходимо затратить на её разрыв. Как правило, чем прочнее связь, тем меньше её длина ( табл. 12 ).
Кратностью ковалентной связи называют число электронных пар, которые участвуют в образовании химической связи между двумя атомами.
Различают одинарные ( ), двойные ( ) и тройные ( ) связи. При перекрывании орбиталей вдоль линии, соединяющей ядра атомов, образуются только σ-связи ( рис. 28 ).
Направленность ковалентных связей определяется ориентацией в пространстве атомных орбиталей, участвующих в образовании связи. Она обусловливает пространственную структуру молекул ( рис. 31 ).
Угол, образованный направлениями химических связей, исходящими из одного атома, называют валентным углом.
Например, вам известно, что в молекуле CH4 связи расположены под углом приблизительно 109°, в молекуле — 120°, в молекуле — 180°.
В молекулах Н2О и Н2S атомы кислорода и серы образуют две σ-связи с атомами водорода. В образовании этих связей участвуют p-орбитали внешнего энергетического уровня, которые ориентированы взаимно перпендикулярно. Это значит, что валентные углы между линиями связи О—Н или S—H должны быть близки к 90°. Однако реальные значения этих углов немного больше из-за взаимного отталкивания атомов водорода ( рис. 32 ). Так, в молекуле воды, находящейся в парах, этот угол равен 104,5°, а в молекуле Н2S — 92° (отталкивание слабее из-за большего радиуса атома серы).
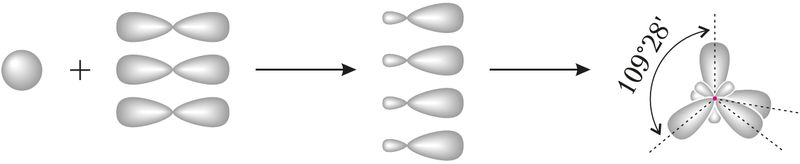
Для прогнозирования и объяснения величины валентных углов во многих молекулах часто используют представления о гибридизации атомных орбиталей. Начальные представления о гибридизации вы получили в курсе органической химии в 10-м классе. С учётом гибридизации можно объяснить строение молекул СН4, NH3, H2O. При гибридизации атомных орбиталей атома, образующего связи с соседними атомами, происходит усреднение по форме и энергии электронной плотности близких по энергии орбиталей. Например, при усреднении энергии одной s-орбитали и трёх р-орбиталей данного атома углерода образуются четыре одинаковые гибридные орбитали, которые располагаются по направлению к вершинам тетраэдра:
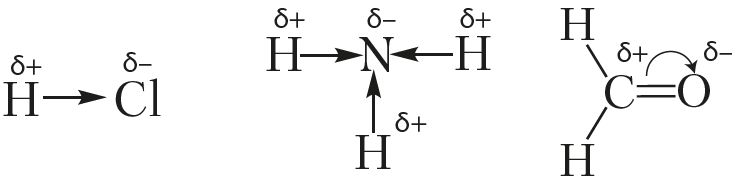
Смещение электронной плотности указывают в структурных формулах стрелками, направленными в сторону более электроотрицательного атома. Смещение электронной плотности при образовании σ-связи указывают прямой стрелкой, а π-связи — дугой:
Молекулу, электронное строение которой описывается как система из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определённом расстоянии друг от друга, называют диполем.
Молекулы, представляющие собой диполи, называют полярными. Полярными являются молекулы галогеноводородов, сероводорода, воды. Так, в молекуле воды электронная плотность от атомов водорода смещена к более электроотрицательному атому кислорода. Молекулы воды — это диполи ( рис. 33 ).
Свойства ионной и металлической связей
В отличие от ковалентной связи ионная связь ненаправленная и ненасыщаемая, поскольку ион может притягивать к себе ионы противоположного знака в любом направлении. Расположение и число соседних ионов определяется их размерами, силами притяжения и отталкивания между ионами разных знаков. Поэтому ионы располагаются в определённом порядке, образуя кристаллическую решётку.
Ковалентная связь характеризуется длиной, энергией, кратностью, направленностью и полярностью:
Ионная и металлическая связи ненаправленные и ненасыщаемые.
Вопросы, задания, задачи
1. Опишите, как образуется:
2. Заполните таблицу, поставив в ячейки под каждой химической связью подходящее значение энергии (167; 945; 418 кДж/моль ) и длины связи (0,145; 0,110; 0, 125 нм ). Объясните свой выбор.
| Связь |
| Энергия, кДж/моль |
| Длина, нм |
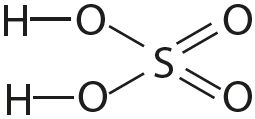
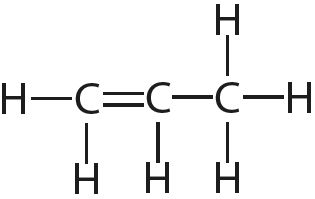
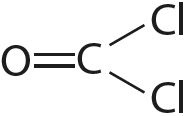
3. Укажите число одинарных и кратных связей в каждой молекуле:
4. Отметьте полярные и неполярные ковалентные связи:
5. Объясните, почему и как меняется длина связи между атомами в ряду:
7. Объясните уменьшение термической устойчивости соединений в ряду: Н2О, Н2S, Н2Se.
8. Объясните, почему молекулы водорода и фтора вступают во взаимодействие мгновенно, а для взаимодействия молекул водорода и азота нужны высокие температура и давление.
9. Нарисуйте схему перекрывания атомных 1s— и 3p-орбиталей в молекуле H2X, если относительная плотность этого газообразного соединения по водороду равна 17.
1. Направленностью и насыщаемостью характеризуется связь:
2. Две связывающие и две несвязывающие электронные пары содержат молекулы:
3. σ-Связи соответствует перекрывание орбиталей:
4. Длина связи в первой молекуле больше, чем во второй, в паре веществ: