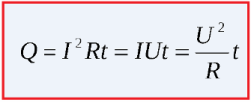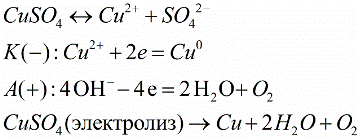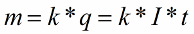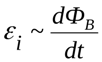Чем объясняется химическое действие тока
Глава третья. Химические действия электрического тока
§ 19. Электрический ток в электролитах
До сих пор мы рассматривали случаи, когда электрический ток проходит через металлические проводники. При этом прохождение электрического тока обусловлено упорядоченным движением свободных электронов. При прохождении электрического тока через металлические проводники переноса частиц вещества самого проводника не происходит. Такие проводники называются проводниками первого рода.
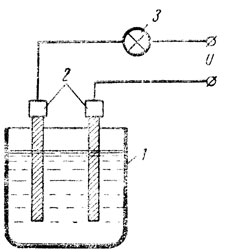
Рассмотрим теперь процесс прохождения тока через жидкости. Соберем схему, показанную на рис. 43. В сосуд 1 налита дистиллированная вода. В воду опущены два угольных стержня 2 (электроды). В цепь включена лампа накаливания 3. При подаче напряжения на зажимы цепи лампа гореть не будет. Значит чистая вода тока не проводит. Если бросить в воду щепотку поваренной соли, то лампа ярко загорится. Следовательно, раствор поваренной соли в воде хорошо проводит электрический ток. Водные растворы всех кислот, щелочей и солей проводят ток. Вещества, растворы которых проводят электрический ток, называются электролитами. Соли и щелочи проводят ток не только в растворе, но и в расплавленном состоянии.
Рис. 43. Определение проводимости растворов
Чем же объясняется способность электролитов проводить электрический ток?
Распад электролита на ионы при растворении его в воде называется электролитической диссоциацией.
При растворении в воде сахара происходит только распад кристаллов, и ионов не образуется. Поэтому раствор сахара тока не проводит.
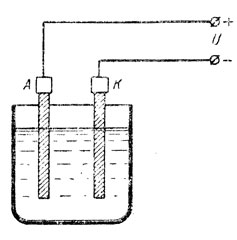
Рис. 44. Электролиз
Процесс разложения электролита при пропускании через него электрического тока называется электролизом.
Разложение электролита под действием тока показывает, что внутри электролита происходит движение атомов или групп атомов, представляющее собой части молекулы растворенного вещества.
Итак, электрический ток в электролитах представляет собой движение положительных и отрицательных ионов. В отличие от металлических проводников, которые не разлагаются током и называются проводниками первого рода, электролиты называются проводниками второго рода.
Химическое действие электрического тока



Растворы солей и кислот в воде или в каком-либо другом растворителе проводят электрический ток и называются электролитами или проводниками второго рода в отличие от металлических проводников, называемых проводниками первого рода.
Электрический ток может проходить через среды, имеющие электрически
заряженные частицы, обладающие способностью перемещаться.
При растворении солей и кислот в воде или в каком-либо ином растворителе (этиловый спирт, бензин, бензол и др.) часть молекул распадается на две части, называемые ионами, причем одна часть имеет положительный заряд, другая — отрицательный заряд.
Если в сосуд с электролитом погружены две металлические пластины, называемые электродами, которые при помощи проволочных проводников присоединены к
источнику энергии постоянного тока, то вследствие разности потенциалов между электродами через электролит будет протекать ток.
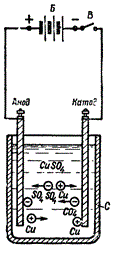
Прохождение тока через электролит сопровождается химическим процессом, называемым электролизом. Находящиеся в электролите ионы, притягиваясь к электродам, двигаются в противоположных направлениях: положительные ионы — к катоду, а отрицательные ионы — к аноду.
Подойдя к катоду, положительные ионы получают от него недостающие им электроны и образуют электрически нейтральные атомы. На аноде происходит обратный процесс: отрицательные ионы отдают аноду свои избыточные электроны.
При прохождении электрического тока через электролит на электродах выделяется определенное количество веществ, содержащихся в виде химического соединения в электролите.
Зависимость выделенного вещества от силы тока устанавливается
двумя законами Фарадея.
Первый закон Фарадея сформулирован так:количество вещества, выделившегося на электродах при прохождении тока через электролит, прямо пропорционально количеству электричества, прошедшему, через электролит.
При прохождении одного кулона электричества из электролита выделяется определенное количество массы вещества, которое называется электрохимическим эквивалентом данного вещества.
В практических расчетах для определения количества электричества удобнее пользоваться не кулонами, а ампер-часами (А-ч).
Так как один кулон равен ампер-секунде, то между ампер-часом и кулоном имеет место следующее соотношение:1 А-ч=3600 А-с=3600 Кл.
Второй закон Фарадея гласит:при одном и том же количестве электричества, протекающего через различные электролиты, количества массы веществ, выделившихся на электродах, пропорциональны их химическим эквивалентам.
Из сопоставления 1-го и 2-го законов Фарадея вытекает, что электрохимические эквиваленты К пропорциональны их химическим эквивалентам, т. е.
К1/а1=К2/а2=К3/а3 =.
Следовательно, отношение электрохимических эквивалентов к их химическим эквивалентам является величиной постоянной и равной
К/а = 3,72/100 = 0,0372;
Итак, второй закон Фарадея может быть выражен следующим образом.
К = а х 0,0372;
Электролиз получил широкое применение в различных отраслях промышленности: в гальванопластике, гальваностегии, для очистки (рафинирования) металлов и др.
Гальванические элементы
Проводники первого рода (твердые) и второго рода (жидкие электролиты) совместно используются в гальванических элементах, служащих источниками постоянного тока.
В гальванических элементах во время их работы происходит движение ионов и оседание на электродах элемента, выделяющегося из 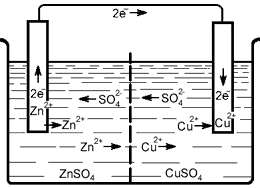
Простейшим гальваническим элементом является медно-цинковый.
В стеклянный сосуд, наполненный раствором серной кислоты в воде, погружены медная и цинковая пластины, которые представляют собой положительный и отрицательный полюсы элемента.
При замыкании цепи элемента каким-либо проводником внутри этого элемента будет проходить ток от цинковой отрицательной пластины к медной положительной, а во внешней цепи от медной к цинковой.
Под действием тока внутри элемента положительные ионы водорода движутся по направлению тока, отрицательные ионы кислотного остатка — в противоположном направлении.
Соприкасаясь с медной пластиной, положительные ионы водорода отдают ей свои заряды, а водород в виде пузырьков газа скопляется на ее поверхности.
В это же время отрицательные ионы остатка серной кислоты отдают свои заряды цинковой пластине. Таким образом происходит непрерывный заряд пластин элемента, поддерживающий разность потенциалов (напряжение) на его зажимах.
Выделение водорода на медной пластине элемента ослабляет его действие — поляризует элемент.
Явление поляризации состоит в том, что скопляющийся на положительном электроде водород создает в совокупности с металлом электрода дополнительную разность потенциалов, называемую электродвижущей силой поляризации. Эта эдс направлена противоположно электродвижущей силе элемента.
Кроме того, пузырьки водорода, покрывающие часть медной пластины, уменьшают ее действующую поверхность, а это увеличивает внутреннее сопротивление элемента.
Поляризация в рассмотренном элементе настолько значительна, что делает его непригодным для практических целей.
Для устранения явления поляризации в состав элемента вводят поглотитель (деполяризатор), который предназначен для поглощения водорода и недопускает скопления его на положительном полюсе элемента.
Деполяризаторами могут служить химические препараты, богатые кислородом или хлором.
Электродвижущая сила медно-цинкового элемента равна 1,1 В, а внутреннее сопротивление в зависимости от времени работы — 5—10 Ом.
В угольно-цинковом элементе положительным полюсом служит угольная пластина,
а отрицательным — цинковый стержень.
Деполяризатором в этом элементе является спрессованная под большим давлением смесь, называемая агломератом. Она состоит из перекиси марганца и графита.
В качестве электролита в угольно-цинковом элементе применяют водный раствор хлористого аммония.
Электродвижущая сила угольно-цинкового элемента 1,4—1,5 В в начале разряда при среднем значении 0,9—1,1 В, а внутреннее сопротивление в зависимости от конструкции элемента — 0,25—0,7 Ом в начале разряда и 1,4—5 Ом в конце.
Затем элемент заливают смолой, в которую вставляют трубку. Назначение этой трубки — удалять образующиеся внутри элемента газы.
На выходящий из смолы угольный электрод насаживают медный колпачок с
винтом и гайкой для присоединения проводника.
К верхней части цинковой коробки (отрицательному полюсу) припаивают изолированный гибкий проводник. На дно коробки укладывают изолирующую прокладку.
В галетном элементе отрицательным электродом является цинковая пластина, положительным — спрессованный в виде галеты порошок двуокиси марганца с углем.
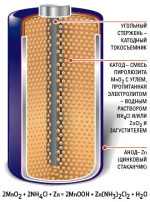
Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности.
В качестве изоляции применяют хлорвиниловые пленки.
Галетные элементы компактны и их активные материалы (особенно цинк) используются лучше, чем в стаканчиковых элементах.
Аккумуляторы
Аккумулятором называется прибор, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию в результате химических процессов.
В аккумуляторе, как и в гальваническом элементе, электрический ток является следствием химических процессов.
Но в отличие от аккумулятора в гальваническом элементе получающиеся химические соединения не могут быть вторично разложены и приведены в первоначальное состояние током постороннего источника.
Поэтому гальванические элементы называются первичными, а аккумуляторы — вторичными или обратимыми.
Повторные заряд и разряд не только не вредят аккумулятору, но даже улучшают его свойства, так как в работе участвуют все более глубокие слои пластин электродов.
В зависимости от состава электролита аккумуляторы могут быть кислотными и щелочными.
Простейший кислотный аккумулятор
состоит из двух свинцовых пластин (электродов), погруженных в электролит, которым служит вода с небольшим добавлением серной кислоты.
Постоянный ток постороннего источника, проходя через электролит, разлагает его на составные части.
Внутри электролита возникает движение положительных ионов водорода Н2 к пластине, соединенной с отрицательным зажимом источника тока, и отрицательных ионов кислорода О к пластине, соединенной с положительным зажимом источника тока.
В результате электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном электроде.
Если аккумулятор отключить от источника тока и замкнуть на какой-нибудь приемник энергии, то аккумулятор сам станет источником тока подобно гальваническому элементу, у которого электродами служат пластины, отличающиеся друг от друга по химическому составу.
Электролитом в кислотных аккумуляторах, как указывалось выше, служит раствор кислоты определенной плотности.
— Плотностью раствора называется число, показывающее, во сколько раз масса этого раствора больше массы воды того же объема.
— При составлении раствора для аккумуляторов серную кислоту тонкой струей наливают в воду.
— Нельзя вливать в серную кислоту воду, так как произойдёт бурное разбрызгивание кислоты, которая может причинить ожоги.
— Вода для электролита должна быть дистиллированной.
— Эдс аккумулятора зависит от плотности электролита и не зависит от его размеров и номинальной емкости.
— В процессе заряда и разряда аккумулятора плотность злектролита не остается постоянной, в связи с этим изменяется как его эдс, так и напряжение на его 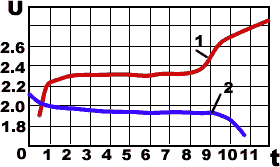
График изменения напряжения
кислотного аккумулятора:
1 — при заряде,
2 — при разряде.
Количество электричества, которое аккумулятор может отдать при разряде определенным током до наинизшего допустимого напряжения, называется его емкостью.
Она равна произведению разрядного тока в амперах на продолжительность времени разряда в часах и выражается в ампер-часах.
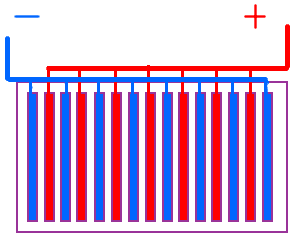
Схема соединения пластин кислотного аккумулятора.
Под номинальной емкостью понимают то количество электричества, которое отдает полностью заряженный аккумулятор при
10-часовом режиме разряда и температуре 25°С.
Таким образом, аккумулятор отдает номинальную емкость, разряжаясь в течение 10 ч током, численно равным 0,1 величины его номинальной емкости.
При увеличении разрядного тока емкость аккумулятора уменьшается, так как поверхность пластин покрывается сернокислым свинцом и затрудняет доступ электролита к внутренним слоям активной массы.
При понижении температуры увеличивается вязкость электролита, что также затрудняет его доступ к внутренним слоям активной массы и уменьшает емкость аккумулятора.
Для увеличения емкости аккумулятора несколько одноименных пластин соединяют параллельно.
Каждая группа положительных и отрицательных пластин работает как одна большая пластина, площадь которой равна сумме площадей параллельно соединённых пластин.
Так как положительные пластины должны находиться между отрицательными, число отрицательных пластин всегда на одну больше числа положительных.
При этом условии обе стороны положительных пластин вступают во взаимодействие с электролитом ( при односторонней работе положительные пластины коробятся и при соприкосновении с отрицательными пластинами может произойти короткое замыкание ).
Стационарные кислотные аккумуляторы изготовляют в стеклянных или керамических сосудах. Аккумуляторы больших емкостей имеют сосуды деревянные, выложенные внутри свинцом или кислотостойким изоляционным материалом.
Кислотные аккумуляторы применяют на электротехнических установках стационарного типа и на автотранспорте.
В качестве переносных аккумуляторов используют преимущественно щелочные аккумуляторы.
Щелочные аккумуляторы.
Сосуды щелочных аккумуляторов сваривают из тонкой листовой стали и с наружной стороны никелируют. В центре крышки сосуда имеется отверстие для заливки аккумуляторов электролитом.
Эдс щелочных аккумуляторов зависит от состояния активной массы пластин. От температуры и плотности электролита эдс зависит незначительно и только при низких температурах, близких к нулю, она резко изменяется.
Напряжение в конце заряда аккумулятора равно 1,8 В, по окончании заряда — 1,5—1,55 В;
эдс разряженного аккумулятора — 1,3 В.
Достоинством щелочных аккумуляторов является то, что
— они не требуют тщательного ухода;
— не боятся сотрясений;
— могут длительно оставаться в разреженном состоянии;
— выносят короткие замыкания, которые для кислотных аккумуляторов представляют большую опасность;
— саморазряд у щелочных аккумуляторов меньше, чем укислотных.
В зависимости от материала электродов щелочные аккумуляторы могут быть кадмиево-никелевые, железо-никелевые, серебряно-цинковые, золото-цинковые и газовые.
Применение в массовом масштабе золото-цинковых аккумуляторов ограничивается их высокой стоимостью.
Газовые аккумуляторы отличаются легкостью и дешевизной, но технология их производства недостаточно разработана.
Наиболее широкое распространение получили кадмиево-никелевые ( КН )
и железоникелевые ( ЖН ) аккумуляторы, электролитом которых служит раствор едкого кали в воде; плотность электролита 1,2.
По своему устройству и электрическим данным аккумуляторы КН и ЖН незначительно отличаются друг от друга.
Активную массу запрессовывают в брикеты ( пакеты ), а затем из брикетов собирают отдельные пластины.
У аккумуляторов типа ЖН отрицательных пластин на одну больше, чем положительных.
У аккумуляторов типа КН положительных пластин на одну больше, чем отрицательных.
Один из полюсов аккумулятора соединяется с сосудом (у ЖН — отрицательный,
а у КН — положительный полюс).
Серебряно-цинковый аккумулятор представляет собой пластмассовый сосуд, в котором помещены положительные и отрицательные электроды, составленные из отдельных пластин.
Отрицательные электроды, изготовленные из пластин окиси цинка, заключены в защитные пакеты из материала, который хорошо пропускает электролит, но задерживает металлические частицы.
Положительные пластины изготовлены из серебра.
Для составления аккумуляторной батареи или батареи гальванических элементов несколько элементов соединяют последовательно, т. е.
катод первого аккумулятора соединяют с анодом второго,
катод второго — с анодом третьего и т. д.
Получившиеся таким образом свободные электроды, а именно, анод первого элемента и катод последнего являются соответственно положительным и отрицательным полюсами аккумуляторной батареи.
При определении эдс аккумуляторной батареи из n кислотных аккумуляторов или гальванических элементов с эдс одного элемента Ео и внутренним сопротивлением Ro эдс батареи Е = nЕ0 и внутреннее сопротивление R = nR0.
Действия электрического тока: тепловое, химическое, магнитное, световое и механическое

Вообще, электрический ток способен вызывать различные действия: тепловое, химическое, магнитное (электромагнитное), световое или механическое, причем разного рода действия тока зачастую проявляются одновременно. Об этих явлениях и действиях тока и пойдет речь в данной статье.
Тепловое действие электрического тока
При прохождении постоянного или переменного электрического тока по проводнику, проводник нагревается. Такими нагревающимися проводниками в разных условиях и приложениях могут выступать: металлы, электролиты, плазма, расплавы металлов, полупроводники, полуметаллы.
Выделяемое на участке цепи количество теплоты зависит от приложенного к этому участку напряжения, значения протекающего тока и от времени его протекания (Закон Джоуля — Ленца).
Преобразовав закон Ома для участка цепи, можно для вычисления количества теплоты использовать либо напряжение, либо силу тока, но тогда обязательно необходимо знать и сопротивление цепи, ведь именно оно ограничивает ток, и вызывает, по сути, нагрев. Или, зная ток и напряжение в цепи, можно так же легко найти количество выделяемой теплоты.
Химическое действие электрического тока
Электролиты, содержащие ионы, под действием постоянного электрического тока подвергаются электролизу — это и есть химическое действие тока. К положительному электроду (аноду) в процессе электролиза притягиваются отрицательные ионы (анионы), а к отрицательному электроду (катоду) — положительные ионы (катионы). То есть вещества, содержащиеся в электролите, в процессе электролиза выделяются на электродах источника тока.
Например, в раствор определенной кислоты, щелочи или соли погружают пару электродов, и при пропускании электрического тока по цепи на одном электроде создается положительный заряд, на другом — отрицательный. Ионы содержащиеся в растворе начинают откладываться на электроде с противоположным зарядом.
Химическое действие электрического тока используется в промышленности, например, для разложения воды на составляющие ее части (водород и кислород). Также электролиз позволяет получать некоторые металлы в чистом виде. С помощью электролиза покрывают тонким слоем определенного металла (никеля, хрома) поверхности — это нанесение гальванических покрытий и т.д.
В 1832 году Майкл Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит. Если через электролит пропускается в течение времени t постоянный ток I, то справедлив первый закон электролиза Фарадея:
Здесь коэффициент пропорциональности k называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Магнитное действие электрического тока
При наличии электрического тока в любом проводнике (в твердом, жидком или газообразном) наблюдается магнитное поле вокруг проводника, то есть проводник с током приобретает магнитные свойства.
Так, если к проводнику, по которому течет ток, поднести магнит, например в виде магнитной стрелки компаса, то стрелка повернется перпендикулярно проводнику, а если намотать проводник на железный сердечник, и пропустить по проводнику постоянный ток, то сердечник станет электромагнитом.
В 1820 году Эрстед открыл магнитное действие тока на магнитную стрелку, а Ампер установил количественные закономерности магнитного взаимодействия проводников с током.
В 1831 году, Фарадей установил, что изменяющееся магнитное поле от одного контура порождает ток в другом контуре: генерируемая ЭДС пропорциональна скорости изменения магнитного потока. Логично, что именно магнитное действие токов используется по сей день и во всех трансформаторах, а не только в электромагнитах ( например, в промышленных).
Световое действие электрического тока
В простейшем виде световое действие электрического тока можно наблюдать в лампе накаливания, спираль которой разогревается проходящим через нее током до белого каления и излучает свет.
Для лампы накаливания на световую энергию приходится около 5% от подведенной электроэнергии, остальные 95% которой преобразуется в тепло.
Люминесцентные лампы более эффективно преобразуют энергию тока в свет — до 20% электроэнергии преобразуется в видимый свет благодаря люминофору, принимающему ультрафиолетовое излучение от электрического разряда в парах ртути или в инертном газе типа неона.
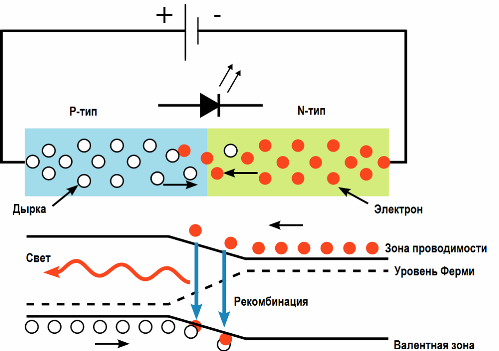
Более эффективно световое действие электрического тока реализуется в светодиодах. При пропускании электрического тока через p-n переход в прямом направлении, носители заряда — электроны и дырки — рекомбинируют с излучением фотонов (из-за перехода электронов с одного энергетического уровня на другой).
Лучшие излучатели света относятся к прямозонным полупроводникам (то есть к таким, в которых разрешены прямые оптические переходы зона-зона), например GaAs, InP, ZnSe или CdTe. Варьируя состав полупроводников, можно создавать светодиоды для всевозможных длин волн от ультрафиолета (GaN) до среднего инфракрасного диапазона (PbS). КПД светодиода как источника света доходит в среднем до 50%.
Механическое действие электрического тока
Как было отмечено выше, каждый проводник, по которому течет электрический ток, образует вокруг себя магнитное поле. Магнитные действия превращаются в движение, например, в электродвигателях, в магнитных подъемных устройствах, в магнитных вентилях, в реле и т. д.
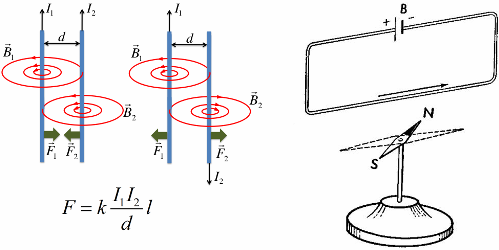
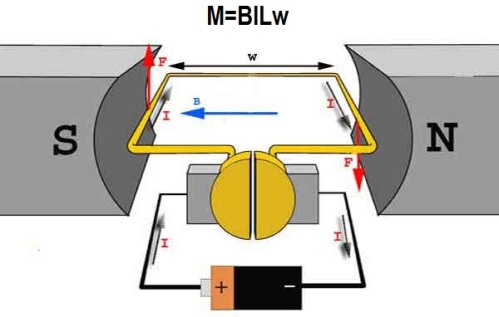
Механическое действие одного тока на другой описывает закон Ампера. Впервые этот закон был установлен Андре Мари Ампером в 1820 для постоянного тока. Из закона Ампера следует, что параллельные проводники с электрическими токами, текущими в одном направлении, притягиваются, а в противоположных — отталкиваются.
Законом Ампера называется также закон, определяющий силу, с которой магнитное поле действует на малый отрезок проводника с током. Сила, с которой магнитное поле действует на элемент проводника с током, находящегося в магнитном поле, прямо пропорциональна току в проводнике и векторному произведению элемента длины проводника на магнитную индукцию.
На этом принципе основана работа электродвигателей, где ротор играет роль рамки с током, ориентирующейся во внешнем магнитном поле статора вращающим моментом M.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети: