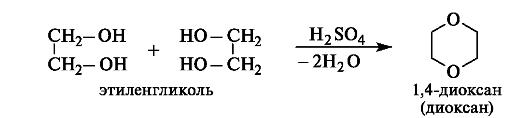Чем объясняется большая реакционная способность глицерина по сравнению с алканолами
Чем объясняется большая реакционная способность глицерина по сравнению с алканолами
Взаимодействие алкоголята и углеводорода:
Физические свойства простых эфиров
Химические свойства простых эфиров
Простые эфиры — малоактивные соединения, их реакционная способность гораздо ниже, чем у спиртов. Хорошо растворяют многие органические вещества, и поэтому часто используются как растворители.
Одноатомные высшие твердые спирты встречаются в виде сложных эфиров высших кислот (спермацет, пчелиный, растительный воски ).
Полимеры на основе эфиров виниловых спиртов имеют большое практическое значение.
Этиленгликоль используется как пластификатор и в производстве синтетических волокон.
Глицерин широко применяется в парфюмерии, пищевой промышленности, в фармакологии, для получения нитроглицерина, в природных условиях он распространен в виде сложных эфиров с высокомолекулярными карбоновыми кислотами ( жиры ).
Многоатомные спирты часто встречаются в природных продуктах (ксилит, сорбит). Многоатомные спирты ряда циклогексана (циклические) также встречаются в природе: кверцит (в желудях), инозит (в семенах многих растений).
Ненасыщенные спирты являются составной частью эфирных масел растений: цитронеллол — выделен из розового масла, гераниол — из эфирного масла герани, фарнезол — из эфирного масла липы, фитол встречается в природных условиях в виде сложного эфира — хлорофилла — зеленого пигмента растений.
Презентация по химии на тему «Реакционная способность спирта»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Описание слайда:
Описание слайда:
Содержание
1. Спирты
2. Классификация спиртов
3. Изомерия спиртов
5. Типы реакций
6. Окисление
4. Физические и химические
свойства спиртов
Описание слайда:
Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных групп, связанных с углеводородным радикалом.
Описание слайда:
2
По количеству гидроксильных групп
3
По характеру атома водорода, с которым связанна гидроксильная группа
1
По характеру углеродного радикала
Описание слайда:
Предельные
Классификация спиртов
По характеру углеродного радикала
CH2-OH
Непредельные
Title
Add your text
СПИРТЫ
Описание слайда:
Циклоалконолы
Алкенолы
Фенолы
Алкинолы
R(OH)x
Алканолы
По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
Описание слайда:
Одноатомные
(Этиловый спирт)
Классификация спиртов
по количеству гидроксильных групп
CH2-CH-CH2-OH
I I I
OH OH OH
Трехатомные
(Глицерин)
CH2-CH-CH2-OH
I I
OH OH
Двухатомные
(Этиленгликоль)
Title
Add your text
СПИРТЫ
Описание слайда:
Третичные
(2-метилпропанол-2)
CH3-CH2-CH-OH3
I
OH
Описание слайда:
Описание слайда:
Описание слайда:
Изомерия спиртов
изомерия положения гидроксильной
группы в углеродной цепи
изомерия углеродного скелета.
Алканы
Для алканолов характерны два вида изомерии:
Описание слайда:
Изомерия положения гидроксильной группы в углеродной цепи
CH3-CH2-CH2-OH пропанол
н-пропиловый спирт
CH3-CH-CH
l
OH
пропанол-2
(изопропиловый спирт)
Описание слайда:
CH3-CH2-CH2-CH2-OH
бутанол-1
(н-бутиловый спирт)
CH3-CH-CH2-OH
l
CH3
2-метилпропанол-1
(изобутиловый спирт)
Первым из спиртов, для которого характерны оба вида изомерии, является бутанол
Изомерия углеродного скелета
Описание слайда:
Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматный запах.
Описание слайда:
Температура кипения
Метиловый (метанол)
Этиловый(этанол)
Пропиловый (пропанол)
Бутиловый (бутанол-1)
Амиловый (пентанол-1)
64,7
78,3
97,2
117,7
137,8
Температура кипения спиртов
Название спирта
Формула
Температура кипения
СН3ОН
С2Н5ОН
С3Н7ОН
С4Н9ОН
С5Н11ОН
Описание слайда:
Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи О–Н и неподелёнными электронными парами атомов кислорода. Такое взаимодействие называют водородной связью
Описание слайда:
Описание слайда:
Описание слайда:
Типы реакций
Реакции окисления
Реакция замещения атомов водорода группы ОН
Реакция замещения атомов водорода ОН группы
Реакция дегидратации (отщепления молекулы воды)
Для алканолов характерно 4 типа реакций:
Описание слайда:
Описание слайда:
Реакция замещения –ОН группы
Наибольшее практическое значение из реакций второго типа имеют реакции замещения гидроксильной группы на галогены. Данная реакция может осуществляться при действии на алканолы различных галогеноводородных кислот
Описание слайда:
R – OH + H – X ↔ R – X + H2O
Реакционная способность алканолов
R3С – OH > R2CH – OH > RCH2 – OH
Реакционная способность HX
HI > HBr > HCl >> HF
Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота
Реакции алканолов
Описание слайда:
Описание слайда:
Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их с избытком концентрированной H2SO4 при темпе- ратуре 150-200ºС или при пропускании спиртов над нагретыми твёрдыми катализаторами.
Описание слайда:
Описание слайда:
Дегидратация вторичных спиртов
При дегидратации вторичных спиртов возможно протекание различных перегруппировок, приводящих к получению изомерной смеси алкенов.
Описание слайда:
Описание слайда:
Реакции окисления
Окисление спиртов проис-ходит и под действием силь-ных окислителей. Характер получаемых при этом продук-тов определяется степенью замещённости спиртов, а так-же природой применяемого окислителя
Описание слайда:
Кислородсодержащие органические вещества, как и углеводороды, горят на воздухе или в кислороде с образованием паров воды и углекислого газа. Горение спиртов – сильно экзотермическая реакция, поэтому они могут быть использованы в качестве высококалорийного топлива.
CnH2n+1OH+O2 nCO2+(n+1)H2O+Q
Описание слайда:
Окисление первичных спиртов до карбоновых кислот протекает при действии HNO3 или перманганата калия в щелочной среде.
Окисление вторичных спиртов приводит к образованию соответствующих кетонов.
Описание слайда:
Окисление спиртов оксидом меди приводит к образованию альдегидов
Описание слайда:
Описание слайда:
Третичные спирты могут окисляться только в жёстких условиях, при действии сильных окислителей. Реакции сопровождаются разрывом С – С связей у α-углеродных атомов и образованием смеси карбонильных соединений
Описание слайда:
Метанол и этанол
CO+2H2
СН3ОН
250-3500C, 5-30MПа
ZnO+ZnCr2O4
СO2+3H2
CH3OH+H2O
t0
кат
Метанол получают гидрированием оксида углерода (II) СО. В настоящее время разработан способ получения метанола частичным восстановлением углекислого газа. При этом используется более дешёвое углеродсодержащее сырьё, но требуется большой объём водорода.
Описание слайда:
Применение отдельных представителей
Применение этанола
Описание слайда:
Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
С6H10O5)n+nH2O
C6H12O6
зимаза
2С2Н5OH+2CO2
Описание слайда:
Мировое производство мета-нола составляет около 10 мил-лионов тонн в год, этанола производится примерно на порядок больше. Метанол и этанол применяются в качестве растворителей и сырья в орга-ническом синтезе. Кроме того этанол используют в пищевой промышленности и в медицине.
Описание слайда:
Запомни
Водородная связь – это связь между атомом водорода одной молекулы и атомами с большой электоотрицательностью ( О,F,N,Cl) другой моле-кулы.
Реакция этерификации – взаимодействие спир-тов с органическими и неорганическими кислотами с образованием сложных эфиров.
Описание слайда:
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Охрана труда
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
Курс профессиональной переподготовки
Охрана труда
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Похожие материалы
Зачетная работа по английскому языку
«Роль конструктивных задач в формировании умственной активности дошкольников»
Орта білім мазмұнын жаңарту бағдарламасы аясында қазақ тілі мен әдебиеті пәніндегі оқу мақсаттар жүйесі
Презентация открытого урока по теме: «САПР AutoCad. Построение прямоугольной изометрии»
Қазақстан Республикасының Конституциялық құрылымы мен мазмұны
Презентация к внеклассному мероприятию «Зоя Космодемьянская»
Урок русского языка на тему «Подготовка к сочинению в формате ЕГЭ» (11 класс)
Презентация Разработка системы творческих заданий для учащихся
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5376492 материала.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
В Оренбурге школьников переведут на дистанционное обучение с 9 декабря
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Учителям истории предлагают предоставить право бесплатно посещать музеи
Время чтения: 2 минуты
Минпросвещения намерено расширить программу ускоренного обучения рабочим профессиям
Время чтения: 2 минуты
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Большая Энциклопедия Нефти и Газа
Большая реакционная способность
Большая реакционная способность магний-йодметила ограничивает его применение при исследовании смесей и анализе полифункциональных соединений. [2]
Большая реакционная способность акрилонитрила определяется наличием двойной связи, сопряженной со связью в циан-группе. В дополнение к обычным реакциям этих двух функциональных групп акрилонитрил вступает в реакцию с большим числом соединений, содержащих активные атомы водорода. Эта реакция широко известна как реакция цианэтилирования; подробно о ней будет сказано в разделе химических свойств. [3]
Большая реакционная способность алкоголятов обусловливает широкое применение их в разнообразных синтезах. [5]
Большая реакционная способность цианид-иона по сравнению с бисульфитным ионом, подтверждается также и тем, что циангидрины образуют и ароматические метилкетоны. Циангидрин ацетофенона, например, получают обработкой кетона цианидом и цианистым водородом. [6]
Большая реакционная способность диазосоединений создает возможность замещения ях на другие атомы или группы. Возможно замещение диазогруппы на Н, ОН, OAlk, OAr, C1, Вг, J, CN, SH и др. Эти превращения имеют большое теоретическое и практическое значение. [7]
Большая реакционная способность алкоголятов обусловливает широкое применение их в разнообразных синтезах. [8]
Большая реакционная способность изоцианатов по отношению к гидроксилсодержащим соединениям исключает возможность использования в качестве растворителей для полиуретанов спиртов и целлозольвов. [10]
Большая реакционная способность пентаэритрита ( наличие в молекуле четырех сс-гидроксильных групп) по сравнению с глицерином способствует ускоренному отверждению покрытий, но в то же время создает опасность быстрой желатинизации реакционной массы в процессе получения смолы. Поэтому пентаэритрит применяют в основном для изготовления жирных смол, модифицированных высыхающими или полувысыхающими маслами. При работе методом алкоголиза или ацидолиза масел получаются смешанные полиэфиры пентаэритрита и глицерина. [11]
Большая реакционная способность нитрогруппы и хлора в ни-тропроизводных трихлорбензола позволяет широко применять их для синтеза самых разнообразных продуктов. [13]
Большая реакционная способность изоцианатов по отношению к гидроксилсодержащим соединениям исключает возможность использования в качестве растворителей для полиуретанов спиртов и целлозольвов. [14]
Спирты
Цель урока: 1)практическое изучение физических и химических свойств предельных одноатомных, многоатомных спиртов;
2)совершенствование лабораторных навыков проведения химического эксперимента; закрепление знаний правил техники безопасности при работе с химическими реактивами;
3)формирование научного мировоззрения и научной картины мира.
Оборудование и материалы: этиловый спирт; пропиловый спирт; бутиловый спирт; изоамиловый спирт; фенолфталеин,1%-ный спиртовой раствор; лакмусовая бумага; металлический натрий; глицерин; сульфат меди, 0,2 н. раствор; едкий натр, 2 н. раствор, спираль из медной проволоки, пинцет; дихромат калия, 0,5 н. раствор; серная кислота, 2 н. раствор.
1. Организационный момент. Объявление темы и целей урока.
2. Инструктаж по технике безопасности при проведении лабораторной работы.
Те правила техники безопасности, которые нам известны, вы перечислите, пользуясь моими вопросами.
? Общие правила техники безопасности при поведении химического эксперимента.
? Правила работы со спиртовкой.
?Правила нагревания веществ в пламени спиртовки.
? Меры первой медицинской помощи при термических ожогах.
? Меры первой медицинской помощи при попадании на кожу рук кислот.
? Меры первой медицинской помощи при попадании на кожу рук щелочей.
Сегодня нам предстоит работать с металлическим натрием. Обращение с ним требует повышенной внимательности, т. к. неправильное использование и утилизация могут привести к пожарам.
Заполнение студентами журнала инструктажа по технике безопасности при проведении лабораторных работ.
3. Актуализация опорных знаний.
В форме фронтального опроса.
1)Какие вещества называют спиртами?
2)Какие типы химических реакций наиболее характерны для спиртов?
3)Перечислите реагенты, с которыми вступают в реакцию спирты по связи О-Н?
4) Перечислите реагенты, с которыми вступают в реакцию спирты по связи С-О?
4. Выполнение лабораторной части.
На малом перерыве преподаватель в обязательном порядке проводит сквозное проветривание кабинета ( студенты находятся в коридоре).
Опыт №1. Отношение спиртов к индикаторам
В четыре пробирки помещают по 3 капли воды и добавляют по 2 капли этилового, пропилового, бутилового и изоамилового спиртов. Испытывают растворы спиртов на фенолфталеин и лакмус. Цвет индикаторов не изменяется. Спирты показывают нейтральную реакцию на индикаторы.
Опыт №2. Образование и гидролиз алкоголятов
Атомы водорода гидроксильных групп в спиртах проявляют определенную подвижность (активность). Подобно воде спирты реагируют со щелочными металлами (натрием, калием и др.), которые замещают водород спиртовых гидроксильных групп. При этом образуется так называемые алкоголяты и выделяется водород.
Кислотные свойства у спиртов выражены несколько слабее, чем у воды,
хотя связь кислорода и водорода и поляризована: O−H. Алкильные группы отталкиваются от себя электроны, снижая этим легкость отщепления протона по сравнению с водой: H
Реакция щелочных металлов со спиртами протекает медленнее, чем с водой.
Алкоголяты – твердые вещества. Они подобны солям очень слабых кислот и при действии воды гидролизуются с образованием спирта и щелочи.
Опыт №3. Взаимодействие глицерина с гидроксидом меди (ІІ)
Глицерин – трехатомный спирт. Кислотность его больше, чем одноатомных спиртов: увеличение числа гидроксильных групп усиливает кислотный характер.
Опыт №4. Окисление этилового спирта оксидом меди (ІІ)
В сухую пробирку помещают 2 капли этилового спирта. Держа спираль из медной проволоки пинцетом, нагревают ее пламени горелки до появления черного налета оксида меди. Еще горячую спираль опускают в пробирку с этиловым спиртом. Черная поверхность спирали немедленно становиться золотистой вследствие восстановления.
H3C−C−H+CuO→CH3−C + Cu + H2O
Опыт №5. Окисление этилового спирта хромовой смесью
Окисление спиртов в лабораторных условиях чаще всего осуществляется хромовой смесью. В пробирку помещают 2 капли этилового спирта, добавляют 1 каплю раствора серной кислоты и 2 капли раствора двухромовокислого калия. Оранжевый раствор нагревают над пламенем горелки до начала изменения окраски на синевато – зелёную. Одновременно ощущается характерный запах уксусного альдегида. Химизм процесс:
K2Cr2O7 + H2SO4 → H2Cr2O7 + K2SO4
H2Cr2O7 → 2CrO3 + H2O
3CH3−CH2OH + 3O → 3CH3−C + 3H2O
Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O O
K2Cr2O7 + 3C2H5OH + 4H2SO4 → 3CH3−C + Cr2(SO4)3 +
Опыт№6. Получение диэтилового эфира
В сухую пробирку вводят 2 капли этилового спирта и 2 капли серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси очень осторожно добавляют еще 2 капли этилового спирта. Ощущается характерный запах диэтилового эфира. Химизм процесс:
C2H5 OH + H OC2H5 → C2H5−O−C2H5 + H2O
Реакция проходит в две стадии. Сначала спирт реагирует с серной кислотой, образуя кислый сложный эфир серной кислоты – этилсульфат, или этилсерную кислоту:
CH3−CH2OH + HO−SO3H ↔ CH3−CH2−OSO3H + H2O
Если спирт берется в избытке, то образуется простой эфир:
Если в реакцию вступает относительно много серной кислоты и мало спирта, то при дальнейшем нагревании(160°С) образуется олефин. Следовательно, в зависимости от температуры реакции и количественных соотношений спирта и серной кислоты возможно два случая дегидратации: а) с образованием этиленового углеводорода (внутримолекулярная дегидратация) и б) с образованием простого эфира (межмолекулярная дегидратация).
5. Защита лабораторной работы.
Студенты получают контрольные вопросы и отведенное время отвечают на них, в соответствии со своими способностями.
( На оценку «5» необходимо ответить на любые 5 вопросов,
на оценку «4» необходимо ответить на любые 4 вопроса,
на оценку «3» необходимо ответить на любые 3 вопроса).
6. Гимнастика для глаз.
7. Оформление отчета о проделанной лабораторной работе.
Студенты в папке для лабораторных работ оформляют отчет о проведенной лабораторной работе.
8. Домашнее задание.
Оформить работу до конца и принести на подпись преподавателю.
ПРИЛОЖЕНИЕ. Контрольные вопросы
Вопросы для контроля: « Спирты».
б) внутримолекулярной дегидратации; в) дегидрирования?
Какие продукты могут образоваться в результате окисления спиртов? Укажите, представители каких классов органических веществ могут быть получены из алканолов? Каковы способы получения спиртов? Чем объясняется большая реакционная способность глицерина по сравнению с алканолами?
19. Какая реакция является качественной на многоатомные спирты?
Реакционная способность и специфические реакции многоатомных спиртов и фенолов
Полифункциональные соединения могут проявлять свойства, присущие монофункциональным соединениям, т. е. способность вступать в реакции по каждой функциональной группе, поэтому наблюдается определенное сходство в поведении монофункциональ-
ных и полифункциональных соединений. Однако одновременное наличие нескольких функциональных групп обусловливает специфическую реакционную способность, как показано на примере приведенных ниже реакций.
Хелатообразование.Многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, при взаимодействии с гидроксидами тяжелых металлов, например гидроксидом меди (ІІ) в щелочной среде, образуют внутрикомплексные, так называемые хелатные, соединения. Такие соединения обычно хорошо растворимы в воде и интенсивно окрашены, поэтому реакция используется как качественная. При взаимодействии этиленгликоля или глицерина с гидроксидом меди (II) возникает интенсивно синее окрашивание в результате образования гликолята меди(II) или глицерата меди(II).
Эта качественная реакция характерна для многоатомных спиртов с открытой цепью и некоторых циклических спиртов, в которых гидроксильные группы достаточно сближены.
Дегидратация.Нагревание этиленгликоля с серной кислотой приводит к межмолекулярному отщеплению двух молекул воды и образованию диоксана.
Диоксан (т. кип. 101 o С) известен как хороший растворитель, смешивается с водой и углеводородами, весьма токсичен.
Хлорсодержащие дибензопроизводные диоксана обладают еще более высокой токсичностью. Печальную известность получил
2,3,7,8-тетрахлородибензо-n-диоксин (или просто диоксин), вызывающий в чрезвычайно низких концентрациях тяжелые заболевания иммунной и кроветворной систем. Попадание диоксина в почву, происходящее при использовании некоторых гербицидов (где он содержится в виде незначительной примеси), представляет серьезную экологическую проблему.
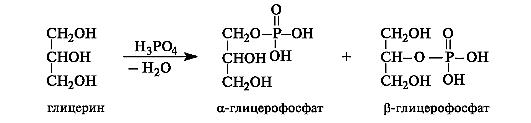
Образование сложных эфиров.Важное значение имеют некоторые сложные эфиры глицерина с неорганическими кислотами, в частности азотной и фосфорной. Тринитрат глицерина, или нитроглицерин,образуется при действии на глицерин азотной кислоты в присутствии серной кислоты.
В результате действия фосфорной кислоты на глицерин образуется смесь α-глицерофосфата и β-глицерофосфата. Глицерофосфаты применяются как общеукрепляющие средства. Они являются структурными элементами фосфолипидов.
Окислительно-восстановительные реакции.Реакции этого типа свойственны двухатомным фенолам с орто- и пара-положением гидроксильных групп в бензольном кольце. Среди продуктов окисления таких двухатомных фенолов особый интерес представляют хиноны.
Хиноны содержат своеобразную систему сопряженных связей, называемую хиноидной группировкой, включающую две двойные связи в цикле и двойные связи двух карбонильных групп.
Окисление гидрохинона в хинон in vivo происходит с участием пероксида водорода под действием фермента.
При окислении нафталина образуется 1,4-нафтохинон,являющийся структурным фрагментом витаминов группы K.
Окислительно-восстановительная система хинон-гидрохинон играет важную роль в организме. По отношению к большинству органических субстратов эта система выступает в роли окислителя.
С химической точки зрения производными 1,4-бензохинона являются убихиноны,называемые еще коферментом Q. Функционирование убихинонов в организме основано на их способности легко и обратимо превращаться в восстановленные формы.
Структурный фрагмент о-хинона содержится в составе окисленной формы флавоноидов. Пирокатехиновая группировка в структуре
таких важных биологически активных веществ, как флавоноиды, обусловливает их способность к участию в окислительно-восстановительных реакциях в организме.