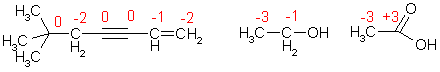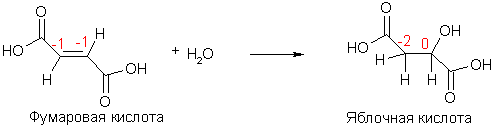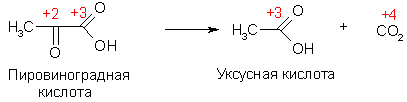Чем объяснить что углерод имеющий в стационарном состоянии электронное строение атома 1s22s22p2
ЗДЕСЬ НЕТ ПРАВИЛЬНОГО ОТВЕТА.
Как было сказано углерод в стационарном состоянии имеет электронную формулу 1s²2s²2p² а вот в возбуждённом состоянии (в котором он находится в органических соединениях) при получении энергии у него происходит распаривание электронов и формула приобретает вид 1s²2s¹2p³т.
Е. появляются 4 неспаренных электрона.
Укажите валентные электроны, определите максимальную валентность этого атома, а также число химических связей в основном состоянии.
На момент создания теории химического строения органических соединений отсутствовало : 1)учение о валентности б)представление о соединении атомов углерода в цепи в)разграничение понятий «атом» и «моле?
На момент создания теории химического строения органических соединений отсутствовало : 1)учение о валентности б)представление о соединении атомов углерода в цепи в)разграничение понятий «атом» и «молекула» г)понятие об электронном строении атомов элементов.
Сколько неспаренных электронов содержится в основном состоянии в электронных оболочках атомов хлора, серы, углерода?
Сколько неспаренных электронов содержится в основном состоянии в электронных оболочках атомов хлора, серы, углерода?
Напишите их электронные формулы.
Определите тип гибридизации атомов углерода в молекулах пропена и толуола?
Определите тип гибридизации атомов углерода в молекулах пропена и толуола.
В чем принципиальное различие в электронном строении этих веществ?
Укажите тип химической связи между атомами углерода в каждом случае?
Число неспаренных электронов на внешнем энергетическом уровне атома углерода в возбужденным состоянии?
Число неспаренных электронов на внешнем энергетическом уровне атома углерода в возбужденным состоянии.
Вид гибридизации электронных облаков атомов углерода в алканах?
Вид гибридизации электронных облаков атомов углерода в алканах?
Обозначение Электронное строение атомов углерода?
Обозначение Электронное строение атомов углерода.
Строение электронной оболочки атома углерода?
Строение электронной оболочки атома углерода.
Тип гибридизации электронного облака атома углерода в алкенах.
Приведите пример реакции, характерной для алкенов.
Составьте электронные схемы строения молекул Cl2, H2S, CCl4?
Составьте электронные схемы строения молекул Cl2, H2S, CCl4.
Укажите тип связи в каждом соединении.
Какой тип гибридизации валентных орбиталей атома углерода в CCl4.
HNO3 = 1 + 14 + 48 = 63m(H2) = 1 / 63 = 0. 016 * 100 = 1. 6%m(N) = 14 / 63 = 0. 22 * 100 = 22. 2%m(O2) = 48 / 63 = 0. 762 * 100 = 76. 2%.
Zn + S — ZnS реакция соединения.
Zn + S = > ZnS Это уровнение реакций цинка с серой.
M(NaOH) = 40 г / моль m(NaOH) = 0. 1моль / л * 0, 5 л * 40 г / моль = 2 г Отвесить на аналитических весах 2 г NaOH, долить немного воды, хорошо перемешать до полного растворения и добавить воды до 0, 5 л.
H2 + Br2 = 2HBr n(H2) = 22. 4 / 22. 4 = 1 n(HBr) = 30 / 22. 4 = 1. 34 m(HBr) = 2 * 81 = 162 m(HBr) = 1. 34 * 81 = 108. 54 w(HBr) = 108. 54 / 162 = 0. 67 или 67%.
А)физическое явление с)физическое явление б)химическое явление.
Этиловый спирт, глюкоза.
M₀ = 150 г w₀ = 0, 035 m(H₂O) = 100 г масса соли m = m₀w₀ масса нового раствора m₁ = m₀ + m(H₂O) массовая доля соли в новом растворе w₁ = m / m₁ w₁ = m₀w₀ /
Чем объяснить что углерод имеющий в стационарном состоянии электронное строение атома 1s22s22p2
Теоретические представления в органической химии
Углерод, его особенности
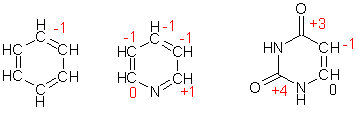
Тогда как атомы элементов-органогенов имеют обычно степени окисления [кислород (-2), азот (-3), фосфор (+5)], углерод может проявлять в соединениях любые степени окисления от (+4) до (-4). В ходе реакций он может присоединять или отдавать электроны, выступая в роли окислителя или восстановителя. Направление перехода электронов зависит от свойств другого реагента.
Степень окисления есть условный заряд атома, который рассчитывается с учетом того, что общая электронная пара связи между атомами полностью относится к более электроотрицательному атому (электроотрицательность характеризует способность атома удерживать электроны, особенно внешние). Общие пары электронов между атомами одного элемента при определении степени окисления не учитываются.
Степени окисления атомов углерода в соединениях
В молекуле органического соединения степени окисления атомов углерода могут быть различными:
Таким образом, степень окисления любого атома углерода в органических соединениях равна алгебраической сумме числа всех его связей с атомами более электроотрицательных элементов (кислород, азот, сера,…), учитываемых со знаком (+), и числа связей с атомами водорода, учитываемых со знаком (-), а все его связи с соседними атомами углерода не учитываются.
Степень окисления является условной величиной, но ее изменение указывает на окислительно-восстановительный характер реакции. Атомы углерода обладают окислительно-восстановительной двойственностью, в органической химии распространены реакции окислительно-восстановительной дисмутации за счет атомов углерода, которые могут протекать как межмолекулярно, так и в рамках одной молекулы.
Гибридные состояния атома углерода.
3. sp-Гибридизация (дигональная), при которой взаимодействуют 1 s и 1 p орбитали. Возникают 2 одинаковых электронных орбитали, расположенные линейно под углом 180°, они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой. Оставшаяся негибридизованные орбитали взаимно перпендикулярны и перпендикулярны плоскости, в которой лежат sp-гибридные орбитали.
Чем объяснить что углерод имеющий в стационарном состоянии электронное строение атома 1s22s22p2
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Электронное строение атома углерода
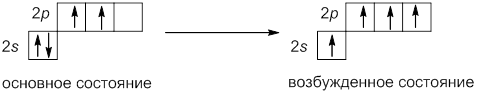
Строение электронной оболочки атома часто изображают с помощью квантовых ячеек. Каждую орбиталь обозначают квадратиком, электроны – стрелками, указывающими различное направление их спина. Валентность атома определяется главным образом числом неспаренных электронов на внешнем энергетическом уровне. Электронная конфигурация внешнего энергетического уровня атома углерода имеет вид:
В соответствии с приведенной электронно-графической формулой атом углерода может образовать по обменному механизму только две ковалентные связи. Однако в подавляющем большинстве органических соединений углерод четырехвалентен. Это можно объяснить тем, что при образовании химических связей выделяется энергия, достаточная для перехода одного из электронов с 2s-орбитали на вакантную 2p-орбиталь. Принято говорить, что атом углерода перешел в возбужденное состояние.
Таким образом, атом углерода имеет четыре неспаренных электрона и может образовать четыре ковалентные связи. Расположение орбиталей пространстве можно представить следующим образом:
В возбужденном состоянии три р-орбитали расположены перпендикулярно друг другу.
Строение атома углерода
Спин (от англ. to spin — вращаться) — это собственный момент импульса электрона (при введении понятия «спин» в 1925 г. предполагали, что магнитные свойства электрона как заряженной частицы вызваны его вращением вокруг собственной оси). Спин электрона проявляется лишь при взаимодействии его с другими электронами и с внешним магнитным полем. Спин может иметь только два значения: + 1/2 и —1/2»
Очень часто строение электронных оболочек атомов отображают с помощью электронно-графических формул. В них каждая орбиталь обозначается одной клеткой; каждый электрон — стрелкой; направление стрелки символизирует направление спина.
Изобразим электронно-графические формулы атомов углерода и водорода:
Такой атом имеет четыре неспаренных электрона и может принимать участие в создании четырёх ковалентных связей.
Для образования ковалентной связи необходимо,чтобы орбиталь одного атома перекрывалась с орбиталью другого. При этом чем больше перекрывание, тем прочнее связь.
Строение атома углерода, свойства и схема элемента
Атом углерода
Положение углерода в периодической таблице Менделеева:
Рис. 1. Положение углерода в таблице Менделеева.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
Также реагирует с оксидами металлов:
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С кислородом углерод образует углекислый газ и угарный газ:
Угарный газ также образуется при взаимодействии с водой:
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.