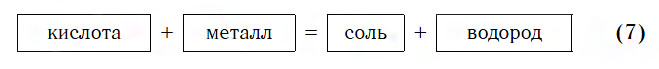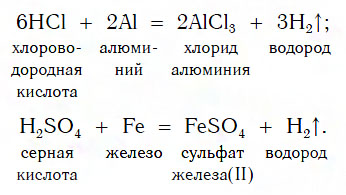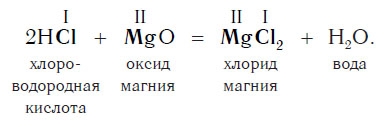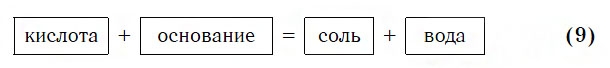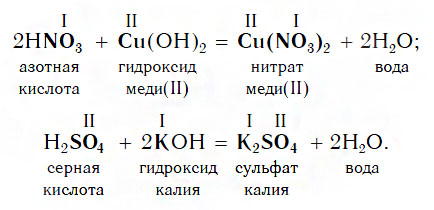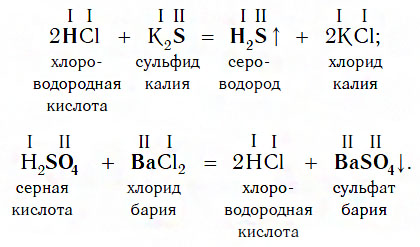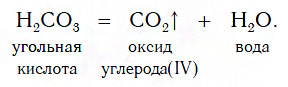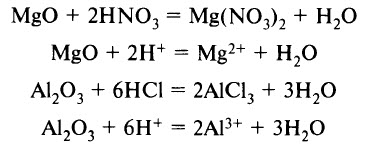Чем обусловлены свойства кислот
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
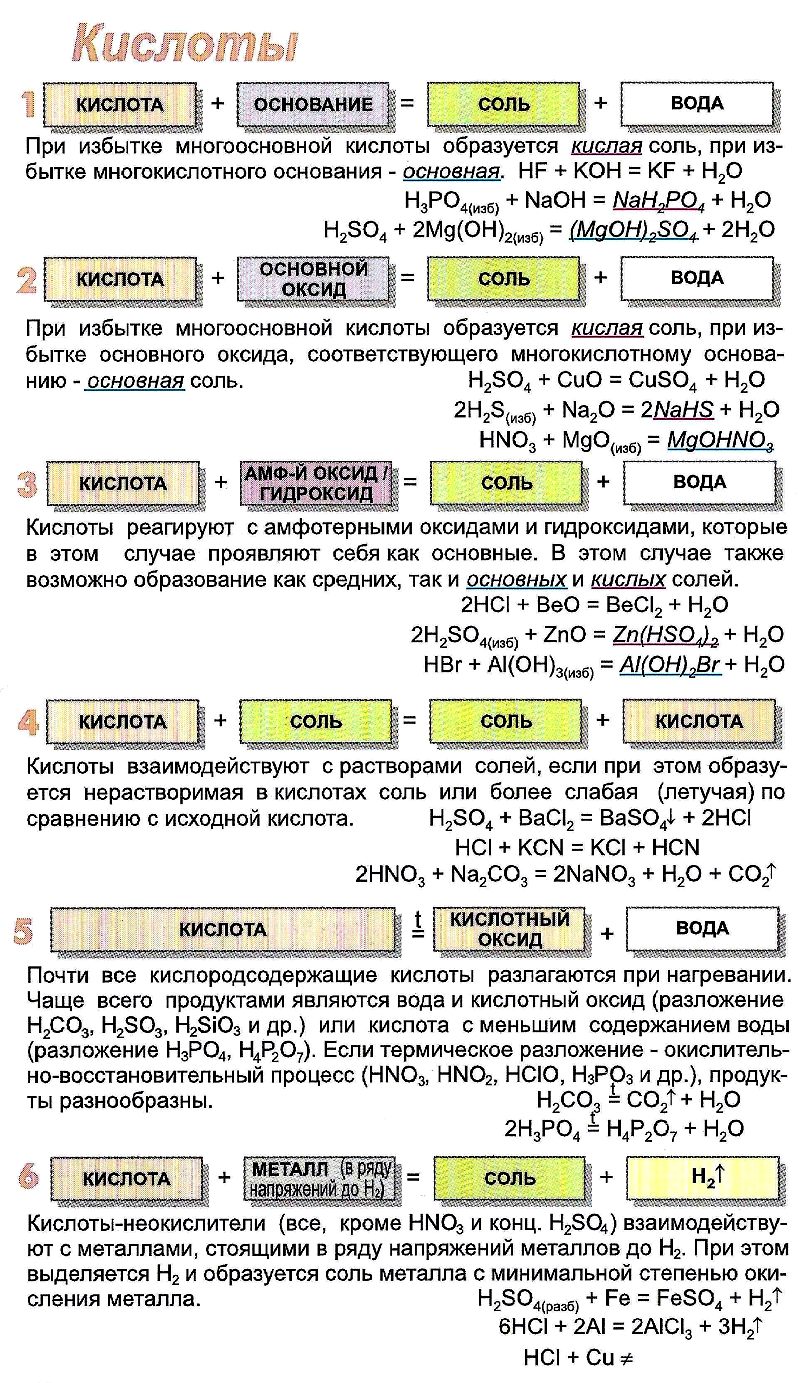
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Характерные химические свойства кислот
Содержание:
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
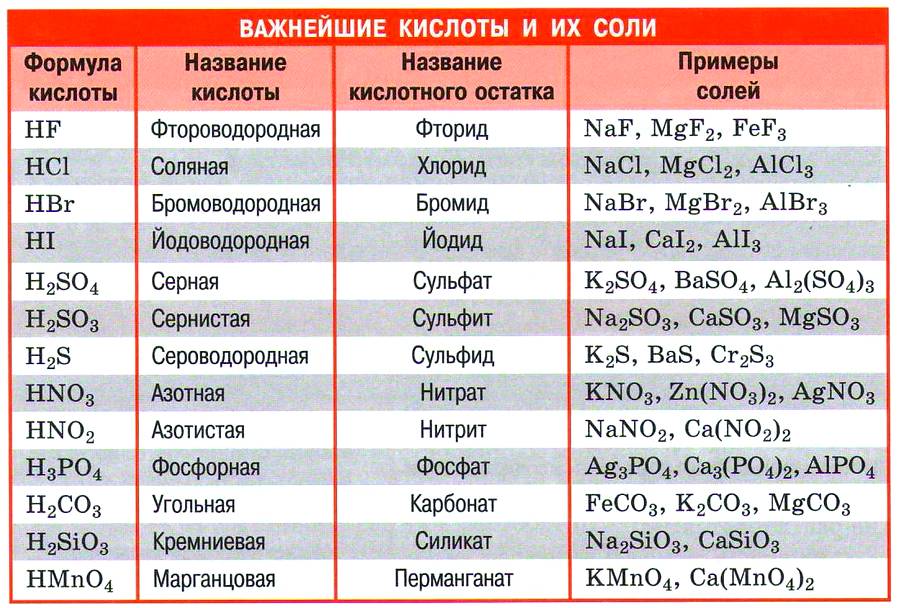
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная.
Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
В качестве примера приведены следующие реакции:
Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд:
В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности.
Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок №48. Химические свойства кислот
Химические свойства кислот
Универсальная индикаторная бумага
2.Реагируют с металлами в ряду активности до H 2 (искл. HNO 3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H 2 ↑ (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O ( р. обмена)
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
2 NaCl (тв.) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
№3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
Чем обусловлены свойства кислот
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ):
НCl = Н + + Cl – (НCl + H2O = H3O + + Cl – )
HNO3 = Н + + NO3 – (HNO3 + H2O = H3O + + NO3 – )
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н + = H2S↑ + Fe 2+
Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
ПОЛУЧЕНИЕ КИСЛОТ
Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО – + Н + = СH3СООН
Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)
Конспект урока по химии в 8 классе «Кислоты: классификация, свойства, получение». Выберите дальнейшее действие: