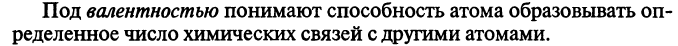Чем обусловлены ненаправленность и ненасыщаемость ионной связи
Чем обусловлены ненаправленность и ненасыщаемость ионной связи
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершенным и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химической связи: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода (рис. 3):
`»H» + «H» = «H»_2`; `Delta»H»=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется `sigma`-связью.
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
$$ \mathrm
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают черточкой, которая символизирует пару электронов: `»H»-«H»`.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
неподелённые пары остаются при своих атомах, а та что их связывает уже становится поделённой между двумя атомными центрами.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x` (рис. 4).
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`. В ней атомы имеют три общие пары электронов:
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `σ`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны от линии, связывающей центры соединяющихся атомов. Такая ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры соединяющихся атомов, называется `pi`-связью.
В общем случае ковалентной называется химическая связь, осуществляемая электронными парами.
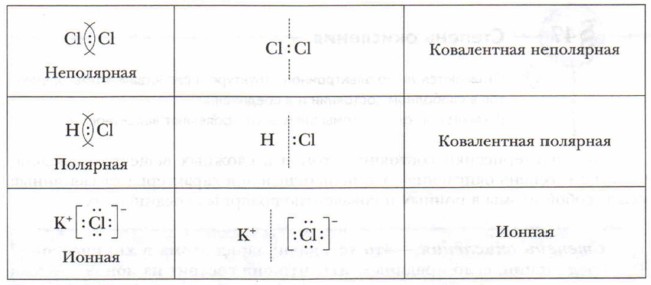
Различают неполярную и полярную ковалентную связь. Все рассмотренные выше молекулы образованы атомами одного и того же элемента, при этом двухэлектронное облако связи распределяется в пространстве симметрично относительно ядер обоих атомов, и электронная пара в одинаковой мере принадлежит обоим атомам. Такая связь называется неполярной ковалентной связью.
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора (рис. 6).
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) – акцептором.
Механизм образования ковалентной связи за счёт двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным; образованная таким путём ковалентная связь называется донорно-акцепторной или координационной связью.
Химическая связь между ионами, возникающая в результате их электростатического притяжения, называется ионной связью.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода `(«IV»)` («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Такой тип химической связи, которая осуществляется электронами, принадлежащими всем атомам одновременно, называется металлической связью. Металлическая связь характерна для металлов в твёрдом и жидком состоянии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической – пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Иногда в соединениях мы встречаемся с особой формой химической связи – так называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды (рис. 7).
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Ионная связь. Ненаправленность и ненасыщенность ионной связи. Электростатическое взаимодействие ионов. Поляризуемость и поляризующая способность ионов.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
Ненасыщаемость ионной связи следует из того, что каждый заряд может притягивать любое число противоположных зарядов (очевидно, что с увеличением расстояния между зарядами сила притяжения между ними ослабевает).
Это связь очень сильная и ее очень трудно разорвать физическим путем (плавлением например ) именно поэтому ионные соединения имеют высокую температуру плавления. Ионные соединения растворяются в полярных растворителях таких как вода например, а растворяются они потому что полярные молекулы воды «захватывают» и удерживают катионы и анионы.
Природа электростатических взаимодействий определяется кулоновским притяжением противоположно заряженных групп или атомов и отталкиванием одноименно заряженных. Энергия электростатического взаимодействия заряженных частиц определяется законом Кулона, где Z1,Z2 — заряды взаимодействующих частиц; е — заряд электрона, равный 1,6*10-19 Кл; ε — диэлектрическая проницаемость среды; l — расстояние между частицами.
Энергия взаимодействия заряженных частиц может быть весьма значительна. Так, в вакууме энергия взаимодействия частиц, находящихся на расстоянии 0,1 нм, составляет 1380 кДж/моль; на расстоянии 0,3 нм — 460 кДж/моль. Однако в водном растворе, особенно в растворах электролитов, кулоновское взаимодействие существенно ослабляется. Молекулы воды имеют большой дипольный момент и поэтому способны, взаимодействуя с заряженными частицами, частично компенсировать их взаимное влияние. Диэлектрическая проницаемость воды равна ε = 80, и согласно закону Кулона сила взаимодействия заряженных частиц в воде будет в 80 раз меньше, чем в вакууме.
Из изложенного следуют два важных для практики вывода:
в органических растворителях или в микрофазе, близкой по характеристикам к гидрофобному аполярному органическому растворителю, сила электростатического взаимодействия заряженных групп возрастает по сравнению с водой (диэлектрическая проницаемость органического растворителя существенно меньше диэлектрической проницаемости воды);
введение в систему дополнительных заряженных ионов должно приводить к ослаблению электростатического взаимодействия в силу экранирования зарядов введенными ионами.
Характеристикой влияния дополнительных ионов является ионная сила раствора электролита.
В реальных системах в присутствии диполей воды и дополнительных электролитов энергия ионных взаимодействий не превышает 12 — 20 кДж/моль, хотя может сильно возрастать в локальной области микроорганической фазы белковой молекулы.
При известной функции потенциальной энергии U(r) электростатические взаимодействия могут быть детально проанализированы. Теоретически в аналитической форме значение l рассчитано для двух случаев — для бесконечно разбавленных растворов электролитов и для растворов электролитов, подчиняющихся предельному закону Дебая — Хюккеля.
Бесконечно разбавленные растворы электролитов. В растворах электролитов при бесконечном разбавлении потенциальная энергия взаимодействия заряженных частиц описывается законом Кулона.
Влияние общего заряда белковой глобулы. Анализ электростатических эффектов не учитывает воздействие на ферментативную реакцию общего заряда белковой глобулы. При исследовании ферментативной реакции в условиях, близких к изоэлектрической точке белка, этим эффектом действительно можно пренебречь.
Однако при проведении реакции вдали от изоэлектрической точки в условиях, когда белковая глобула несет большой заряд, влияние общего заряда глобулы может быть весьма значительным.
Предполагалось, что общий заряд белка можно представить равнодействующим зарядом, локализованным в центре сферической глобулы. Диэлектрические свойства среды считались постоянными по всему объему и характеризовались диэлектрической проницаемостью. В рассматриваемом приближении предполагалось также, что потенциальная энергия взаимодействия заряженных частиц не зависит от угловых характеристик и взаимодействие зарядов имеет линейный характер.
Влияние заряда глобулы может быть весьма значительным. Если субстрат заряжен и реакция проводится вдали от изоэлектрической точки, можно ожидать увеличения или уменьшения энергии взаимодействия примерно на два порядка.
Важно отметить, что электростатические взаимодействия являются ненаправленными в отличие, например, от водородной связи.
Ослабление электростатического взаимодействия при высоких концентрациях солей часто используют в препаративной химической энзимологии. Например, выделение белков в большинстве случаев включает стадию осаждения белков концентрированным раствором электролита, часто сульфата аммония. При этом в первую очередь происходит нейтрализация зарядов белковых молекул и агрегация белка.
Ионная связь. Ненаправленность и ненасыщаемость ионной связи. Свойства веществ с ионным типом связи
Гибридизация атомных орбиталей. Примеры. Пространственная конфигурация молекул с sp,sp2, sp3-гибридизацией (примеры).
Валентность атомов в стационарном и возбужденном состояниях. Кратность связи. Сигма-связь и Пи-связь.
Ковалентная связь. Ее разновидности и свойства.
Обменный и донорно-акцепторных механизмы образования ковалентной связи.
Природа химической связи. Метод валентных связей.
S-, p-, d-, f-элементы, положение в периодической системе. Основные химические свойства.
Периодический закон с точки зрения строения атома. Причины периодичности.
Распределение электронов в атоме. Правило Хунда.
Современная модель состояния электрона в атоме. Квантовые числа. Принцип Паули.
ВОПРОС 25.

Ионная связь – это связь, которая образуется при взаимодействии атомов, резко отличающихся друг от друга по значениям электроотрицательности. В результате взаимодействия образуются ионы.
Ионной связи характерны:
1) ненасыщаемость (каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля)
2) ненаправленность (любой ион в любом направлении способен притягивать к себе ион противоположного заряда)
Свойства веществ с ионной связью: твердые, тугоплавкие, не имеют запаха, часто хорошо растворимые в воде.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Ионная связь и её свойства
Важнейшими свойствами ионной связи являются её прочность, ненасыщенность, ненаправленность.
Ионная связь весьма прочная. Так, например, энергия разрыва связи К— Сl равна 426,1 кДж/моль, связи Li—F — 577,3 кДж/моль, Na—Сl — 411,3 кДж/моль.
Ненасыщенность её объясняется тем, что вокруг заряженной частицы — иона создаётся сферическое электромагнитное поле.
Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной.
Вы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова — электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов.
Чем больше разность между значениями ОЭО атомов, тем выше степень ионности их соединения. Связи с разностью ОЭО больше 2,1 можно отнести к ионным (более 50% ионности).
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы — ковалентная и ионная также условно.
Ионы • Катионы • Анионы • Ионная связь • Ионные соединения






Ионная, водородная и металлическая связи
Донорно-акцепторная связь
Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором):
Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от атома-донора к атому-акцептору: А→В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора:
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NH3. Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную 1s-орбиталь, поэтому он может быть акцептором электронов:
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Следовательно, если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
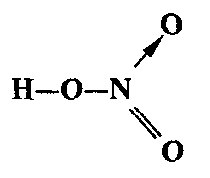
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей. Такую валентность азот имеет и в таких соединениях, как N2О5, HNО3, NaNО3 и т. п. Например, в молекуле азотной кислоты три ковалентные связи N—O образуются неспаренными электронами атома азота, а одна связь N—О образуется неподеленной парой электронов атома азота:
Ионная связь
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ДЭО > 1,7), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, имеющих электрические заряды. Эти Частицы называются ионами:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи.
Как вы уже знаете, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны: Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами, например:
Na 0 — 1ē→Na + — катион натрия;
Ca 0 — 2ē→Ca 2+ — катион кальция.
При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами, например:
Cl 0 + 1ē→ Cl — — хлорид-анион;
O 0 + 2ē→O 2- — оксид анион.
Например, образование ионной связи при взаимодействии атомов натрия и хлора схематично можно показать так:
Как видно из этого примера, ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи, как и при образовании ковалентной связи, атомы переходят в более устойчивое состояние.
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SО4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в NaОН и между атомами кислорода и серы в Na2SО4) — ковалентные полярные.
Металлическая связь
Как известно, атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ-металлов.
Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути Hg). В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.
Поэтому электроны, которые находятся в кристаллической решетке металлов, называются свободными электронами, или «электронным газом».
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью.
Металлическая связь обусловливает важнейшие физические свойства металлов.
Водородная связь
Водородная связь является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (например, с фтором, кислородом, азотом). Ковалентные связи H—F, Н—О, H—N являются сильно полярными (большая разность ЭО!). Поэтому атом водорода имеет избыточный положительный заряд +5, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды:
В результате электростатического взаимодействия происходит притяжение положительно заряженного атома водорода одной молекулы к электроотрицательному атому другой молекулы. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «полусвободной» 1s-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома:
Это примеры образования межмолекулярных водородных связей. (Водородные связи обозначаются точками). Образование межмолекулярных водородных связей является причиной существования ассоциатов молекул типа (HF)n, (H2O)n и др.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=О:
Внутри- и межмолекулярные водородные связи существуют в молекулах белков, ДНК и др.
Таким образом, при образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью.
Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи и варьируется в пределах 15 — 40 кДж/моль. Тем не менее, водородные связи играют важную роль во многих физико-химических и биологических процессах.
Межмолекулярные взаимодействия
Межмолекулярная водородная связь является одним из видов межмолекулярных взаимодействий.
Существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти силы называются ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольными молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным:
Типы кристаллических решеток твердых веществ
Скачать:
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Химическая связь» Химическая-связь.doc (203 Загрузки)
Рефераты по другим темам можно скачать здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42