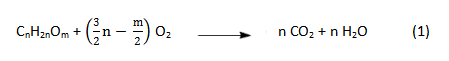Чем обусловлено свечение пламени свечи
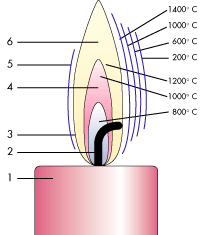
Строение пламени свечи
Люди с незапамятных времен покланялись и будут поклонятся огню в самых разных его ипостасях. На минутку задумайтесь пламя свечи отличается от пламя костра только размером и температурой! Во всем остальном их суть и строение одинаково. Всмотритесь внимательно в пламя свечи и Вы увидите строго определенные зоны пламени. Визуально их выделяют три. Разные зоны окрашены по разному и идентичны от свечи к свече в любом уголке мира в независимости от используемого свечного материала*. Без сомнения такое строение имеет сакральный смысл!
В этой статье мы кратко и просто расскажем о известных физических свойствах пламени свечи, данная информация будет особенно полезна тем, кто хочет стать настоящих профессионалом в изготовлении свечей (см. статью ошибки в горении фитиля).
*Примечание: обычные условия, а не лабораторные условия.
С химической точки зрение горение выглядит так:
В процессе горения происходит расщепление сложных углеводородов (парафин, стеарин, воск и т.д) под действием кислорода до углекислого газа и воды. Процесс горения происходит непрерывно за счет подъема (как в капилляре) по фитилю расплавленного свечного материала с последующим его сжиганием.
Пламя свечи разделено на различные светящиеся и температурные области, которые легко видны невооруженным глазом:
Примечание: считается, что самое горячее пламя на кончике свечи, это не совсем так. Самая горячая часть пламени в основной зоне реакции или чуть ниже.
Материалы к уроку: Пламя светящееся и не светящееся. Горелка Бунзена
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Пламя — постоянный спутник энергичного горения обычных горючих веществ. Характеристикой пламени могут служить его pa змеры, изменение формы в зависимости от количества горючего вещества и большая или меньшая способность свечения.
Пламя представляет собой раскаленный газ, что легко подтверждается тем, что при зажигании струи газа образуется пламя. Твердое вещество, не выделяющее при нагревании воспламеняющихся газообразных продуктов, при своем горении не образует пламени в общепринятом понимании этого слова. Например, при горении угля реакция распространяется по поверхности, которая накаляется; при горении же газа получается не только большая «поверхность» соприкосновения с кислородом воздуха, но и создается во всех направлениях теснейший контакт между горючим веществом и пособником горения.
Газы могут светиться лишь во время самого горения или лишь немного спустя. Твердый углерод при горении дает достаточное количество газов, но они так быстро теряют свою теплоту и высокий накал, что перестают светиться, едва лишь потеряют Связь с его поверхностью, где происходит реакция. Если твердое вещество окисляется очень быстро, как например, сгорающий в кислороде углерод, то сгорающие в непосредственном контакте с горящим углеродом газы светятся и количество тепла, образующегося при горении, достаточно для образования «пламени».
Светящееся и несветящееся пламя
Пламя бывает двух видов — светящееся и несветящееся и, хотя почти всякое пламя является видимым, не всякое испускает достаточное количество света.
Свечение пламени обусловлено: a ) наличием в нем твердого вещества, b ) плотностью его, т. е. давлением и плотностью участвующих в реакции газов, и c ) его температурой.
Присутствие твердого вещества в пламени — наиболее общая причина свечения, В качестве примера пламени мы возьмем пламя c вечи.
Пламя свечи описано было неоднократно. Воск (смесь твердых углеводородов и жирных кислот) плавится под действием теплоты (получающейся в достаточном количестве в результате горения фитиля свечи) и всасывается фитилем. Поскольку фитиль непосредственно связан с пламенем, температура оказывается достаточной для превращения расплавленного воска в газ путем разложения или возгонки. Глазу на первый взгляд пламя кажется состоящим из нижней темной или слабо светящейся части и верхней светящейся части. На самом же деле вокруг нижней темной части имеется тонкая полоска светящегося пламени, а вокруг всего пламени находится как бы оболочка из совершенно незаметных для глаза газов. Темная часть состоит из несгоревших газов. В верхней части, где всосанный воздух благодаря конвекции вступает в контакт с горючими парами, происходит процесс горения; часть паров сгорает. Такое же явление имеет место и в узкой полоске, окружающей ядро пламени, куда также частично всасывается воздух. В наружной, едва заметной части, происходит полное сгорание. Свечение своим происхождением обязано отдельным частицам твердого углерода, накаленным добела; некоторые из них сгорают в светящейся части пламени, остальные в других частях.
В пламени правильной формы, образуемом свечей, лампой или старинной газовой горелкой, лишь небольшое количество углерода не подвергается окислению. В пламени, имеющем неправильную форму, например в пламени, получающемся при сжигании обычных горючих материалов — дерева, бумаги, тканей и т. п., — воздуха, входящего в пламя, оказывается недостаточно, чтобы образовать надлежащую смесь с горючими газами, потребную для полного сгорания, и несгоревшие частицы углерода отлагаются в виде сажи и дыма.
Образование частиц углерода в пламени горящих углеродистых веществ (в частности углеводородов) в течение долгого времени приписывали «преимущественному горению». Считалось, что кислород воздуха быстрее соединяется с водородом горючего, чем с углеродом, и следовательно часть последнего выделяется в той части пламени, где воздуха для полного горения недостаточно. При выходе же его наружу он сгорает. В результате же произведенных опытов со взрывом смеси углеводородов с водородом обнаружено, что кислород распределяется между водородом и углеродом, образуя воду и окись углерода, причем углерод стремился превратиться в окись углерода прежде, чем водород, сгорая, превращался в воду. Развивалась теория, что в пламени образовывался ацетилен, который экзотермически разлагался на составные элементы. Такая теория однако оказалась неудовлетворительной, так как ацетилен образовывался лишь иногда. Во время процесса разложения углеводорода кислород поглощался и образовывались кислородсодержащие соединения углерода, например альдегиды, которые в пламени разлагались, выделяя углерод. Таким образом процессы, протекающие при горении, оказались сложными.
Хотя вопрос об «образовании» углерода оказался спорным, все же отложение несгоревших частиц углерода в виде сажи следует отнести или за счет недостатка кислорода (воздуха) или за счет неполного смешения его с горящими газами.
Пламя, свечение которого обусловлено наличием частиц углерода, является наиболее общим типом светящегося пламени и образуется всегда при горении обыкновенных горючих материалов. Свечение пламени, впрочем, может быть обусловлено и наличием в нем других твердых веществ. Так например, при горении легкогорючих металлов, таких например, как магний, пламя получается светящимся вследствие образования твердых окислов (при горении магния пламя получается белое). Твердые вещества, вводимые в пламя, раскаляются, вследствие чего свечение увеличивается. Этот факт легко подметить на обыкновенном газокалильном колпачке, где окислы редких земель накаляются до сильного свечения посредством бунзенского пламени. Так как в данном случае твердые частицы могут быть как введены в пламя, так и выведены из него, то считать самое пламя в этом случае светящимся нельзя.
При повышении температуры пламени повышается и свечение; такое повышение температуры может зачастую и несветящееся пламя сделать светящимся. Повышение температуры может быть достигнуто подогревом воспламеняющихся газов и воздуха. Если трубку горелки Бунзена нагреть докрасна и пропустить через нее смешанный с воздухом газ, пламя становится особенно светящимся.
Замена воздуха кислородом вызывает увеличение свечения. Высокая температура дает возможность нагреть и инертный азот. Углерод в кислороде горит с образованием пламени, так как окислы углерода, находящиеся в соприкосновении с горящим твердым веществом, имеют достаточно высокий накал.
На свечение пламени оказывает большое влияние давление участвующих в реакции газов. Возрастание давления повышает свечение, а понижение давления уменьшает его. Если зажженную свечу поместить под колокол и соединить последний с воздушным насосом, то при частичной откачке воздуха свечение быстро уменьшается. С другой стороны, при увеличении давления газы, горящие обычно несветящимся пламенем (например водород), можно заставить гореть светящимся пламенем.
Густые и плотные пары и газы различных веществ обычно горят более светящимся пламенем, чем образованные продуктами, дающими пары меньшей плотности. Например, пары фосфора и его соединений, выделяющие плотные продукты горения, дают желтое пламя; соединения мышьяка — светящееся пламя. Если некоторые соли (лучше всего хлористые соединения щелочных или щелочноземельных металлов) ввести в малом количестве в пламя горелки Бунзена, то соль улетучивается или разлагается, и пламя принимает окраску, меняющуюся в зависимости от присутствующего металлического радикала. Такие металлические соли выделяют пары высокой плотности и таким образом дают светящееся пламя.
Коптящее или светящееся пламя может быть превращено в несветящееся путем подмешивания воздуха в горючий пар или газ перед сжиганием. Ближайшим примером может служить горелка Бунзена. В бунзеновской горелке горючий газ поступает через форсунку у дна трубки горелки, воздух всасывается через отверстие благодаря быстрому движению поступающего через форсунку газа. Этого количества воздуха недостаточно для полного горения газа, но его достаточно для образования в соединении с газом горючей смеси, сгорающей вверху горелки. Пламя состоит из внутреннего конуса голубовато-зеленого цвета, окруженного тонкой чуть светящейся оболочкой. Внутренний конус состоит из частично окислившихся газов. Стремительный поток газа всасывает воздух в пламя, и в наружной оболочке происходит полное сгорание.
Температура пламени неодинакова для различных горючих газов и паров; неодинакова также и температура различных частей пламени; область полного сгорания имеет и наиболее высокую температуру.
При сжигании некоторого количества горючего вещества выделяется определенное количество теплоты. Если известно строение вещества, можно рассчитать состав и объем получившихся продуктов горения. Зная удельную теплоту этих продуктов, можно высчитать максимальную температуру, достижимую в пламени. Следует помнить, что, если вещество горит в воздухе, на каждый объем кислорода, вступающего в реакцию, приходится 4 объема инертного азота и, поскольку азот присутствует в пламени, он нагревается выделяемой при реакции теплотой, и таким образом температура пламени будет равна температуре продуктов горения плюс азот.
Все данные должны конечно выражаться в единицах одной и той же системы мер. При употреблении британской системы вес должен быть выражен в фунтах, а температура — в градусах Фаренгейта.
Удельная теплота вещества меняется с температурой, так что определить приблизительно температуру возможно; точное же ее определение невозможно.
На практике точный расчет температуры невозможен, так как в продолжение горения имеется непрерывная потеря теплоты. Эта теплота рассеивается различными путями. Часть уходит в виде лучистой теплоты и света и других форм энергии; часть теряется путем конвекции, в результате движения горячих газов пламени, вступающих в контакт с более холодной окружающей атмосферой; наконец, часть теплоты теряется, вследствие проводимости окружающей среды, в воздухе. Направленный вверх стремительный поток горячих газов пламени поглощает большее количество воздуха, чем потребно для горения, — эта «разбавка» также действует охлаждающе. Наибольшие потери теплоты происходят в результате излучения, и, если пренебречь теплом, теряемым вследствие конвекции и теплопроводимости, то получим температуру несколько ниже теоретического максимума.
Повысить температуру пламени, увеличивая количество горючих газов в данный момент, мы не можем, так как при таком увеличении количества горючих газов расходуется и кислород, и таким образом продукты горения будут образовываться в большем количестве.
При тесном смешении определенного количества воздуха, потребного для горения с горючим газом, мы получим наиболее благоприятные условия для получения максимальной температуры пламени. Это достигается путем применения горелки. Если мы попытаемся пропустить полностью потребное количество воздуха через отверстия бунзеновской горелки, то получится «обратный выхлоп» пламени, так как скорость распространения пламени вниз, через взрывчатую смесь, превысит скорость, с которой смесь движется по трубке горелки и выходит в верхнем конце ее. Придав смеси большую скорость посредством дутья или выпуская перед смешиванием воздух из резервуара под большим давлением, мы преодолеем это затруднение и получим довольно правильную подачу смеси в горелку. Вторичное всасывание воздуха будет весьма незначительным, а потому пламя не будет разбавляться избытком воздуха, как это обычно бывает при всасывании воздуха поверхностью пламени. При замене воздуха кислородом полученная температура повысится настолько, что накалит и инертный азот.
Лучистая энергия (излучение)
Светящееся пламя углеводородов, в котором весь воздух, потребный для горения, всасывается из окружающей атмосферы, не достигает столь высокой температуры, как пламя горючих смесей воздуха, например в горелке Бунзена. Кроме того, в первом случае получается неполное сгорание и образуется сажа. Однако, светящееся пламя излучает гораздо большее количество энергии. Обнаружено, например, что при горении ацетилена светящимся пламенем излучалось 28,2% теплоты, полученной при горении, а при горении того же самого газа несветящимся пламенем — всего 6,9%. Сильное излучение светящегося пламени играет важную роль в распространении огня и является причиной «живости» и тепла горящего угля. При горении газа нужно нагреть до свечения твердые частицы, которые отнимают
Химия пламени
Чем проклинать тьму,
лучше зажечь хотя бы
одну маленькую свечу.
Конфуций
В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, ракетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент ракетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится характерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.
Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгейту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.
Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-голубого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.