Чем обусловлена высокая прочность коллагеновых волокон
Лекция 1. НЕМИНЕРАЛИЗОВАННАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ
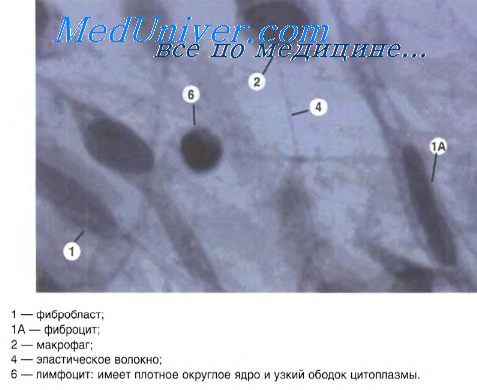
Ткани организма человека состоят из клеток и внеклеточного пространства, которое называется внеклеточный (межклеточный) матрикс. Ткань, в которой внеклеточный матрикс занимает значительно больший объем, чем клетки называется соединительнойтканью. Рис.11.1.
Доля соединительной ткани в разных органах различна, в коже, костях – она является основным компонентом. Соединительная ткань:
● образует твердые, как камень, кости и зубы;
● формирует прозрачное вещество роговицы глаза;
● принимая форму каната, придает сухожилиям прочность на разрыв.
ХИМИЧЕСКИЕ МАКРОМОЛЕКУЛЫ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Макромолекулы синтезируются и секретируются клетками соединительной ткани: фибробластами, хондробластами (хрящ), остеобластами (кость), цементоцитами (цемент).
Матрикс неминерализованной ткани образуют макромолекулы двух основных классов:
— в свободном состоянии;
— или ковалентно связанные с белком.
• фибриллярные белки двух типов:
— структурные коллаген и эластин;
— адгезивные, например, фибронектин, ламинин, нидоген.
■ ГАГ и протеогликаны образуют гидратированную гелеподобную среду, в которую погружены фибриллярные белки;
■ Коллагеновые волокна организуют порядок и укрепляют матрикс, эластические структуры придают ему упругость;
■ Адгезивные белки взимодействуя с клетками, коллагеном и ГАГ обеспечивают интеграцию компонентов матрикса.
♦ один остаток – аминосахар N-ацетилглюкозамин или N-ацетилгалактозамин, который у многих ГАГ сульфатирован;
В матриксе различают 4 главные группы ГАГ:
· хондроитинсульфат и дерматансульфат;
· гепарансульфат и гепарин;

Сердцевинный белок (белковая часть) ПГ образуется на рибосомах ЭР, а синтез цепей ГАГ идет, в аппарате Гольджи. Синтез ГАГ начинается с присоединение к остатку серина в белке ксилозы, галактозы, галактозы с образованием трисахарида. Рис.11.2.
Синтез протеогликана – хондроитинсульфата рис.11.3
В сульфатировании участвует ФАФS (3′-фосфоаденозин-5′-фосфосульфат).
Синтезированные протеогликаны выходят из клетки, они различаются по:
• длине полисахаридных цепей;
• числу и типу гликозамингликановых цепей в молекуле.
Структура – «мономера» протеогликана
В межклеточном пространстве ПГ могут образовывать гигантские агрегаты с участием ГК. Они могут удерживать более сотни протеогликановых «мономеров» с помощью связующих белков.
Строение агрекана хрящевого матрикса Рис.11.5.
Агрекан хрящевого матрикса содержит
100 цепей хондроитинсульфата и
Комплексы из ПГ и коллагенов в позвоночных и суставных дисках:
■ повышают их устойчивость к ударам;
■ смягчают трение возникающее между костями.
Диски сдавливаются в течение дня, восстанавливают эластичность ночью, но постепенно деформируются с возрастом.
Рессорная функция гликозамингликанов. Рис.11.6.
Распад ГАГ и ПГ происходит в лизосомах под действием гидролаз (протеаз, кислых гликозидаз и сульфатаз). Нарушение процесса распада приводит к накоплению в лизосомах фрагментов ГАГ и развитию лизосомальных болезней.
КОЛЛАГЕНЫ составляют около 30% от общего белка организма человека. Молекулы коллагенов имеют трехспиральную структуру, образованную скручиванием трех пептидных α-цепей, которые содержат от 600 до 3000 аминокислот.
Аминокислотный состав α-цепей коллагена.
Коллаген содержит, в основном, заменимые аминокислоты, поэтому является неполноценным белком.
Этапы синтеза и формирования фибрилл коллагена.
Весь процесс протекает в два этапа. Первый – внутриклеточный идет на полирибосомах, поэтому одновременно образуется много молекул пре-про-α-цепей коллагена.
• отщепление «сигнального» пептида;
С помощью N-концевого «сигнального» пептида пре-про-α-цепи молекулы белка переносятся в просвет ЭР. После этого «сигнальный» пептид отщепляется и образуется про-α-цепь.
• гидроксилирование аминокислотных остатков пролина и лизина
происходит в полости ЭР под действием железосодержащих (Fe 2+ ) ферментов пролилгидроксилазы и лизилгидроксилазы. В ходе реакций Fe 2+ окисляется (Fe 3+ ), в его восстановлении участвует вит. С. Рис.11.9.
Введение ОН- группы в гидрофобный радикал Про позволяет гидПро образовывать водородные связи, стабилизирующие трехспиральную структуру коллагена. Лизин и гидроксилизин в ходе внеклеточного этапа образуют ковалентные связи при сборке коллагеновых фибрилл.
• гликозилирование гидроксилизина катализируют специфические гликозилтрансферазы. Они могут присоединять остатки галактазы, галактозы и глюкозы. По завершении спирализации гликозилирование прекращается.
Гликозилирование аминокислотных остатков гидроксилизина. Рис.11.10.
Остатки Цис в N (100 ам-т)- и С-концевых (250 ам-т) фрагментах:
■ обеспечивают правильную ориентацию 3-х про-α-цепей относительно друг друга;
■ образуя меж- и внутрицепочечные дисульфидные мостики мешают спирализации N- и С-концов.
■ предотвращают образование крупных коллагеновых фибрилл в клетках.
Образованные структуры из трех про-α-цепей включаются в секреторные гранулы и экзоцитозом поступают во внеклеточное пространство.
Внеклеточный этап начинается с частичного протеолиза специфическими пептидазами N- и С-концевых фрагментов. Образованный тропоколлаген состоит из 3-х равных по длине (
1000 ам-т) полипептидных цепей.
Внеклеточная модификация радикалов лизина идет под действием лизилоксидазы. Рис.11.11.
Фибриллогенез – объединение тропоколлагена в микрофибриллы.
Молекулы тропоколлагена самопроизвольно располагаются параллельными рядами. В каждом ряду может находиться несколько молекул тропоколлагена, расстояние между ними
35нм. В параллельных рядах отдельные молекулы тропоколлагена смещены на ¼ относительно друг друга (67 нм). Структура фибрилл стабилизируется межмолекулярными ковалентными сшивками между радикалами лизина, аллизина, гидроксилизина или гидроксиаллизина Рис.11.12.
Количество и тип сшивок зависит от прочности ткани на растяжение. Наибольшее количество сшивок в коллагене ахиллового сухожилия.
Прочность коллагеновых волокон обусловлена :
· водородными связями между пептидными цепями коллагена;
· образованием тройной спирали из полипептидных цепей;
· множеством ковалентных связей между молекулами тропоколлагена
· сдвигом молекул тропоколлагена на 1/4 относительно друг друга в микрофибрилле коллагена.
Коллагеновые микрофибриллы в различных тканях отличаются по:
Коллагены – полиморфные белки, которые кодируется 20 генами. В разных тканях экспрессируются различные комбинации этих генов. Коллагены I, II, III – фибриллярные белки, особенно широко распространен коллаген I типа.
Коллаген – медленно обменивающийся белок. Время его полужизни недели или даже месяцы. Коллагеназа гидролизует сразу три нити в между остатками глицина и лейцина (изолейцина). Рис.11.15.
По количеству гидроксипролина, выделяемого за сутки с мочой, можно судить об активности процесса катаболизма коллагена. У здорового человека за сутки экскретируется 15-50 мг гидроксипролина.
· снижается скорость обмена коллагена;
· увеличивается количество поперечных связей между молекулами тропоколлагена, что делает их более жесткими и хрупкими;
· уменьшается соотношение ГАГ/коллаген;
· уменьшается количество связанной воды;
· увеличивается сухость кожи, изменяются механические свойства хрящей и сухожилий, понижается прозрачность роговицы глаза.
Эластичность, необходимая для функционирования кровеносных сосудов, легких, связок и кожи обеспечиваетсяэластином матрикса.Структура молекулы кодируется только одним геном.
Особенности строения эластина:
· белок построен из 750 аминокислотных остатков;
· молекулы содержат много аминокислот с гидрофобными радикалами. Глицин, валин, аланин и пролин составляют 70% от общего количества аминокислот полипептида;
· в состав цепи входит небольшое количество гидроксипролина, совсем нет гидроксилизина и углеводных фрагментов;
· полимерные молекулы не имеют строго определенной конформации; при натяжении упорядоченность структуры возрастает.
Синтез эластина и формирование полимерных структур.
Мономерная форма эластина синтезируется на рибосомах и называется тропоэластин.
Между остатками 4 остатками аллизина и лизина образуются десмозин (пиридинолин) или в похожий по структуре изодесмозин (изопиридинолин).
Структура десмозина Рис.11.16.
В образовании десмозина могут принимать участие две, три или четыре молекулы тропоэластина.
Эластические волокона могут растягиваться и снова сжиматься в двух направлениях, подобно резине.
Кроме десмозинов в эластине встречаются поперечные сшивки лизиннорлейцина, образованные двумя радикалами лизина.
Катаболизм.эластина. Время полураспада эластина составляет около 75 лет. Протеолиз белка происходит под действием эластазы, которая также может гидролизовать коллаген, иммуноглобулины и другие белки.
АДГЕЗИВНЫЕ.БЕЛКИ Внеклеточный матрикс содержит адгезивные гликопротеины: фибронектин, ламинин, нидоген,
Фибронектин – образующий фибриллы гликопротеин, он состоит из двух субъединиц, которые свернуты в серию.глобулярных.доменов. Отдельные домены могут взаимодействовать с: другими молекулами фибронектина, коллагеном, гликозамингликанами, интегриновыми рецепторами клеток и ферментом трансглутаминазой. Фермент образует ковалентную связь между остатками глутамина и лизина двух молекул фибронектина, фибронектина и коллагена или фибронектина и.других.белков. Структура фибронектина. Рис.11.18.
Эндотелиальные клетки, секретируют адгезивный гликопротеин ламинин – основной белок базальных мембран. Он состоит из трех пептидных цепей: α-, β- и γ имеющих доменное строение. Строение ламинина Рис.11.19.
Домены ламинина связываются с: другими молекулами ламинина, интегринами,.протеогликанами.базальной.мембраны,.гликопротеинами клеточной поверхности и белком нидогеном. N-концевые группы ламинина могут связывать Са 2+ и образовывать сетевидные структуры с помощью.Са-зависимого.взаимодействия.
Нидоген – доменный белок, в базальной мембране нидоген играет связующую роль между сетевидными слоями ламинина и сетью из коллагеновых.фибрил.
Чем обусловлена высокая прочность коллагеновых волокон
Коллагеновые волокна. Образуются коллагеновые волокна при полимеризации молекул тропоколлагена, имеющих длину около 280 нм и толщину 1,4 нм. Молекулу формируют три полипептидных цепочки, содержащих около тысячи аминокислотных остатков. Из них 1/3 составляет глицин, 1/3 — приходится на пролин или лизин и остальное — на другие аминокислоты. Молекулы тропоколлагена в коллагеновом волокне продольно ориентированы. Они сдвинуты друг относительно друга на 1/4 своей длины. За счет этого в протофибриллах коллагенового волокна возникает поперечная исчерченность с периодом повторяемости темных и светлых участков в 64-70 нм. При участии гликозаминогликанов и протеогликанов из протофибрилл коллагена формируются фибриллы толщиной 50-100 нм, а затем и волокна с поперечником 1-3 мкм. Коллагеновые волокна располагаются в различных направлениях, образуя подобие войлока. Они обладают малой растяжимостью и большой прочностью на разрыв. Так, совокупность коллагеновых волокон с поперечным сечением 1 см2 может выдержать нагрузку до 500 кг.
Эластические волокна. Это волокна диамером 0,2-10 мкм. В фиробластах синтезируются молекулы белка — эластина, содержащего аминокислоты: лизин, пролин, глицин, лейцин и в меньшей степени — оксипролин и другие. Внеклеточное формирование эластических волокон происходит в два этапа: 1) расположение фибрилл в виде пучка, 2) пропитывание этого пучка аморфным веществом. Молекулы эластина располагаются в фибриллах без определенной ориентировки (как молекулы в резине). Эластические волокна обладают большой растяжимостью и сравнительно малой прочностью. Модуль упругости их 4-6 кг/см2. Они обычно анастомозируют друг с другом, образуя широкопетлистую сеть.Переходными формами развития эластического волокна являются окситалановые и элауниновые волокна.
Ретикулярные, или ретикулиновые, волокна. Ретикулярные волокна имеют диаметр 0,1-2 мкм. Волокна эти называют также аргирофильными, так как они отличаются сродством к солям серебра и образованы коллагеном III типа. В нем повышено содержание цистеина и гексозамина. Таких аминокислот, как пролин и оксипролин меньше, чем в тропоколлагене. Под электронным микроскопом в ретикулярных волокнах обнаружена периодическая исчерченность. Ретикулярные волокна не перевариваются трипсином. Они образуют обычно сетчатые структуры типа решетки (отсюда их другое название — решетчатые волокна). Ретикулярные волокна входят в состав базальных мембран, располагаются вокруг сосудов, в том числе капилляров, нервных волокон, входят в состав сарколеммы мышечных волокон, вместе с ретикулярными клетками формируют остов кроветворных органов.
Основной (аморфный) компонент межклеточного вещества — это микроскопически бесструктурная основа, в которой находятся клетки и волокна соединительной ткани. Здесь осуществляются метаболические процессы. Биохимически — это полужидкий вязкий гель, состоящий из макромолекул, преимущественно полисахаридов, и большого количества тканевой жидкости. Полисахаридный компонент основного вещества присутствует в виде гиалуроновой кислоты (гликозаминогликана) — длинной молекулы, которая в водных растворах образует изгибы, занимая участок диаметром 400 нм и при этом связывает очень большой объем жидкости. Соседние молекулы гиалуроновой кислоты формируют сеть, в петлях которой находится тканевая жидкость. Гликозаминогликаны связывают межклеточную воду, регулируют осмотическое давление и ионный состав основного вещества.
Гликозаминогликаны бывают двух видов: сульфатированные (гепаринсульфат, хондроитинсульфат, дерматансульфат); и несульфатированные — гиалуроновая кислота. Сульфатированные гликозаминогликаны в норме соединены с белками и образуют протеогликаны. Этот процесс регулируют тучные клетки. В составе основного вещества также обнаружены липиды, альбумин, глобулины, минеральные вещества и др. Таким образом, молекулы гликозаминогликанов формируют сети, ячейки, каналы, по которым циркулирует тканевая жидкость, и это является молекулярным барьером для бактерий и вирусов.
Выработка фибриллярного и основного компонентов межклеточного вещества — главное проявление дифференцировки клеток фибробластического ряда.
КОЛЛАГЕН
ФАКТОР, ОГРАНИЧИВАЮЩИЙ
ГИБКОСТЬ
В этой главе мы ознакомимся с существующей в настоящее время системой знаний о механических свойствах, механической ультраструктуре и биохимических составляющих соединительных тканей и влиянии на них процесса старения и иммобилизации. Наша задача состоит в том, чтобы понять, как воздействуют эти переменные на функцию соединительных тканей, которые в значительной мере определяют степень гибкости человека.
Соединительная ткань содержит множество специализированных клеток. Различные виды клеток выполняют функции защиты, хранения, транспортировки, связывания, соединения, поддержки и ремонта. Остановимся на клетках, выполняющих привязывающие функции.
КОЛЛАГЕН
Коллаген является преобладающим белком в организме млекопитающих. Ученые полагают, что он — основной структурный компонент живой ткани. Коллаген определяют как белок, содержащий три цепочки аминокислот, образующих тройную спираль. Два отличительных физических свойства коллагеновых волокон — высокий предел прочности на разрыв и относительная нерастяжимост.
Коллагеновые волокна, как правило, бесцветные и располагаются пучками. Им свойственна лишь незначительная степень растяжимости. В то же время они характеризуются высоким пределом прочности на разрыв и поэтому являются основными компонентами таких структур, как сухожилия и связки, подвергающиеся силе растяжения.
В настоящее время различают 5 видов коллагена, каждый из которых, в свою очередь, имеет подвиды (Jungueira, Carneiro, Long, 1989). Наиболее распространенной формой коллагена является коллаген типа 1. Он содержится в коже, костях, сухожилиях и связках.
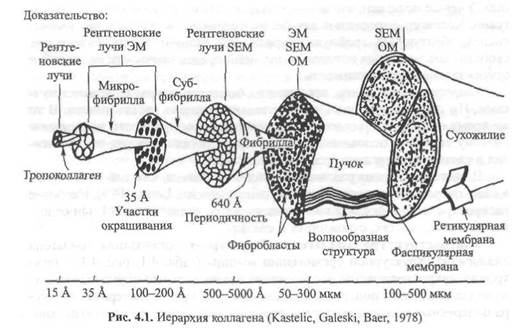
Ультраструктура коллагена.Структурная организация коллагена аналогична структурной организации мышцы (табл. 4.1, рис. 4.1). Электронно-микроскопическое исследование показывает, что отдельные волокна коллагена имеют поперечнополосатую структуру. Характерная структура поперечных полосок коллагена отражает ее ультраструктурную органи-
| Таблица 4.1. Сравнение структуры коллагена н мышцы |
| Мышца |
| Коллаген |
| Мышца Мышечный пучок Мышечное волокно Миофибрнлла Миофиламент Саркомер (функциональная единица) Актин Миозин Титин Поперечные мостики |
| Сухожилие Пучок Фибрилла Субфибрилла Микрофибрилла Молекула коллагена (функциональная единица) Альфй| цепочки (2) Альфа2 цепочки (I) Поперечные связи |
зацию. Знание этой структуры имеет большое значение для понимания механизма двух основных физических свойств коллагена, о которых мы говорили выше.
Коллаген сухожилия расположен пучками (см. рис. 4.1). Диаметр пучков колеблется от 50 до 300 мкм. Фибриллы, в свою очередь, состоят из пучков коллагена — субфибрилл, диаметр которых составляет примерно 10-20 км. Каждая субфибрилла состоит из пучков коллагена, микрофибрилл или филаментов. Их диаметр достигает 3,5 нм. Размеры филаментов в данной ткани колеблются в зависимости от возраста и других факторов.
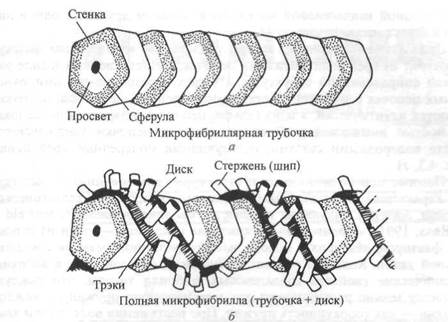
Согласно мнению Пну и Леб-
лона (1986), наименее изученным фиброзным компонентом соединительной ткани является коллаген микрофибрилла. Своему названию он обязан Лоу (1961а, 19616, 1962). Ину и Леблон (1986) изучали микрофибриллы соединительной ткани мыши под мощным электронным микроскопом. Они выяснили, что микрофибриллы состоят из двух частей: собственно трубочки и поверхностного диска. Поперечное сечение трубочки характеризуется почти пятиугольной стенкой и полостью (просве-
| Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость |
Рнс 4.2. Модель тубулярной части типичной микрофибриллы (а). Она состоит из пятиугольных сегментов, объединенных в столбик. Модель типичной микрофибриллы (б). Диск изображен в форме спирали, однако может иметь другую организацию. X 2 700 000
(Inoue, Leblond, 1986)
том), а которой имеется шарик, называемый сферулом. Поверхностный диск представляет собой лентообразную структуру, окутывающую трубочку. Диск имеет плотные края —трэки с шипами, расположенными с определенным интервалом (рис. 4.2). В настоящее время мы не знаем, имеется ли эта структура в микрофибриллах человека.
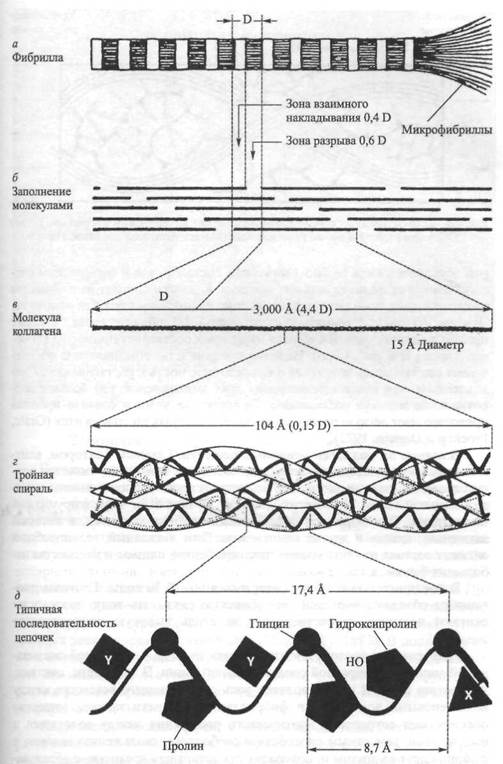
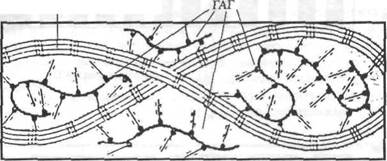
Коллагеновая микрофибрилла состоит из взаимонакладываю щихся молекул коллагена, расположенных с одинаковым интервалом друг от друга. Эти единицы аналогичны саркомерам мышечных клеток. Многие крошечные коллагеновые фибриллы (рис. 4.3, а) состоят из волокна коллагена. Поперечные полосы фибриллы — следствие взаимного перекрытия молекул коллагена (рис. 4.3, б). Сама молекула коллагена (рис. 4.3, в) состоит из трех полипептидных цепочек, напоминающих тройную спираль (рис, 4.3, г). Аминокислотная последовательность этих полипептидных цепочек характеризуется наличием глицина в каждой третьей кислоте (рис. 4.3, д). Х-положение после глицина нередко представлено пролином, а Y-положение, предшествующее глицину — гидроксипролином. Молекулы коллагена, в свою очередь, состоят из кольцевидных спиралей аминокислот. Молекулы коллагена очень маленькие, их длина составляет около 300 нм, а диаметр — 1,5 нм (рис. 4,3, в). Взаимное накладывание молекул коллагена и обусловливает наличие поперечной исчерченности. Ее частота (периодичность) в коллагеновых фибриллах колеблется от 60 до 70 нм, в зависимости от источника и степени гидратации. Измерения показывают, что между
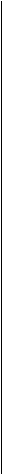


При сильном увеличении можно увидеть, что коллагеновая молекула состоит из трех полипептидных цепочек, представленных в виде ригидной спиралевидной структуры. Из трех переплетенных аминокислотных цепочек в коллагене в организме человека две (альфа1 цепочки) являются идентичными, а одна (альфа2 цепочка) отличается последовательностью аминокислот. Считают, что три цепочки удерживаются вместе водородными связями, образующими поперечные соединения (рис. 4.3, г).
Помимо поперечнополосатой структуры, для соединительных тканей характерны волнообразные ундуляции (колебания) коллагеновых волокон. Явление ундуляции называется «волнистостью» (Portenfield и De Rosa, 1991). «Волнистая» организация коллагена — один из основных факторов, лежащих в основе высокоэластичной реакции соединительной ткани. Коллаген состоит из фибрилл, соединенных в волокна. Механические свойства коллагеновых фибрилл таковы, что каждую фибриллу можно рассматривать как механическую пружину, а каждое волокно — как совокупность пружин. При растяжении волокна его длина увеличивается. Подобно механической пружине, энергия, обеспечиваемая для растягивания волокна, хранится в волокне, и именно выделение этой энергии обусловливает возврат волокна в нерастянутое положение, когда прикладываемую нагрузку убирают (Ozkaya и Nordin, 1991).
Поперечные соединения коллагеновой ткани.Главным фактором, который увеличивает растягивающую силу коллагеновых структур, является наличие внутримолекулярных поперечных соединений между альфа и альфа2 цепочками молекулы коллагена, а также межмолекулярных поперечных соединений между коллагеновыми субфибриллами, филаментами и другими волокнами. Эти поперечные соединения связывают молекулы в прочную единицу. Обычно чем меньше расстояние между одним поперечным соединением и другим или чем больше число поперечных соединении на данном расстоянии, тем выше эластичность (R.M.Alexander, 1975, 1988).
Ученые высказывают предположение, что количество поперечных соединений связано с интенсивностью обмена коллагена: коллаген непрерывно производится и расщепляется. Если количество производимого коллагена превышает количество расщепляемого, число поперечных соединений увеличивается и сопротивление структуры растягиванию повышается, и наоборот. По мнению некоторых специалистов, физическая нагрузка или мобилизация снижают число поперечных соединений, увеличивая интен- сивность обмена коллагена (W.M.Bryant, 1977; Shephard, 1982). Результаты последних исследований также показывают, что эти два фактора могут играть определяющую роль в предотвращении образования поперечных соединений.
Биохимический состав коллагена.Молекула коллагена представляет собой сложную спиралевидную структуру, механические свойства кото-
Глава 4 ■ Соединительная тканы фактор, ограничивающий гибкость
Рис. 43. Ультраструктура коллагена. Рисунок Б.Тагавы (Prockop, Gurman, 1977)

 |
| Голлагеновая фибрилла |

рой обусловлены как ее биохимическим составом, так и физическим расположением ее индивидуальных молекул. Коллаген состоит из множества сложных молекул — аминокислот, однако из них выделяют три основные. Это аминокислоты: глицин, составляющий 1/3 общего числа, а также пролин и гидроксипролин, каждая из которых составляет примерно 1/4 общего числа (см. рис. 4.3, г)). Наличие пролина и гидроксипролина обеспечивает стабильность коллагена и его резистентность к растягиванию. Следовательно, чем выше концентрация этих аминокислот, тем больше сопротивление молекул растяжению. Присутствие азота в составе пролина предотвращает легкую ротацию участков, в которых он содержится (Grant, Prockop и Darwin, 1972).
Влияние на коллаген основных веществ. Главным фактором, влияющим на механические свойства или поведение коллагена, является присутствие основных веществ. Эти вещества широко распространены в соединительной ткани. Во многих участках их называют цементирующими веществами. Они образуют нефиброзный элемент матрикса, в который заключены клетки и другие компоненты. Этот вискозный, гелеподобный элемент состоит из гликозаминогликанов, белков плазмы и множества небольших белков, а также воды.
В соединительной ткани содержится 60-70 % воды. Гликозамино-гликаны обладают большой способностью связывать воду, поэтому их считают частично ответственными за столь высокую концентрацию воды.
Гиалуроновая кислота и «захваченная» ею вода — основной смазывающий материал фиброзной соединительной ткани. В частности, считают, что вместе с водой она выполняет роль смазывающего вещества между коллагеновыми волокнами и фибриллами. Это смазывающее вещество обеспечивает сохранение критического расстояния между волокнами и фибриллами, тем самым способствуя свободному скольжению волокон и фибрилл друг за другом и, возможно, предотвращая чрезмерное образование поперечных соединений (рис. 4.4).



Гликозаминогликан (ГАГ) представляет собой полисахарид, ко
торый состоит из повторяющихся единиц дисахарида.-Четырьмя ос
новными гликозаминогликанами в соединительной ткани являются
гиалурововая кислота, хондроитин-4-сульфат, хондроитин-6-сульфат
и дерматан сульфат.»Как правило, гликозаминогликаны привязывают
ся к белку. Их собирательное название лротеоглйканы. В соедини
тельной ткани протеопшканы соединяются с водок и образуют про-
— теогликановое соединение. По определению, протеогликан состоит
из белка или пояипептида, к которому ковалентно прикреплена одна
или несколько цепочек ГАГ. Каждая группа дисахарида в цепочке
ГАГ нередко имеет две отрицательно заряженные группы. Их высо
кий отрицательный заряд притягивает протеопшканы, а осмотичес
кий дисбаланс, обусловленный высокой локальной концентрацией
ионов, «вытягивает» воду из окружающих участков. Лротеоглйканы,
. таким образом, поддерживают гидратацию матрикса и физически
функционируют как-создатели наполненного водой компартмента.
Они поддаются,деформаций и не являются.ригидными, поскольку
цепочки ГАГ мобильные и могут сближаться. Это выбывает повыше
ние плотности внутреннего заряда, который противостоит силам
сжатия.
Электромеханические и физиологические свойства
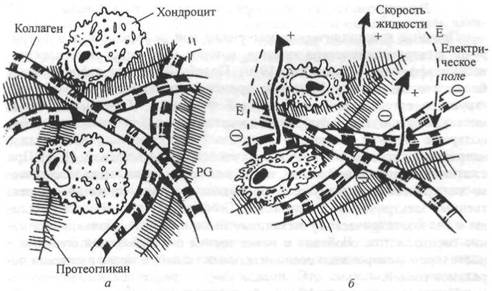
Прочные кристаллические материалы при деформации демонстрируют электромеханическое явление, которое называется пьезоэлектрическим эффектом (Athenstaedt, 1970). Подобный эффект наблюдается в биологических тканях. Одним из примеров может быть молекулярная структура естественной коллагеновой фибриллы. Тропоколлагеновые молекулы, образующие фибриллу, представляют собой электрически биполярные стержни, имеющие постоянный электрический потенциал в направлении продольной тропоколлагеновой оси (Athenstaedt, 1970). При сжатии соединительной ткани, такой, как хрящ, происходит механичес-ко-электрическая трансдукция, приводящая к возникновению существенных электрических потенциалов (Grodzinsky, 1983). В последние годы к пьезоэлектрическому механизму было приковано большое внимание специалистов, особенно с точки зрения его возможной функции в росте и ремоделировании соединительных тканей, а также в лечении переломов костей.
Пьезоэлектрический эффект в биологических тканях называют электрокинетикой или потенциалами движения. Кроме потенциалов течения и токов, деформация биологических тканей может вызвать градиенты гидростатического давления, поток жидкости и деформацию клеток в матрик-

Можно допустить, что потенциалы течения представляют собой механизм, посредством которого механические силы растягивания трансдукци-руются в различные видь/ генной экспрессии и, следовательно, в белковый синтез (например, создание особых изоформ титина и других тканей). В этой связи исследование Сатклиффа и Девидсона (1990) показало, что трансдукция механической силы а генную экспрессию эластина клетками гладкой мышцы во время растягивания может способствовать их специальной адаптации.
До настоящего времени в большинстве исследований рассматривали суставной хрящ под действием сил сжатия. Возможность получения весьма важной информации на этой основе объясняется следующим. Во-первых, суставной хрящ относится к категории соединительной ткани. Во-вторых, удлинение происходит одновременно вследствие сжатия. Известно, что электростатические силы можно рассматривать как межмолекулярные взаимодействия, которые существенно влияют на реологическое поведение биологических тканей (Grodzinsky, Lipshitz, Glimcher, 1978). В частности, внеклеточный матрикс выполняет важную функцию сопротивления силам растяжения, сжатия и сдвига. Как уже
Рнс 4.5. Схематическое изображение соединительной ткани с коллагеновыми фибриллами, протеогликановыми кластерами и клетками (а). Динамическое сжатие ткаии приводит к деформации, градиентам давленая, потоку жидкости и потенциалам течения (и потокам) во внеклеточном матриксе в клеточной среде (б)
Глава 4 ■ Соединительная тканы фактор, ограничивающий гибкость

женными группами, как правило, делают матрикс более жестким, что
повышает его способность противостоять деформации и выдерживать
нагрузку (Grodzinsky, 1983, 1987; Muir, 1983; рис. 4.5). Внеклеточный
матрикс содержит отрицательный фиксированный заряд, а интерстици-
альная жидкость, таким образом, содержит достаточное количество до
полнительных (+) контроионов для обеспечения электронейтральности;
обусловленные сжатием изменения плотности фиксированного заряда
вызывают изменение концентрации всех подвижных видов ионов во
внеклеточном матриксе, согласно Доннану и законам эле ктро нейтраль
ности. Таким образом, протеогликаны действуют как «молекулярные
пружины» (Muir, 1983).
Сравнение влияния статических и динамических
Исследования суставного хряща in vivo показывают, что статическая иммобилизация, пониженная нагрузка или статическое сжатие сустава приводят к появлению участков повышенной фиксированной плотности заряда, повышению концентрации положительных контрионов и осмотического давления. Это интибирует синтез и обработку протеогликанов (Gray и др., 1988; J.P.G.Urban, Bayliss, 1989), а также нарушает питание хряща. С другой стороны, динамическое сжатие приводит к увеличению гидростатического давления, потока жидкости, потенциалов течения и изменению формы клетки, что может стимулировать биосинтез (A.Hall, Urban, Gehl, 1991; Y.-J.Kim и др., 1994). Таким образом, цикличная нагрузка и разгрузка способствуют сохранению здоровья хряща. Вместе с тем, при чрезмерной нагрузке повышается поток жидкости, напряжение и его интенсивность. Высокие уровни напряжения или его интенсивность могут привести к повреждению матрикса, отечности тканей н усилению диффузии в хряще (San и др., 1991), что ведет к хроническому повреждению хряща.
Влияние процесса старения на коллаген. Коллаген по мере своего старения претерпевает определенные физические и биохимические изменения. В конечном итоге они отражают снижение минимальной степени растяжимости, которая имела место, и увеличение ригидности. Так, например, процесс старения приводит к увеличению диаметра коллагеновых волокон в различных тканях. Кроме того, с течением времени усиливается процесс кристаллизации фибрилл. Увеличение степени кристаллизации или ориентации еще больше укрепляет межмолекулярные связи и повышает резистентность к дальнейшей деформации. Более того, предполагают, что процесс старения связан с увеличением числа внутри- и межмолекулярных поперечных соединений. Эти дополнительные поперечные соединения явно ограничивают способность скольжения коллагеновых молекул относительно друг друга. Важная роль в процессе старения принадлежит дегидратации. Так, с возрастом снижается количество воды, связанной с соединительными тканями, такими, как сухожилие. По некоторым
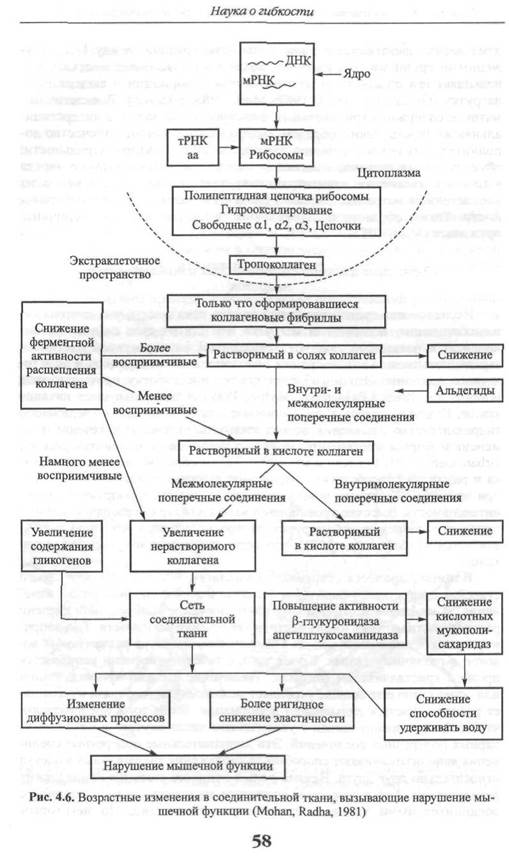 |

оценкам, если в сухожилиях маленьких детей содержание воды составляет приблизительно 80-85 %, то у взрослых этот показатель снижается до 70% (Elliot, 1965; рис. 4.6).
Ультраструктурная основа и физиологический предел удлинения
коллагена. В отличие от саркомера, волокно коллагена является сравнительно нерастяжимым. Волокно коллагена настолько неэластично, что оно даже не растягивается при воздействии нанего массы, в 10 000 раз превышающей его собственную (Vevzar, ] 963). Исследования показывают, что микроскопические волокна можно растянуть примерно на 10 % их исходной длины, прежде чем они порвутся. На молекулярном уровне степень растяжения кол-лагеновых фибрилл составляет около 3 % (Ramachandran, 1967). Электронно-микроскопическое исследование показывает, что при удлинении коллагена в нем происходит постепенное изменение внутрифибриллярной периодичности и латеральных измерений. В одном из ранних исследований (Cowan, McGavin, North, 1955) было установлено, что растяжение приводит к повторяющемуся увеличению осевого интервала с 0,286 до 0,310 нм и больше.
Считают, что подобное растяжение первоначально осуществляется в результате распрямления волокон и последующего постепенного скольжения их относительно друг друга. В результате увеличивается степень кристаллизации или ориентации, что, в свою очередь, усиливает межмолекулярную связь и повышает резистентность к дальнейшему удлинению. Кроме того, возрастает взаимопереплетение соседних молекул. Это приводит к увеличению силы интерцепочек, что обеспечивает повышенное сопротивление силам деформации. Дальнейшее растягивание приводит к превышению межмолекулярных связей и разрыву ткани (Laban, 1962; L.Weiss, Greep, 1983).
Дата добавления: 2015-05-19 ; просмотров: 4253 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ