Чем обусловлена пиронинофилия и базофилия цитоплазмы клеток
Чем обусловлена пиронинофилия и базофилия цитоплазмы клеток
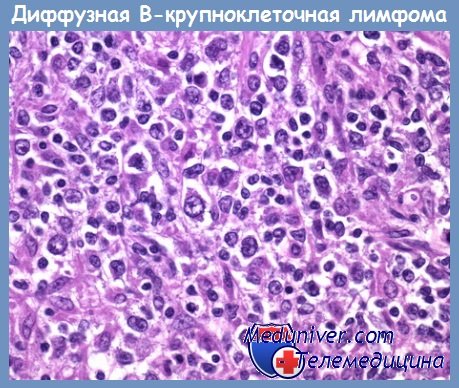
Диффузная В-крупноклеточная лимфома (KILL): центробластная, иммунобластная; WF: диффузная крупноклеточная, крупноклеточная иммунобластная, плазмоцитоидная]
К диффузным крупноклеточным В-клеточным лимфомам относят крупноклеточные (бластные) лимфомы с весьма широким спектром клеточного состава опухолевой ткани.
При преобладании в опухолевом инфильтрате крупных центрофолликулярных клеток — центробластов опухоль получила название центробластной лимфомы. Центробласт — крупная (в 3—4 раза превышающая по размеру малый лимфоцит) клетка с овально-округлым светлым ядром и 2—3 ядрышками, локализующимися у ядерной мембраны. Цитоплазма опухолевого центробласта разной степени пиронинофилии и базофилии.
Иммунобласт — бласттрансформированная клетка В-клеточной линии лимфопоэза. Для него характерно округлое пузырьковидное ядро с крупным центрально расположенным ядрышком. Ободок цитоплазмы широкий, обычно интенсивно пиронинофильный (базофильный). При иммунобластной лимфоме могут наблюдаться морфологические признаки плазмоцитарной дифференцировки.
При явном преобладании в опухолевой ткани центробластов или иммунобластов поставить диагноз несложно. В большинстве случаев даже разграничение лимфом на центробластные и иммунобласт-ные не так просто, так как в опухолевом инфильтрате могут присутствовать как одни, так и другие клетки.
Положение усугубляется тем, что при этой категории лимфом опухолевая ткань может иметь чрезвычайно «пестрый» клеточный состав за счет присутствия в инфильтрате того или иного количества клеток типа центробластоидных, занимающих по структуре промежуточное положение между центробластом и центроцитом, клеток с многодольчатыми ядрами (из трех и более долек), а также мелких лимфоидных клеток и гистиоцитов.
Встречаются случаи, когда в качестве реактивного компонента представлены Т-клетки, причем количество последних может быть весьма значительным (до 90 % от клеточного состава). Такая форма лимфомы получила название богатой Т-клетками В-крупноклеточной лимфомы. Помимо мелких, с неправильной формой ядер Т-клеток, встречаются гистиоциты, эозинофилы; в опухолевой ткани много сосудов, поэтому возникает необходимость дифференциальной диагностики с периферической Т-клеточной лимфомой.
Гистологическими дифференциальнодиагностическими критериями надо считать отсутствие переходных форм от мелких клеток к крупным бластным, а также преимущественно округло-овальную форму ядер последних (центробласт, иммунобласт), что, как правило, не свойственно Т-клеточным лимфомам.
В качестве отдельного подтипа крупноклеточной В-клеточной лимфомы выделяют вариант с первичной локализацией опухоли в средостении — медиастинальную (тимичсскую) В-крупноклеточную лимфому. Основанием для такого выделения послужили особенности клинической картины: заболевают молодые люди, чаще женщины, опухоль локальная (I— II стадия), часто пораждается тимус, рецидивы преимущественно экстранодальные.
Кроме того, необходимо учитывать морфологический субстрат. Последний характеризуется чрезвычайным клеточным полиморфизмом опухолевой ткани, связанным прежде всего с различной конфигурацией ядер опухолевых клеток, присутствием многоядерных форм. Цитоплазма опухолевых клеток обычно светлая, в опухолевой ткани могут встречаться тонкие коллагеновые волокна, окружающие группы клеток.
Первичная лимфома серозных оболочек (primary effusion lymphoma) — подтип диффузной крупноклеточной В-клеточной лимфомы выделен благодаря клиническому своеобразию, обусловленному локализацией опухолевого субстрата. Последний поражает серозные оболочки, не формируя узловатых масс. Болеют почти исключительно молодые мужчины, большинство из них ВИЧ-инфицированные.
Заболевание сопровождается выпотом в плевре, перикарде, асцитом. Серозные оболочки могут быть инфильтрированы как относительно мономорфными клетками типа иммунобластов, так и полиморфными крупными бластами с большим содержанием дву- и многоядерных форм.
Иммунофенотип диффузной В-крупноклеточной лимфомы: CD19+, CD20+, CD22+, CD79a+ (возможна потеря экспрессии одного или более панВ-маркеров), sIgM/cIgM > sIgG/cIgG > sIgA/cIgA в 50-75 % случаев; CD5+ до 10 % случаев, CD10+ в 25-50 % случаев, BCL-2+ в 30-50 % случаев, BCL-6+ более чем в 50 % случаев, 40— 90 % опухолевых клеток Ki-67-позитивные.
С учетом иммунофенотипических характеристик в настоящее время выделяют диффузные В-крупноклеточные лимфомы:
1) фолликулярного происхождения (CD10+ и/или BCL-6+);
2) из активированных клеток центра фолликула с экспрессией одного маркера фолликулярного происхождения и одного активационного маркера (CD138 или MUM 1);
3) из активированных нецентрофолликулярных клеток (MUM l+ и CD138+).
Диффузные В-крупноклеточные лимфомы 1-й группы относятся к лимфомам с благоприятным клиническим течением.
Цитологическая характеристика диффузной В-крупноклеточной лимфомы. В цитограмме определяются бластные клетки однотипной морфологии или сочетание различных субпопуляций. Клеточный состав может быть представлен следующими клетками:
1) центробластами;
2) иммунобластами. Иммунобласт — крупная бластная клетка (15—29 мкм) с равномерно-сетчатой структурой хроматина, одним крупным или одним — тремя небольшими ядрышками, расположенными в центральной зоне ядра, умеренно выраженной базофильной цитоплазмой. Могут присутствовать признаки плазмоцитарной дифференцировки;
3) бластными клетками с полиморфными, в частности многодольчатыми, ядрами с небольшими ядрышками;
4) плазмобластами — крупными клетками с обильной интенсивно базофильной цитоплазмой, содержащей просветление вокруг округлого ядра — околоядерное гало, с насыщенным хроматином и неотчетливыми ядрышками.
В каждой диффузной крупноклеточной В-клеточной лимфоме определяются в том или ином количестве макрофаги с выраженными признаками фагоцитоза, значительное количество разрушенных бластных клеток с нитями ядерного детрита, «голыми» ядрами. Характерна высокая клеточность материала, в качестве «фона» отмечается большое количество цитоплазматических глобул.
Для диффузной крупноклеточной В-клеточной лимфомы, богатой Т-клетками и/или гистиоцитами, характерны немногочисленные дискретно расположенные крупные опухолевые клетки с округло-овальными или многодольчатыми ядрами среди выраженного мелкоклеточного фона, представленного мелкими лимфоидными клетками без признаков атипии и/или гистиоцитами. Могут в различном количестве встречаться плазматические клетки, эозинофильные лейкоциты.
Дифференциальную диагностику диффузной В-крупноклеточной лимфомы проводят с помощью иммуногистохимического исследования с атипичным подвариантом лимфомы Беркитта, ангиоиммунобластной Т-клеточной лимфомой. Если отмечается выраженная плазмоцитарная дифференцировка, в дифференциально-диагностический ряд необходимо включать плазмоклеточную (плазмобластную) миелому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ПЛАЗМАТИЧЕСКИЕ КЛЕТКИ
ПЛАЗМАТИЧЕСКИЕ КЛЕТКИ (греч. plasma вылепленное, оформленное; син.: плазмоциты, клетки Унны) — высокоспециализированные клеточные элементы кроветворной ткани, функцией которых является продукция иммуноглобулинов.
Плазматические клетки выделены в 1891 г. П. Унной в особый вид клеток благодаря ярко выраженной базофилии цитоплазмы. В дальнейшем было установлено, что эта базофилия связана с высоким содержанием в цитоплазме плазматических клеток РНК, что характерно для клеток, активно синтезирующих белок. В результате наблюдений над культурами лимфоцитов и обнаружения среди них переходных форм А. А. Максимов предположил, что Плазматические клетки образуются из лимфоцитов (см.). В последующем оказалось, что Плазматические клетки образуются только из В-лимфоцитов. Интерес к Плазматическим клеткам усилился в связи с обнаружением зависимости между повышением титра антител в процессе гипериммунизации и увеличением количества Плазматических клеток в лимфатических узлах и селезенке. В 1948 г. Фагреус (A. Fagraeus) показала, что в течение 2—3 дней после иммунизации животных различными антигенами в селезенке образуются «переходные клетки» с большим округлым ядром, содержащим много ядрышек, и слабо базофильной цитоплазмой. Затем происходит уменьшение величины этих клеток и их ядер, а базофилия и пиронинофилия (при окраске метиловым зеленым-пиронином) цитоплазмы усиливаются. «Переходные клетки» разные исследователи называли большими лимфоцитами, миелобластами, лимфобластическими П. к., макрогистиоцитами, базофильными макрофагами.
П. к. у человека и высших позвоночных в большом количестве обнаруживаются в лимф, узлах и селезенке. В лимф, узлах П. к. располагаются гл. обр. в мякотных тяжах, а в селезенке — в красной пульпе. Часто их скопления окружают мелкие кровеносные сосуды и располагаются вокруг лимфатических фолликулов. Во вторичных фолликулах встречаются в основном плазмобласты. П. к. обнаруживаются также в рыхлой соединительной ткани по ходу сосудов, в серозных оболочках (особенно сальника), строме различных желез (молочных, слюнных), слизистой оболочке кишечника, костном мозге.
Большинство П. к. являются короткоживущими клеточными элементами с жизненным циклом ок. 2 сут., но нек-рые из них существуют до 6 мес. В конце жизненного цикла П. к. образуются гомогенные белковые тельца Русселя (см. Русселя тельца). Одна П. к. образует, как правило, антитела одной специфичности. Набор П. к. обеспечивает синтез различных антител.
Известно несколько стадий созревания П. к. При пролиферации иммунокомпетентного лимфоцита, активированного антигеном, происходит гиперплазия гранулярной эндоплазматической сети, в связи с чем клетки становятся более пиронинофильными. Затем они превращаются в плазмобласты и плазмоциты.
Плазмобласт диам. ок. 20 мкм имеет крупное ядро с несколькими ядрышками. Цитоплазма его интенсивно базофильна (пиронинофильна) и окружает ядро поясом средней ширины, изредка в ней встречаются мелкие вакуоли. Ядро расположено центрально или эксцентрично, вокруг него видна зона просветления. В цитоплазме увеличивается количество мембран эндоплазматической сети и связанных с ними рибосом. В незрелой П. к. диам. 20—25 мкм (Проплазмоцит) хроматиновые нити ядра несколько утолщены, сеть их уплотнена, но хроматин располагается сравнительно равномерно. В ядре содержится одно небольшое ядрышко, перинуклеарная зона обычно хорошо выражена, цитоплазма широкая, гомогенная или с наличием базофильных вакуолей. Количество мембран эндоплазматической сети продолжает нарастать, число рибосом увеличивается, пластинчатый комплекс (аппарат Гольджи) гипертрофируется. Зрелая П. к. диам. 10—20 мкм имеет расположенное чаще эксцентрично компактное относительно малого размера ядро круглой или овальной формы с грубоглыбчатой структурой и очаговыми плотными радиальными скоплениями хроматиновых нитей — колесовидное ядро. В П. к. описаны внутриядерные структуры (ядерные тельца), фибриллярный компонент которых содержит РНК, а плотный гранулярный — ДНК. Появление ядерных телец связывают с усиленным белковым синтезом. Объем цитоплазмы П. к. заметно превосходит объем ядра, в ней содержится много мелких вакуолей (пенистая цитоплазма). Сбоку от ядра, или охватывая его, находится ясно очерченное светлое поле — центросфера. По окружности светлого поля в цитоплазме рассеяны митохондрии.
В зоне гипертрофированного пластинчатого комплекса возрастает число электронно-плотных гранул секреторного характера. Цитоплазма переполнена структурами в виде мешочков и канальцев, на стенках мембран эндоплазматической сети (рис.) видны многочисленные рибосомы (см.); количество полисом и свободных рибосом резко уменьшается. Расширенные цистерны эргастоплазмы заполняются электронноплотным материалом.
Синтез тяжелых (Н) и легких (L) цепей молекул иммуноглобулинов происходит в рибосомах зернистой эндоплазматической сети. Здесь же они объединяются в целые иммуноглобулиновые молекулы (H2L2), секретируемые в окружающую среду. Сборка начинается с взаимодействия связанных с рибосомами Н-цепей с пулом свободных L-цепей. Затем в течение нескольких минут образуются дисульфидные связи и мономеры объединяются в пентамеры (в случае синтеза IgM) с участием L-цепи. Транспорт иммуноглобулинов из канальцев зернистой эндоплазматической сети в пластинчатый комплекс с последующей секрецией осуществляется относительно медленно и за 1 час секретируется меньше половины синтезированных молекул. На мембране П. к. экспрессированы H-2-антигены и дифференцировочный антиген плазматических клеток (Р. С.). Последний отсутствует на предшественниках П. к. и количество его увеличивается по мере созревания от плазмобласта до зрелой П. к. На части П. к. определяется рецептор для связывания Fc-фрагмента IgG. Количество специфических иммуноглобулиновых рецепторов при созревании от плазмобласта до зрелой П. к. уменьшается. Плазмобласты активно синтезируют РНК. В зрелых П. к. синтез РНК отсутствует. Активное образование в них белка предполагает синтез его на матрицах и в рибосомах, заготовленных в плазмобластах.
Пролиферация клеток плазмоцитарной ряда называется плазмоцитарной реакцией. Плазмоцитарная реакция является важным морфол. критерием иммунол, процесса, сопровождающегося выработкой антител (см.). Динамика ее обычно несколько опережает нарастание и снижение титра антител в сыворотке крови. При повторной иммунизации плазмоцитарная реакция более интенсивна и развивается быстрее, чем при первичной. После введения антигена в лимфоидной ткани начинается гиперплазия ретикулярных клеток, Макрофагальная реакция и активация В-лимфоцитов, характеризующихся наличием специфических иммуноглобулиновых рецепторов (см. Иммунокомпетентные клетки). При этом происходит ряд клеточных делений и из одного плазмобласта в ходе дифференцировки образуется несколько сотен зрелых П. к. Их объединяет происхождение от одной и той же клетки, т. е. они образуют клеточный клон (см.). В ходе дифференцировки плазмобласта в зрелую П. к. изменяется не только интенсивность синтеза антител, но и происходит переход от синтеза IgM к синтезу IgG. Через несколько дней объем клона уменьшается. Популяция П. к. поддерживается за счет дифференцировки новых клеток-пред-шественников. В процессе дифференцировки от B-лимфоцита до П. к. специфичность и авидность вырабатываемых клетками антител не меняется.
Количество П. к. увеличивается при различных инфекционных, инфекционно-аллергических и воспалительных заболеваниях. Скопления П. к. находят в грануляционной ткани, особенно при хрон, гнойном воспалении, в специфической грануляционной ткани при сифилисе. В меньшем количестве П. к. встречается в туберкулезных гранулемах. Число П. к. увеличивается при ревматических заболеваниях, раке, циррозе печени и др. В крови П. к. появляются в небольших количествах при острых инфекциях, лейкозе. Бластоматозные разрастания П. к. наблюдаются при миеломной болезни (см.) и изолированной плазмоцитоме. При болезни Вальденстрема происходит трансформация клеток лимфоидного ряда в П. к., секретирующие макроглобулин. Описаны иммунодефицитные состояния, сопровождающиеся отсутствием П. к., синтезирующих определенный класс иммуноглобулинов, напр. IgA при болезни Крона. При агаммаглобулинемии Брутона у больных отсутствуют иммуноглобулины всех классов, а в лимфоидной ткани нет П. к.
Для цитол, изучения П. к. используют основные красители (по-лихромный метиленовый синий, толуидиновый синий, метиловый зеле-ный-пиронин, азур-эозин, смесь Романовского — Гимзы). Большое значение для изучения происхождения и функциональной роли П. к. имел разработанный Кунсом (А.Н. Coons) и соавт. иммуногистохимический метод (см. Иммунофлюоресценция), который дал возможность идентифицировать клетки, содержащие антитела. Широко применяется метод локального гемолиза в геле Ерне — Нордина, позволяющий исследовать морфофункциональные свойства живых антителообразующих клеток, в том числе П. к. (морфологию клеток, синтез ДНК, РНК и белка, синтез и секрецию специфических антител, авидность синтезируемых антител и т. п.). Иммуноферментный метод, основанный на маркировке антител пероксидазой хрена или использовании этого фермента в качестве антигена, дает возможность выявить локализацию антител в П. к. на электронно-микроскопическом уровне. Радиоиммунол, и радиоавтографический методы позволяют исследовать биосинтез и транспорт антител в П. к.
Гурвич А. Е. и др. Иммуногенез и клеточная дифференцировка, М., 1978; Петров Р. В. Иммунология и иммуногенетика, с. 45, М., 1976; Фриденштейн А. Я. и Чертков И. Л. Клеточные основы иммунитета, М., 1969; Avrameas S. a. Leduс Е.Н. Detection of simultaneous antibody synthesis in plasma cells and specialized lymphocytes in rabbit lymph nodes, J. exp. Med., v. 131, p. 1137, 1970; Bessis М. С. Ultrastructure of lymphoid and plasma cells in relation to globulin and antibody formation, Lab. Invest., v. 10, p. 1040, 1961; Sell S. Immunology, immunopathology and immunity, Hagerstown, 1980; TakahashiT., Old L. J. a. Boyse Е.А. Surfase alloantigens of plasma cells, J. exp. Med., y. 131, p. 1325, 1970; Tartakoff A. a. Vassalli P. Plasma cell immunoglobulin M molecules, J. Cell Biol., v. 83, № 2, pt 1, p. 284, 1979, bibliogr.
Диагностическое значение изменения морфологии лейкоцитов
Большинство токсических изменений отражает асинхронность созревания между ядром и цитоплазмой. Во время нормального гранулоцитопоэза удлинение и пикноз ядра происходят одновременно с конденсированием хроматина и исчезновением цитоплазматических белков (РНК – в виде рибосом и шероховатой эндоплазматической сети, которые придают синий цвет цитоплазме). В результате ускоренного созревания в периферическую кровь попадают незрелые клетки. Они могут быть более крупными (гигантизм), с остатками шероховатой эндоплазматической сети, рибосомами, менее конденсированным хроматином. Эти клетки также могут иметь пенистую или вакуолизированную цитоплазму.
Нейтрофильная токсичность встречается как у палочкоядерных, так и у сегментоядерных нейтрофилов. Нейтрофильную токсичность в мазке крови оценивают субъективно и полуколичественно. Различают легкую, умеренную и выраженную нейтрофильную токсичность.
30% измененных клеток – выраженная нейтрофильная токсичность.
Далее каждый вид нейтрофильной токсичности оценивается в баллах или «+».
Различают 5 основных видов нейтрофильной токсичности:
Возможно появление телец
Деле в цитоплазме нейтрофилов при длительном хранении образца крови (более суток). Следовательно, их появление следует интерпретировать с осторожностью. Наличие 1-2 телец Деле в цитоплазме нейтрофилов оценивается как легкая нейтрофильная токсичность, 3-4 – как умеренная, более 4 – как выраженная.
В отличие от бело-розовой цитоплазмы «здорового» нейтрофила, у токсически измененной клетки цвет цитоплазмы будет варьироваться от серо-голубого до темно- синего. Подобное диффузное неравномерное окрашивание цитоплазмы нейтрофилов связано с наличием рибосом и остатков шероховатой эндоплазматической сети. Изменение цвета цитоплазмы от неоднородно серого до светло-голубого оценивается как легкая нейтрофильная токсичность, окрашивание цитоплазмы в равномерно голубой цвет – как умеренная, от синего до темно-синего – как выраженная.
Ядерный хроматин у таких клеток более рыхлый, тонкий, менее конденсированный. Могут встречаться клетки, значительно превосходящие в размере нейтрофилы здоровых животных (гигантские нейтрофилы). Гигантские нейтрофилы возникают в результате пропуска одного из клеточных делений в костном мозге. Эти клетки могут иметь как нормальную морфологию ядра, так и гипосегментированные ядра. Появление подобных клеток мы можем часто наблюдать в крови у кошек, реже – у собак. Гигантские нейтрофилы всегда свидетельствуют о выраженной нейтрофильной токсичности. Появление гигантских нейтрофилов в крови характерно для тяжелых воспалительных процессов или дисгранулопоэза.
Основные причины появления гигантских нейтрофилов в крови кошек:
1. тяжелые бактериальные инфекции (пиоторакс, пиометра и т. д.);
2. острая миелоидная лейкемия (ОМЛ);
3. миелодиспластический синдром;
4. вирусная лейкемия кошек (FeLV);
5. вирус иммунодефицита кошек (FIV);
6. панлейкопения (в результате временной гранулоцитарной гипоплазии).
Под токсической зернистостью принято понимать появление мелких красных зерен (гранул) в цитоплазме нейтрофилов. Данный вид нейтрофильной токсичности характерен для лошадей, коров, лам, верблюдов, он редко встречается у собак и кошек. Эти зерна представляют собой первичные гранулы, сохранившие способность окрашиваться с той же интенсивностью, как это в норме свойственно гранулам промиелоцитов. Токсическую зернистость следует дифференцировать от гранул, содержащихся в цитоплазме нейтрофилов животных с лизосомными болезнями накопления. Ее следует отличать от розовой окраски вторичных гранул, которая не является признаком токсичности. Следует также помнить, что у кроликов, морских свинок, птиц и рептилий вторичные гранулы нейтрофилов окрашиваются в красный цвет (гетерофилы). Токсическая зернистость всегда свидетельствует о выраженной нейтрофильной токсичности.
Степени тяжести нейтрофильной токсичности:
Тельца Деле+
Базофилия цитоплазмы+
Пенистость цитоплазмы++
Темная серо-синяя пенистая цитоплазма+++
Токсическая зернистость+++
Следует помнить, что общеклинический анализ крови (ОАК) должен обязательно включать в себя подсчет лейкограммы вручную и оценку морфологии лейкоцитов. Врач-лаборант всегда должен указывать любой вид нейтрофильной токсичности в бланке результата ОАК. Автоматический подсчет лейкограммы очень сомнителен и не способен оценить изменения морфологии нейтрофилов. Для исследования морфологии нейтрофилов не рекомендуется использовать быстрые красители (например, лейкодиф). Оптимальной окраской считается окраска по Романовскому или Паппенгейму. Токсические изменения часто указывают на тяжелый воспалительный процесс и сопровождаются выраженным нейтрофильным лейкоцитозом со сдвигом ядра влево и появлением незрелых клеток (промиелоцитов, миелоцитов и метамиелоцитов), что является плохим прогностическим признаком. Пациентам с подобной картиной крови необходимы ежедневные исследования общеклинического анализа крови для оценки реакции на проводимое лечение. Важно помнить, что некоторые животные могут иметь сдвиг влево без нейтрофильной токсичности и токсические изменения без сдвига влево (редко). В последнем случае врач- клиницист должен искать другие причины появления токсичности (например, миелодисплазии, длительное хранение образца крови и т. д.). Появлению нейтрофильной токсичности способствуют инфекционные процессы, опухолевые, метаболические. В случае нейтрофилии со сдвигом ядра вправо, нейтропении или при отсутствии изменений в лейкограмме оценка морфологии нейтрофилов может оказатьдополнительную помощь врачу-клиницисту в постановке диагноза.
Диагностическое значение изменения морфологии лейкоцитов
Большинство токсических изменений отражает асинхронность созревания между ядром и цитоплазмой. Во время нормального гранулоцитопоэза удлинение и пикноз ядра происходят одновременно с конденсированием хроматина и исчезновением цитоплазматических белков (РНК – в виде рибосом и шероховатой эндоплазматической сети, которые придают синий цвет цитоплазме). В результате ускоренного созревания в периферическую кровь попадают незрелые клетки. Они могут быть более крупными (гигантизм), с остатками шероховатой эндоплазматической сети, рибосомами, менее конденсированным хроматином. Эти клетки также могут иметь пенистую или вакуолизированную цитоплазму.
Нейтрофильная токсичность встречается как у палочкоядерных, так и у сегментоядерных нейтрофилов. Нейтрофильную токсичность в мазке крови оценивают субъективно и полуколичественно. Различают легкую, умеренную и выраженную нейтрофильную токсичность.
30% измененных клеток – выраженная нейтрофильная токсичность.
Далее каждый вид нейтрофильной токсичности оценивается в баллах или «+».
Различают 5 основных видов нейтрофильной токсичности:
Возможно появление телец
Деле в цитоплазме нейтрофилов при длительном хранении образца крови (более суток). Следовательно, их появление следует интерпретировать с осторожностью. Наличие 1-2 телец Деле в цитоплазме нейтрофилов оценивается как легкая нейтрофильная токсичность, 3-4 – как умеренная, более 4 – как выраженная.
В отличие от бело-розовой цитоплазмы «здорового» нейтрофила, у токсически измененной клетки цвет цитоплазмы будет варьироваться от серо-голубого до темно- синего. Подобное диффузное неравномерное окрашивание цитоплазмы нейтрофилов связано с наличием рибосом и остатков шероховатой эндоплазматической сети. Изменение цвета цитоплазмы от неоднородно серого до светло-голубого оценивается как легкая нейтрофильная токсичность, окрашивание цитоплазмы в равномерно голубой цвет – как умеренная, от синего до темно-синего – как выраженная.
Ядерный хроматин у таких клеток более рыхлый, тонкий, менее конденсированный. Могут встречаться клетки, значительно превосходящие в размере нейтрофилы здоровых животных (гигантские нейтрофилы). Гигантские нейтрофилы возникают в результате пропуска одного из клеточных делений в костном мозге. Эти клетки могут иметь как нормальную морфологию ядра, так и гипосегментированные ядра. Появление подобных клеток мы можем часто наблюдать в крови у кошек, реже – у собак. Гигантские нейтрофилы всегда свидетельствуют о выраженной нейтрофильной токсичности. Появление гигантских нейтрофилов в крови характерно для тяжелых воспалительных процессов или дисгранулопоэза.
Основные причины появления гигантских нейтрофилов в крови кошек:
1. тяжелые бактериальные инфекции (пиоторакс, пиометра и т. д.);
2. острая миелоидная лейкемия (ОМЛ);
3. миелодиспластический синдром;
4. вирусная лейкемия кошек (FeLV);
5. вирус иммунодефицита кошек (FIV);
6. панлейкопения (в результате временной гранулоцитарной гипоплазии).
Под токсической зернистостью принято понимать появление мелких красных зерен (гранул) в цитоплазме нейтрофилов. Данный вид нейтрофильной токсичности характерен для лошадей, коров, лам, верблюдов, он редко встречается у собак и кошек. Эти зерна представляют собой первичные гранулы, сохранившие способность окрашиваться с той же интенсивностью, как это в норме свойственно гранулам промиелоцитов. Токсическую зернистость следует дифференцировать от гранул, содержащихся в цитоплазме нейтрофилов животных с лизосомными болезнями накопления. Ее следует отличать от розовой окраски вторичных гранул, которая не является признаком токсичности. Следует также помнить, что у кроликов, морских свинок, птиц и рептилий вторичные гранулы нейтрофилов окрашиваются в красный цвет (гетерофилы). Токсическая зернистость всегда свидетельствует о выраженной нейтрофильной токсичности.
Степени тяжести нейтрофильной токсичности:
Тельца Деле+
Базофилия цитоплазмы+
Пенистость цитоплазмы++
Темная серо-синяя пенистая цитоплазма+++
Токсическая зернистость+++
Следует помнить, что общеклинический анализ крови (ОАК) должен обязательно включать в себя подсчет лейкограммы вручную и оценку морфологии лейкоцитов. Врач-лаборант всегда должен указывать любой вид нейтрофильной токсичности в бланке результата ОАК. Автоматический подсчет лейкограммы очень сомнителен и не способен оценить изменения морфологии нейтрофилов. Для исследования морфологии нейтрофилов не рекомендуется использовать быстрые красители (например, лейкодиф). Оптимальной окраской считается окраска по Романовскому или Паппенгейму. Токсические изменения часто указывают на тяжелый воспалительный процесс и сопровождаются выраженным нейтрофильным лейкоцитозом со сдвигом ядра влево и появлением незрелых клеток (промиелоцитов, миелоцитов и метамиелоцитов), что является плохим прогностическим признаком. Пациентам с подобной картиной крови необходимы ежедневные исследования общеклинического анализа крови для оценки реакции на проводимое лечение. Важно помнить, что некоторые животные могут иметь сдвиг влево без нейтрофильной токсичности и токсические изменения без сдвига влево (редко). В последнем случае врач- клиницист должен искать другие причины появления токсичности (например, миелодисплазии, длительное хранение образца крови и т. д.). Появлению нейтрофильной токсичности способствуют инфекционные процессы, опухолевые, метаболические. В случае нейтрофилии со сдвигом ядра вправо, нейтропении или при отсутствии изменений в лейкограмме оценка морфологии нейтрофилов может оказатьдополнительную помощь врачу-клиницисту в постановке диагноза.