Чем образованы основные оксиды
Оксиды: классификация, получение и химические свойства
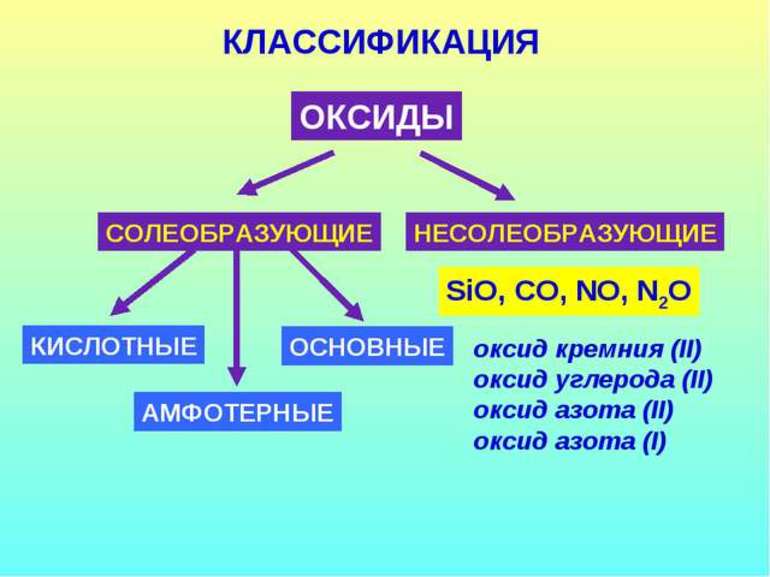
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Общие сведения
В 1775 году французский химик А. Лавуазье правильно истолковал результаты опытов Д. Пристли. Он понял, что газ, поддерживающий горение в герметичном сосуде, — это не часть воздуха, а новый химический элемент. Лавуазье назвал его оксигеном, что в переводе с греческого означает «образующий кислоты», так как думал, что новый элемент входит во все кислоты. Однако такая теория не была верной. Название кислород — это своего рода калька с французского, введенная М. В. Ломоносовым.
Кислород — газ без цвета, запаха и вкуса. При сильном охлаждении превращается сначала в голубую жидкость, затем — в кристаллы синего цвета. Имеет валентность 2 и семь степеней окисления в зависимости от вещества, с которым взаимодействует.
Степени окисления для разных соединений:
Образование оксидов
Получаются оксиды как при непосредственном вступлении кислорода в реакцию с другим химическим элементом, так и при косвенном взаимодействии — в результате разложения кислот, солей и оснований. Самый простой способ получения окисла — это сжигание вещества в кислороде. Формулы оксидов можно определить исходя из значений валентности кислорода и второго химического вещества, а номенклатура названий образуется по схеме:
Например, Mn2O7 — оксид марганца (VII). Допускается название по количеству атомов кислорода — монооксид, диоксид и т. п. Широко распространены и названия, сложившиеся исторически.
Все существующие оксиды разделяются на солеобразующие и несолеобразующие. Последние являются оксидами неметаллов, не имеющих соответственных гидроксидов. Таких соединений немного, к ним относятся оксиды одно- и двухвалентных неметаллов — вода H2O, токсичные газы монооксид углерода CO и оксид азота (II) NO, «веселящий газ» N2O, соединения с кислородом серы и кремния. Они довольно инертны, если и взаимодействуют с другими веществами, то солей не образовывают. Например, при растворении в воде N2O и SO2 образуется серная кислота, и выделяется азот.
Классификация солеобразующих соединений
В химии соединения с кислородом разделяют по характеру их соответствия основаниям, кислотам и амфотерным образованиям. Если металл, составляющий формулу с кислородом, имеет несколько степеней окисления, то промежуточное значение будет у амфотерного, самое большое — у кислотного, а самое низкое — у основного соединения.
К основным оксидам относятся соединения металлов, степень окисления которых равна +1 или +2. Им соответствуют гидроксиды, относящиеся к классу оснований. Реагируют с кислотами, в результате чего получаются соль и вода. В периодической системе усиление основных характеристик наблюдается в главных подгруппах сверху вниз. Список основных оксидов:
К кислотным или ангидридам относятся оксиды неметаллов и металлов со степенью окисления больше +5.
Поскольку в них химические элементы находятся в высшей степени активности, их еще называют высшими. Кислотные свойства таких соединений повышаются по мере продвижения по таблице Менделеева слева направо, так как увеличивается положительный заряд ионов элемента с возрастанием номера периода.
Ангидриды соответствуют гидроксидам, относящимся к кислотам, они могут растворяться в щелочах, образуя при этом соль и воду. Некоторые вступают в реакцию с водой. Типичные представители кислотных оксидов: SO2, SO3, CrO3, P2O5, Cl2O7, Mn2O7. Металлы, которые могут иметь степень окисления +2, +3, +4, образуют с кислородом амфотерные соединения, проявляющие то кислотные, то основные свойства в зависимости от условий химической реакции. К ним относятся Fe2O3, Cr2O3, Al2O3, ZnO, BeO и MnO2.
Физические и химические свойства
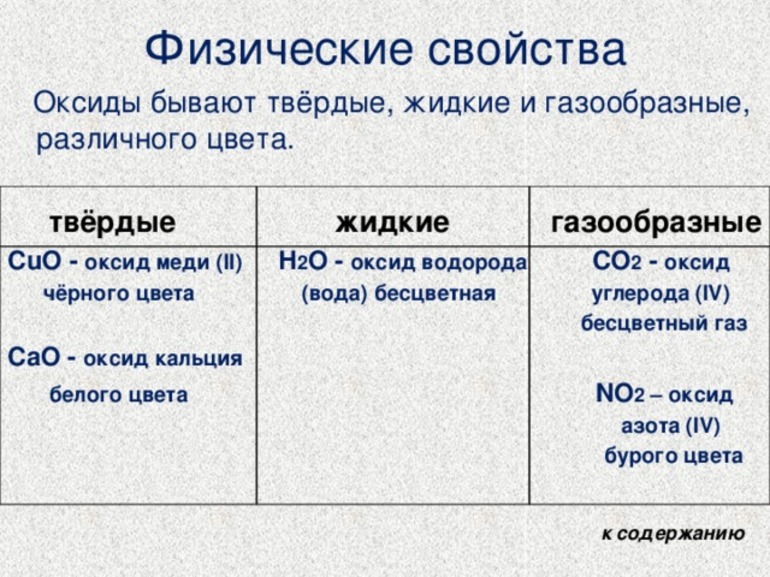
Свойства оксидов физического характера определяются структурой их строения. Окислам металлов присуще ионное строение, что определяет и их свойства. Чаще всего это твердые вещества самых разных окрасок. Не растворяются в воде, за исключением соединений щелочных и щелочноземельных металлов. Имеют высокие температуры кипения и плавления. Другие свойства определяются их составом.
Вещества, образованные неметаллическими элементами, чаще всего имеют молекулярный вид строения и более разнообразны по агрегатному состоянию — встречаются жидкие, газообразные и твердые оксиды. К жидкостям относятся:
Окиси серы, углерода и азота при нормальных условиях находятся в газообразном состоянии. Главные химические свойства основных оксидов:
Разные соединения имеют и уникальные свойства. CuO при сплавлении с основаниями, т. е. когда смесь веществ дополнительно нагревают, образует купраты (двойные соли меди и другого металла). Это говорит о слабовыраженных амфотерных свойствах окиси меди.
Также она довольно хорошо восстанавливается до металлического состояния аммиаком, углем и водородом.
FeO распадается при среднем нагревании, но если продолжать поднимать температуру, то получатся оксид Fe3O4 и железо. Может вступать в реакцию с сероводородом и восстанавливаться водородом и коксом. BaO при нагревании до 600 градусов переходит в пероксид бария и может восстановиться до металла при повышении температуры с цинком, магнием и кремнием.
Кислотные оксиды также хорошо реагируют с водой, взаимодействуют с основаниями и основными оксидами. Углекислый газ, растворяясь в воде, образует слабую угольную кислоту, ее применяют для газирования воды, при этом происходит обратная реакция. Диоксид углерода, вступая в реакцию с едким натром NaOH, образует соль угольной кислоты, известную в обиходе как кальцинированная сода. Из углекислого газа получается и так называемая горькая соль MgCO3, для этого нужно соединить CO2 и MgO.
Амфотерные оксиды вступают в химические реакции и с кислотами, и с основаниями. При взаимодействии со щелочами часто получаются соли двойных металлов.
Области применения
Оксиды очень широко применяются в быту, промышленности, медицине и других областях. Вода H2O — источник жизни на земле. Гематит или красный железняк Fe2O3 используют для пигментации красных красок, а магнетит или магнитный железняк Fe3O4 — в металлургии и для изготовления электродов, так как он хорошо проводит электрический ток.
Негашеная известь применяется в строительстве и быту для борьбы с вредителями древесины. Мелкие кристаллы корунда Al2O3 наносят на наждачную бумагу для создания хорошего шлифовального эффекта. Крупные используют в изготовлении искусственных рубинов и сапфиров для ювелирных изделий и часов.
Нанесение оксида железа (II) на сталь называется воронением или чернением. Соединение образовывает прочный тонкий слой на поверхности. Регулируя его толщину, можно получить так называемые цвета побежалости — пленки, изменяющей свой цвет в радужном спектре. Это свойство используют в технологии нанесения цветных рисунков на сталь.
Углекислый газ CO2 используют и в твердом, и в жидком виде. В пищевой промышленности его применяют при изготовлении разнообразных газированных напитков, соды, сахара. В виде сухого льда он используется для сильного охлаждения продуктов и материалов. Жидкой углекислотой наполняют огнетушители.
Широкое применение получил сернистый газ SO2. Его используют в химической промышленности для производства серной кислоты. Способность сернистого газа убивать микроорганизмы и плесень позволила использовать его для дезинфекции подвалов, погребов, складских помещений, а также для хранения и перевозки фруктов и ягод.
Оксид кремния (IV) SiO2 — тугоплавкое и твердое вещество. Встречается в природе в кристаллическом и аморфном состоянии. Кристаллический кремнезем — это минералы кварца в виде халцедона, агата, яшмы, горного хрусталя. Кварцевый песок используют для изготовления стекла, бетона и кирпича. Полудрагоценные камни обрабатывают ювелиры, особенно красиво кристаллы выглядят при использовании одновременно с SiO2 оксида свинца PbO.
Аморфный кремнезем называется опалом и выражается формулой SiO2 ∙ nH2O. Из него делают украшения, химическую посуду, кварцевые лампы. Соединения, имеющие устойчивый цвет, используют для пигментации стекол и красок. CO2O3 придает материалам синий, Cr2O3 — зеленый, ZnO — белый, MnO2 — розовый цвет.
Окись цинка нашла и медицинское применение, ее добавляют в маски и кремы, подсушивают раны при кожных заболевания. Жженую магнезию MgO из-за ее способности хорошо реагировать с соляной кислотой желудочного сока назначают как средство при повышенной кислотности, она помогает убрать изжогу и выступает сорбентом. Оксид хрома (VI) CrO3 используется в восстановительной хирургии. Это вещество безвредно для человеческого организма.
Основные оксиды, перечень, список, физические и химические свойства
Основные оксиды, перечень, список, физические и химические свойства.
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды:
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Какие оксиды основные? Список, примеры и перечень основных оксидов:
| Название оксида: | Химическая формула: |
| Оксид бария | BaO |
| Оксид калия | K2O |
| Оксид кальция | CaO |
| Оксид лития | Li2 O |
| Оксид магния | MgO |
| Оксид меди II | CuO |
| Оксид натрия | Na2O |
| Оксид ртути II | HgO |
Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
| Название оксида: | Химическая формула: | Внешний вид: |
| Оксид бария | BaO | бесцветные кристаллы |
| Оксид калия | K2O | твердое бесцветное или бледно-желтое вещество |
| Оксид кальция | CaO | белое кристаллическое вещество |
| Оксид лития | Li2 O | бесцветные кристаллы |
| Оксид магния | MgO | твердое белое вещество |
| Оксид меди II | CuO | твердое черное вещество |
| Оксид натрия | Na2O | бесцветные кристаллы |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
Получение основных оксидов:
Основные оксиды получаются в результате:
2Сa + О2 → 2CaО (t = 300 o C);
Ba(OH)2 → BaO + H2О (t = 780-800 o C);
Сa(OH)2 → СaO + H2О (t = 520-580 o C);
BaCO3 → BaO + CO2 (t = 1000-1450 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
MgО + Н2О → Mg(ОН)2 (t = 100-125 o C);
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C);
MgО + SiО2 → MgSiО3 (t = 1100-1200 o C);
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 o C);
BaO + SnO → BaSnO2 (t = 1000 o C);
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 o C);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 o C);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 o C);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 o C);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 o C);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 o C);
Li2O + Mg → 2Li + MgO (t > 800 o C);
2Li2O + Si → 4Li + SiO2 (t = 1000 o C);
2MgО + Si → 2Mg + SiО2;
MgО + Са → Mg + СаО (t = 1300 o C);
CuО + H2 → Cu + H2О (t = 300 o C);
CuО + С → Cu + СО (t = 1200 o C);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.