Чем образована паренхима тимуса
Чем образована паренхима тимуса
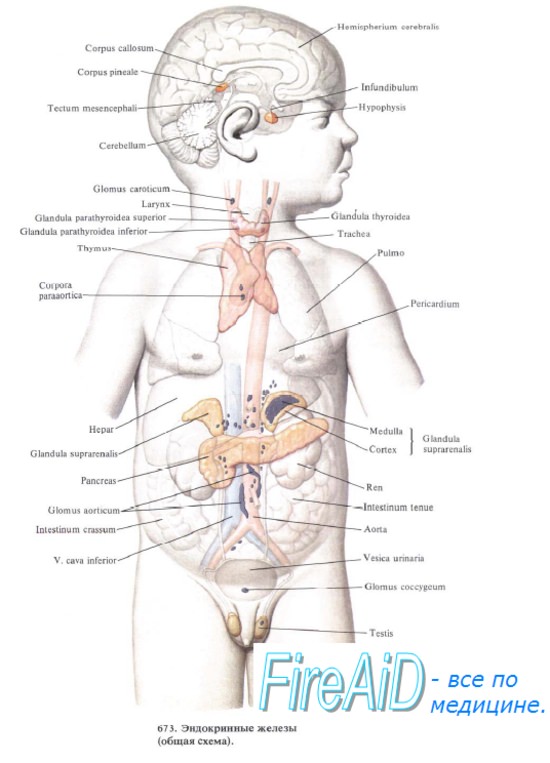
Вилочковая железа, thymus, расположена в верхнепередней части грудной полости позади рукоятки и части тела грудины. Она состоит из двух долей: lobus dexter и lobus sinister, соединенных друг с другом посредством рыхлой соединительной ткани.
Верхние, более узкие, концы долей обычно выходят за пределы грудной полости, выступая над верхним краем рукоятки грудины и иногда достигая щитовидной железы. Расширяясь книзу, вилочковая железа ложится впереди больших сосудов, сердца и части перикарда. Величина железы изменяется с возрастом.
У новорожденного масса ее примерно 12 г и продолжает расти после рождения до наступления половой зрелости, достигая 35—40 г, после чего (14—15 лег) начинается процесс инволюции, вследствие которого масса у 25-летних понижается до 25 г, к 60 годам — менее 15 г, к 70 — около 6 г. Атрофии подвергаются главным об- ^ разом латеральные участки железы и отчасти нижние, так что железа, поскольку она сохраняется у взрослого, принимает более удлиненную форму.
При инволюции элементы железы в значительной степени замещаются жировой тканью с сохранением общих очертаний железы.
Топография вилочковой железы
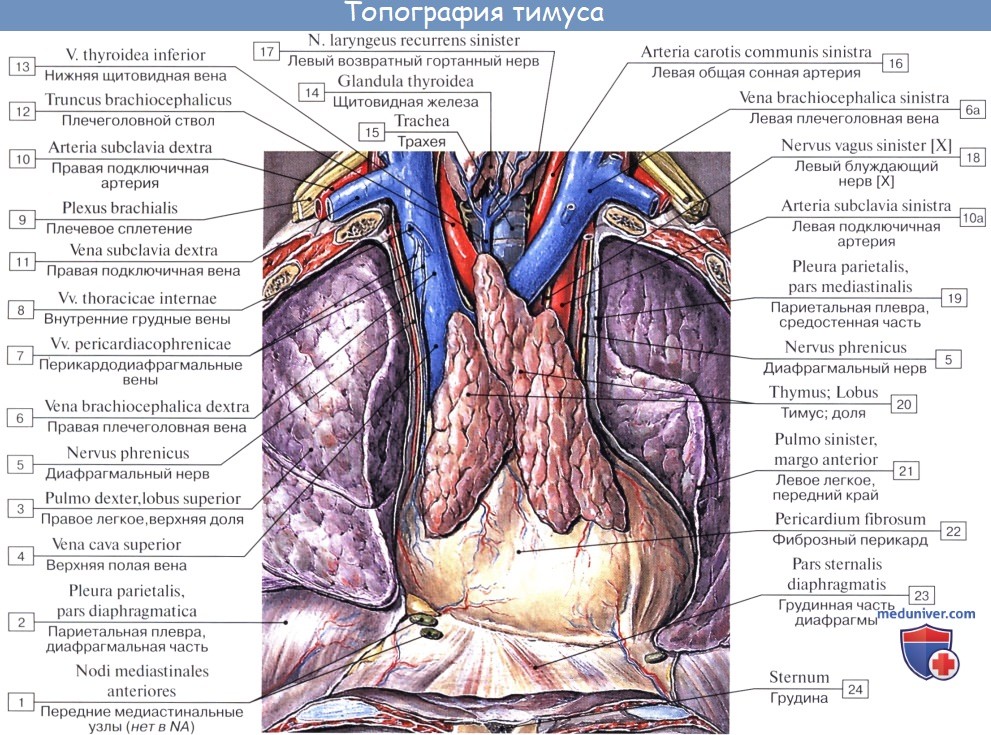
Скелетотопически железа у детей проецируется вверху на 1 — 1,5 см над рукояткой грудины, внизу достигает III, IV, а иногда и V ребра. У взрослых, как правило, шейный отдел железы отсутствует, ее верхний край находится за рукояткой грудины на различном расстоянии книзу от яремной вырезки. Нижний же край соответствует второму межреберью или III ребру.
Синтопия вилочковой железы (тимуса) различна у детей и у взрослых. Так, у детей до 3 лет шейная часть железы находится за грудино-щитовидными, грудино-подъязычными мышцами. Задняя поверхность прилежит к трахее. Грудной отдел передней поверхностью прилежит к задней поверхности грудины. Нижняя поверхность железы прилежит вплотную к перикарду. Задняя поверхность прилежит к крупным сосудам. Передненаружные поверхности справа и слева покрыты плеврой.
У взрослых после удаления рукоятки грудины видна клетчатка, в которой обнаруживаются различной величины железистые остатки. Спереди железа покрыта листками соединительной ткани, которые как бы продолжая шейные фасции, соединяются внизу с перикардом.
Строение вилочковой железы (тимуса)
Вилочковая железа покрыта капсулой, которая отдает внутрь железы междольковые перегородки, разделяя ее на дольки. Каждая долька состоит из коркового и мозгового вещества. Корковое вещество образовано сетью эпителиальных клеток, в петлях которой лежат лимфоциты вилочковой железы (тимоциты). В мозговом веществе эпителиальные клетки уплощаются и ороговевают, образуя так называемые тельца вилочковой железы.
Научная электронная библиотека
Шевченко Б П, Гончаров А Г, Сеитов М С,
5.4.1.Вилочковая железа
Или тимус развивается из нижней стенки эпителия третьего жаберного кармана и четвертой жаберной дуги. Эпителиальные тяжи инфильтрируются лимфоцитарными и другими клетками, прорастают кровеносными сосудами и железа приобретает строение лимфоэпителиального органа. Достигнув максимального развития к половозрастному периоду, затем она подвергается инволюции, ее паренхима замещается жировой и соединительной тканями (Ю.Т. Техвер, 1970). Но доказано, что у северного оленя железа полностью не исчезает, начиная с трех лет, она приобретает плоскую форму с изрезанными краями, дольки ее становятся плотными, теряют выпуклость. С возрастом сглаживается дольчатый рисунок тимуса, консистенция постепенно меняется от рыхлой, эластичной, к сочной уплотненной (И.С. Решетников, 1979; И.С. Решетников, Л.Н. Владимиров, 2002).
Тимус, или вилочковую железу А.И. Акаевский (1984) относит к органам кроветворения и внутренней секреции, позднее его стали считать только органом кроветворения, сейчас вернулись к функции кроветворения, иммунной защиты и внутренней секреции
(Н.А. Жеребцов, 2004). Железа является ценным эндокринным сырьем (И.С. Решетников, К.С. Кириков, 2002). Для получения таких биопрепаратов как тимолин, тимозин, тимоген и др.
В ходе утробного развития железа растет в каудальном направлении вдоль дыхательного горла (трахеи), зачатки ее сливаются и у плодов, новорожденных различают парные шейные, непарную и грудную доли. Тимус имеет строму и паренхиму, поделенную на дольки. В дольках различают корковое и медуллярное вещество (зоны или слои).
В корковой зоне из лимфобласт образуются предшественники Т-лимфоцитов, часть их погибает, а другая – проникает в мозговое вещество, где переходят в зрелые «Т-»лимфоциты, а от туда током крови (3–5 %) по венулам и лимфатическим сосудам выносятся в большой круг кровообращения. Оставшиеся клетки (95–97 %) фагоцитируются макрофагами, а дендритные (отросчатые) клетки мозгового вещества образуют эпителиальные тельца (т. Гассаля).
Т-лимфоциты, совместно с гормонами тимуса (тимозин, тимопоэтин и др.), способствуют развитию как клеточного, так и гуморального иммунитета, повышая защитные функции лимфатических узлов, селезенки и др.
Абсолютная масса тимуса оренбургской пуховой козы интенсивно возрастает во время утробного развития и, особенно, до 15 дней после рождения. Далее ее масса возрастает до шести месяцев и остается на этом уровне до девяти месяцев (табл. 93), после чего темп прироста массы резко снижается и в возрасте 12 месяцев у козликов составляет 12,2, а козочек – 9,4 грамма. Таким образом, наибольшей абсолютной массы железа достигает у козликов в возрасте 9 меся-
цев – 24,12 г, а у козочек – 20,44 г. С этого возраста наступают инволятивные (involutio – свёртывание, утрата) процессы.
В утробном развитии наблюдается неравномерный абсолютный прирост массы тимуса, особенно интенсивно она увеличивается в возрасте плодов 90, 120 дней, а пики максимального прироста приходятся на возраст плодов 145 дней, к рождению повышается, но незначительно. Из данного анализа следует, что в раннем этапе плодного развития прирост массы железы у козликов составил 2,84 г, а у козочек – 2,26 г, в позднем, соответственно, 10,64 и 10,4 г, то есть у козочек он всегда был ниже, чем – у козликов.
Чем образована паренхима тимуса
Тимус — центральный орган лимфоидного кроветворения и иммунной защиты организма. В тимусе происходит антигеннезависимая дифференцировка костномозговых предшественников Т-лимфоцитов в иммунокомпетентные клетки — Т-лимфоциты. Последние осуществляют реакции клеточного иммунитета и участвуют в регуляции гуморального иммунитета, что происходит, однако, не в тимусе, а в периферических органах кроветворения и иммунной защиты. Кроме того, в экстрактах тимуса обнаружено более 20 биологически активных веществ, в том числе дистантного действия, что позволяет отнести тимус к железам эндокринной системы.
Развитие тимуса. Тимус закладывается на 2-м месяце эмбриогенеза в виде небольших выпячиваний стенок 3-й и 4-й пар жаберных карманов. На 6-й неделе зачаток железы имеет отчетливо выраженный эпителиальный характер. На 7-й неделе он утрачивает связь со стенкой головной кишки. Эпителий закладки железы, образуя выросты в мезенхиму, приобретает сетевидное строение. Вначале плотная эпителиальная закладка железы разрыхляется благодаря заселению ее лимфоцитами. Число их быстро нарастает, и железа приобретает структуру лимфоэпителиалъного органа.
Врастающая мезенхима с кровеносными сосудами подразделяет тимус на дольки. В каждой дольке различают корковое и мозговое вещество. В гистогенезе тимуса в мозговом веществе долек образуются слоистые эпителиальные образования — эпителиальные жемчужины, или тельца Гассаля. В их составе определяются плотные эпителиальные клетки, концентрически наслаивающиеся друг на друга.
Строение тимуса. Снаружи вилочковая железа покрыта соединительнотканной капсулой. Отходящие от нее перегородки — септы — подразделяют тимус на дольки. Основу дольки составляют отростчатые эпителиальные клетки — эпителиоретикулоциты, в сетевидном остове которых находятся тимические лимфоциты (тимоциты). Источником развития Т-лимфоцитов являются костномозговые стволовые кроветворные клетки. Далее предшественники Т-лимфоцитов (претимоциты) поступают с кровью в тимус и превращаются здесь в лимфобласты.
В корковом веществе тимуса одни из них под действием выделяемых эпителиальными клетками пептидных гормонов — тимозина, тимопоэтина и др., а также макрофагов превращаются в антиген-реактивные Т-лимфоциты — приобретают рецепторы к строго определенным антигенам. Они выходят из тимуса, не попадая в мозговое вещество, и заселяют тимусзависимые зоны лимфатических узлов и селезенки. Здесь в периферических органах иммуногенеза происходит их дальнейшее созревание в Т-киллеры (цитотоксические), Т-хелперы, после чего они способны к рециркуляции, клонированию (пролиферации), образованию клеток-памяти.
Другие Т-лимфобласты превращаются в аутоиммунокомпетентные клетки, реактивные к аутоантигенам. Они подвергаются разрушению путем апоптоза (примерно 95% клеток) и фагоцитируются макрофагами.
Процесс специализации Т-лимфоцитов в корковом веществе долек тимуса происходит в условиях, предохраняющих от избыточного действия на них антигенов. Это достигается за счет образования гематотимического гистиона (барьера), состоящего из эндотелия гемокапилляров с отчетливо выраженной непрерывной базальной мембраной, перикапиллярного пространства с межклеточным веществом и макрофагами, а также из эпителиоретикулоцитов с их базальной мембраной. Корковое вещество тимуса имеет самостоятельное микроциркуляторное русло. Напротив, в мозговом веществе тимуса капиллярная сеть не выполняет барьерной роли, и через эндотелий этих капилляров зрелые лимфоциты могут уходить и возвращаться в тимус, т. е. рециркулировать.
В тимусе эти лимфоциты находятся в мозговом веществе. Зрелые лимфоциты покидают тимус через стенку посткапиллярной венулы.
Мозговое вещество тимуса имеет более светлую окраску, так как лимфоцитов здесь меньше, чем в корковом веществе. Эпителиальный остов выступает более отчетливо, а эпителиоретикулоциты здесь более крупные и многочисленные. В средней части мозгового вещества встречаются слоистые эпителиальные тельца Гассаля. С возрастом количество и размеры их увеличиваются. В строме тимуса кроме эпителиоретикулоцитов находятся макрофаги, дендритные клетки костномозгового происхождения, нейроэндокринные клетки — производные нервного гребня, а также миоидные клетки.
Возрастные изменения и реактивность тимуса.
После 20 лет происходит возрастная инволюция тимуса. Это сопровождается уменьшением количества лимфоцитов и развитием жировой ткани. В тех случаях, когда вилочковая железа не подвергается обратному развитию, возникает пониженная сопротивляемость организма к инфекциям и интоксикациям.
Ткани тимуса являются высокореактивными структурами. При действии повреждающих факторов (интоксикации, травмы и др.) наблюдаются выброс Т-лимфоцитов в кровь и массовая их гибель преимущественно в корковом веществе. Возникающая при таких стресс-воздействиях инволюция тимуса называется временной, быстропроходящей, или акцидентальной. Наблюдаемые при этом явления лимфоцитолиза и фагоцитоза макрофагами гибнущих лимфоцитов рассматриваются как возможные способы высвобождения факторов роста и ДНК, необходимых для восстановительных процессов в тканях. С гибелью лимфоцитов в этих условиях связывают также селекцию Т-лимфобластов.
Реактивные изменения вилочковой железы находятся в тесной корреляции с функциональными изменениями коры надпочечников и уровнем глюкокортикоидов в крови. В тимусе выявлены адренергические и холинергические нервные волокна, входящие в орган вместе с сосудами.
Тимус – что это? Роль тимуса на первому году жизни ребенка
Консультация педиатра и аллерголога-иммунолога
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе. Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами. Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую. Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием. Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем. Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
Чем образована паренхима тимуса
Текущий раздел: Лучевая диагностика
Опухоли вилочковой железы, этиология, эпидемиология, морфология, возможности лучевых методов исследования в диагностике.
Фархат Фeйсал Бен Мохамед, Кафедра лучевой диагностики и терапии с курсом лучевой диагностики факультета усовершенствования врачей
ГОУ ВПО «Российский государственный медицинский университет» Росздрава
Адрес документа для ссылки: h ttp://vestnik.rncrr.ru/vestnik/v7/papers/farh_v7. htm
Подробно, с исторической справкой и анализом разработанности данной темы, освещены вопросы диагностики. Приведены литературные данные по преимуществам метода компьютерной томографии в диагностике и дифференциальной диагностике новообразований переднего средостения, в том числе опухолей и кист вилочковой железы.
Tumors of the thymus, their etiology, epidemiology, morphology, capacity of radiological methods of diagnostics
Farhat Feisal Ben Mohamed
Chair of Radiological Diagnostics and Radiation Therapy of the Postgraduate Medical Education Faculty of the Russian State Medical University of the Russian
The problems of the diagnostics of the thymus tumors are discussed in detail, the unclear areas in that field are described. The survey contains the
published data on superiority of computed tomography in the diagnostics and differential diagnostics of the anterior mediastinum masses, including thymus
Вилочковая железа или тимус – дольчатый орган расположенный в передне-верхнем средостении. Орган обычно состоит из двух долей, реже встречаются варианты строения с одной, тремя или более долями, что по мнению ряда авторов является следствием нарушения его развития [Максименков А.Н, 1955; Аллаев М., 1990; Кульпина Е.В., 1999].
Вилочковая железа развивается из третьего и в меньшей степени – из четвертого глоточных карманов, затем опускается до уровня верхнего средостения. Как результат данного изменения положения ткань вилочковой железы может сохраняться в области шеи, жировой ткани средостения в виде узелковых островков в любой точке вдоль того маршрута, который она проделывает по мере опускания [Fukai I. et al., 1991].
В тимусе различают шейный и грудной отделы. Шейный отдел хорошо выражен у детей и достигает нижнего края языка. У половины взрослых он отсутствует [Sarrazin R. et al., 1987]. В грудном отделе правая и левая доли, соединенные рыхлой соединительной тканью, тесно примыкают или накладываются друг на друга.
По данным разных авторов тимус в онтогенезе перетерпливает сложные морфологические изменения, так в детстве железа состоит преимущественно из паренхимы. В коре каждой дольки содержатся многочисленные лимфоциты, жировая и соединительная ткань встречается лишь изредка. В мозговом слое содержится эпителиальная сеть. Тельца Гасоаля, которые являются производными эпителиальных клеток, включаются в состав решетки из эпителиальных структур мозгового слоя. Также присутствуют клетки плазматического вида, гистиоциты, эозинофилы и энтерохромафинные клетки. В период полового созревания, в возрасте от 11 до 15 лет, железа продолжает увеличиваться в объеме за счет развития широких междольковых перегородок. Заметной регрессии паренхимы в дольках не наблюдается. В возрасте от 15 до 20 лет происходит нарастающая инфильтрация железы жировой тканью, которая вначале появляется в междольковой соединительной ткани и быстро распространяется в сами дольки. Жировая инфильтрация сопровождается уменьшением популяции лимфоцитов в корковой части железы. В период от 21 до 40 лет железа имеет типичный «взрослый» тип строения, в паренхиме и в строме преобладает жировая ткань. В этот период дольки уменьшаются до узких тяжей и полос, количество которых с возрастом прогрессивно снижается [Аллаев М., 1990].
У людей старше 40 лет происходят дальнейшие инволюционные изменения, железа представлена жировой тканью и тонкими, беспорядочно разбросанными тяжами паренхимы [von Gaudecker B., 1991].
Тимус, с точки зрения функции является «общим звеном» или «перекрестком» иммунной и эндокринной систем [Шарова Н.И.с соавт., 1995].
В периоде внутриутробного развития тимус влияет на формирование иммунной и нейро-эндокринной систем, а на протяжении всей жизни, прямо или косвенно участвует в физиологических и патологических процессах, связанных с этими системами [Зайратъянц О.В. с соавт., 1991].
Паренхима вилочковой железы состоит из восьми типов эпителиальных клеток, возможно представляющих три различные гистогенетические линии. К ним относятся веретенообразные отростчатые клетки, составляющие паренхиматозную основу кортикальной зоны; округлые и полигональные клетки плоскоэпителиального типа, локализующиеся исключительно в медуллярной зоне, эпителиальные клетки с признаками железистой дифференцировки, также локализующиеся исключительно в медуллярной зоне [Харченко В.П., с соавт., 1998; Галил-Оглы Г.А. с соавт., 1988].
Кроме перечисленных клеточных форм, в тимусе встречаются тучные клетки, миоидные и эпителиальные клетки других органов [Харченко В.П., с соавт., 1998; Галил-Оглы Г.А. и соавт., 1988].
В 70-х годах термин «тимома» ограничили новым определением как «новообразований, возникающих из эпителиальных клеток тимуса без цитологической атипии» [Levine G.D., Rosai J., 1978]. Авторы данных рекомендаций с особой тщательностью разъяснили ряд неправильных понятий, возникающих в литературе из-за гетерогенности морфологических структур первичных новообразований тимуса. Существует огромное многообразие классификаций опухолей развивающихся из клеток вилочковой железы основанных на различных принципах и отражающих развитие представлений о патогенезе этих новообразований и сложность верификации природы опухоли [Харченко В.П., с соавт., 1998; Галил-Оглы Г.А. и соавт., 1988].
В связи с отсутствием общепринятых определений и классификации опухолей вилочковой железы, данные литературы по частоте их варьируют по данным разных авторов, от 5 до 33% новообразований средостения [Ветшев П.С. с соавт., 2002; Харченко В.П. с соавт., 1998; Зайратьянц О.В. с соавт., 1996; Couture M.M., Mountain C.F., 1990; Bassi N. et al. 1991].
Тимомы являются органоспецифическими опухолями тимуса, гистогенез которых связан с эпителиальными клетками паренхимы, без цитологической атипии [Харченко В.П., с соавт., 1998; Галил-Оглы Г.А. с соавт., 1980; Macchiarini P., Ostertag H., 2004]. Эпителиальные клетки опухоли сохраняют способность привлекать костно-мозговых предшественников Т-лимфоцитов и индуцировать их созревание, вследствие чего тимомы содержат большее или меньшее число Т-лимфоцитов, находящихся на разных стадиях дифференцировки. Гетерогенность тимом связана не только с различным содержанием в опухоли Т-лимфоцитов и их предшественников, но и с выраженной вариабельностью морфологии самих эпителиальных клеток. В отличие от многих классификаций тимом, учитывающих степень лимфоидной инфильтрации опухоли или гистологические и ультраструктурные особенности эпителиальных клеток [Macchiarini P., Ostertag H., 2004; Baba M. et al., 2001], в основу современной гисто-генетической классификации легло положение о существовании двух основных субпопуляций эпителиальных клеток: кортикальной и медуллярной [Chen G. et al., 2002; Bergh N. et al., 1978]. Они различаются по своему происхождению в эмбриогенезе, а также по ультраструктурным, гистохимическим и иммуногистохимическим признакам. Исходя из гистогенеза эпителиальных клеток опухоли, выделяют кортикальноклеточные, медуллярноклеточные и смешанноклеточные тимомы [Харченко В.П., с соавт., 1998; Галил-Оглы Г.А. и соавт., 1988; Chen G. et al., 2002; Baba M. et al., 2001]. Медуллярноклеточные тимомы в большинстве своем являются доброкачественными и могут быть причиной иммунных дефицитов с гипогамма-глобулинемией, гипопластической анемией. Кортикальноклеточные тимомы отличаются агрессивным течением, сопровождаются развитием аутоиммунных заболеваний, прежде всего миастении.
Преимущество новой классификации состоит в том, что выделенные варианты строения тимом сильно коррелируют с прогнозом заболевания, что помогает выбрать правильную тактику лечения. Так, например B2 и B3 опухоли отличаются агрессивным течением, инвазивностью и высокой вероятностью рецидивов при сравнении с опухолями типов A, AB и B1. Последние отличаются доброкачественным течением, протекают бессимптомно и сочетаются с иммунным дефицитом. Кроме этого тимомам типов A, AB и B1 свойственна полная резектабельность, в отличие от типов B2 и B3 [Sonobe S. et al., 2005;Chen G. et al., 2002].
Отдельные кортикальноклеточные тимомы у больных миастенией отличаются преобладанием эпителиальных клеток, цитологические особенности которых соответствуют таковым клеток-«нянек» тимуса. Продукция «клетками-няньками» опухоли тимических гормонов в сочетании с утратой ими антигенов может быть причиной формирования клона аутоагрессивных Т-лимфоцитов, которые как полагают, играют важную роль в патогенезе миастении и других аутоиммунных заболеваний у больных с тимомами [Зайратьянц О.Б. с соавт., 1991].
Своеобразным вариантом тимомы является веретеноклеточная опухоль, представленная вытянутыми веретенообразными клетками, идущими в виде пучков в разных направлениях [Macchiarini P., Ostertag H., 2004; Baba M. et al., 2001; Levine G.D., Rosai J., 1976].
Макроскопически тимомы – это плотные, коричнево-желтого или серого цвета, дольчатые структуры в большинстве случаев имеющие ровную фиброзную капсулу. По данным разных авторов преобладают опухоли размером от 5 до 10 см в диаметре [Ветшев П.С с соав., 2002; Зайратьянц О.В. с соавт., 1996]. Приблизительно две трети тимом инкапсулированы, остальные – локально инвазивные.
Для рентгенологов очень удобна классификация основанная на характере роста и критериях ивазивности. Данная классификация широко используется в определении злокачественности и в прогнозировании результатов лечения. Данная классификация предложена N.Bergh et al. (1978) и модифицирована A. Masaoka et al. (1981):
Стадия 1. Макроскопически опухоль полностью инкапсулирована и микроскопически нет инвазии капсулы.
Стадия 2. Макроскопически инвазия в окружающую жировую ткань или медиастинальную плевру или микроскопическая инвазия капсулы.
Стадия 3. Макроскопическая инвазия в соседние (перикард, крупные сосуды или легкие).
Стадия 4. Плевральная или перикардиальная диссеминация, лимфогенные или гематогенные метастазы.
Тимомы редко метастазируют, имеющиеся в литературе данные о метастазах в плевру, сердце, легкие, надключичные лимфоузлы, печень, кости, головной мозг относятся к так называемым «злокачественным» тимомам [Evans T.L., Lynch T.J., 2005; Gamondes J.P. et al., 1991].
Эпидемиологические особенности данной патологии приведены в литературе, так многие авторы отмечают, что средний возраст больных приблизительно 50 лет [Харченко В.П. с соавт., 1998; Агеев А.Г. с соавт., 1996; Castro C.Y, Chhieng D.C., 2005; Bassi N. et al., 1991; Couture M.M., Mountain C.F., 1990; Masaoka A. et al.,1981]. Мужчины и женщины поражаются этой опухолью в равной мере [Харченко В.П. с соавт., 1998]. Дети поражаются крайне редко [Агафонов Б.В., 1995; Kaplinsky C. et al., 1992].
Возникновение миастении является результатом поражения вилочковой железы и связанных с этим аутоиммунных расстройств [Зайратьянц О.В. с соавт., 1990; Ветшев П.С. с соавт., 1991], Клинические и физиологические проявления миастении обусловлены уменьшением количества ацетилхолиновых рецепторов в нервно-мышечных синапсах вследствие аутоиммунной атаки, что приводит к их недостаточности. Изменения тимуса по данным различных авторов отмечают у 80.0-100.0% больных миастенией [Зайратьянц О.В. с соавт., 1990; Cohen I.I. et al., 1988], в то время как только у 7.9-15.0% больных миастенией встречается опухоль вилочковой железы [Захарычев В.Д. с соавт., 1974; Чилингариди К.Е., с соавт., 1993; Густов А.В. с соавт., 2000]. Частота развития миастении у больных с тимомой колеблется от 7 до 59.0% [Зайратьянц О.В., 1992].
До 10% больных с тимомой старше 40 лет страдают гипогамма-глобулинемией с поражением и гуморального и клеточного иммунитета. У трети этих больных встречается гипоплазия красных клеток крови [Kaplinsky C. et al., 1992].
Данные литературы свидетельствуют о том, что тимомы могут встречаться в различных отделах средостения с частотой: переднее средостение – 75.0%, переднее верхнее средостение – 15.0%, верхнее средостение – 6.0%, шея, среднее и заднее средостение – 5.0% [Castro C.Y, Chhieng D.C., 2005; Bassi N.et al.,1991; Brown L.R., Aughenbaugh G.L., 1991].
Дистопированные или эктопированные тимомы встречаются редко [al-Salem A.H., 1992]. В 2,2% нaблюдений Nomori H. et al (1990) описал множественный вариант развития опухолей тимуса, в описанных случаях опухоли имели разное гистологическое строение.
Основным методом лечения больных с тимомами является хирургический.
Рассматривая вопрос о месте лучевой терапии в лечении опухолей вилочковой железы, необходимо отметить, что хотя опухоли вилочковой железы и поддаются лучевому воздействию, они имеют склонность рецидивировать. Метод лучевой терапии следует считать вспомогательным и сочетать его с хирургическим. Неинвазивные тимомы не требуют применения лучевой терапии [Eng T.Y., Thomas C.R. Jr., 2005].
Опухоли, которые не подвергаются удалению и, которые резистентны к лучевой терапии, могут реагировать на кортикостероиды с реальными ремиссиями. Если нет реакции на стероиды, возможна химиотерапия адриамицином либо циспластином, а также комбинации циклофосфана, винкристина, прокарбозина и иреднизолона [Kobayashi Y. et al., 2006; Evans T.L., Lynch T.J., 2005].
Наличие миастении, по мнению многих авторов является признаком неблагоприятного прогноза [Густов А.В с соавт., 2000; Вишневский А.А., Адамян А.А., 1977; Huang C.S. et al., 2005].
Цитологический и гистологический тип опухоли также влияет на прогноз. Наиболее неблагоприятный прогноз имеют кортикально-клеточные с минимальным количеством лимфоцитов тимомы (преобладание эпителиального компонента в гистологической структуре опухоли) [Gamondes J.P. et al., 1991].
В то время, как тимомы редко дают метастазы, карциномы метастазируют в 50.0-65.0% случаев [Cohen I.I. et al., 1988; Brightman I. et al., 1992]. Около половины больных даже с инвазивными тимомами живут более десяти лет, тогда как средняя выживаемость при карциноме тимуса 18 месяцев [Bassi N. et al., 1991; Gamondes J.P. et al., 1991; Couture M.M., Mountain C.F., 1990].
Много дискуссий вызывает определение места в классификации опухоли, которую одни авторы называют гранулематозной тимомой [Вишневский А.А., Адамян А.А., 1977; Стружко И.Б. с соавт., 1987], другие – лимфогрануломатозом вилочковой железы [Соколов A.Л., 1988; Алипченко А.А., 1980; Wernecke K. et al., 1991; Heron C.W., et al., 1988]. Клиническая картина данного заболевания сходна с таковой при лимфогрануломатозе любой другой локализации. Опухоль часто прорастает в легкие, перикард, типично метастазирование в надключичные лимфатические узлы. Неходжкинские лимфомы тимуса встречаются реже [Macchiarini P., Ostertag H., 2004].
Среди мезенхимальных опухолей наиболее распространена тимолипома, она составляет около 10.0% всех опухолей вилочковой железы [Macchiarini P., Ostertag H., 2004; Le Marc’hadour F. et al., 1991]. Опухоль имеет мягкую консистенцию и представляет собой гистологически зрелую жировую ткань с разбросанными по ней различной величины островками типичной вилочковой железы. Протекает бессимптомно и может достигать громадных размеров [Chew F.S., Weissleder R., 1991]. Крайне редко может сочетаться с миастенией [Chew F.S., Weissleder R., 1991; Le Marc’hadour F. et a1., 1991]. Удаление опухоли заканчивается выздоровлением, рецидивов не наблюдается. Другие опухоли вилочковой железы мезенхимального происхождения, такие как фиброма, фибросаркома, миосаркома, рабдомиома представлены единичными сообщениями и являются казуистикой [Le Marc’hadour F., et a1., 1991; Wissenbach R. et al., 1990].
Карциноиды тимуса в одной трети случаев встречаются в сочетании с различными паранеопластическими эндокринопатиями и, в частности, с синдромом Иценко-Кушинга [Ferolla P. et al, 2005; Doppman J.L. et al., 1992;].
Эти опухоли рассматриваются рядом специалистов как потенциально злокачественные, склонные к инвазивному росту и рецидиву. Овсяноклеточная опухоль возникает при злокачественной трансформации карциноида. Это очень редкое поражение вилочковой железы с несколькими случаями, описанными в литературе [Wick M.R., Rosai J., 1991]. Нейроэндокринные опухоли тимуса нередко прорастают капсулу и дают метастазы, причем сравнительно часто (20.0-30.0%) в кожу и кости. Они плохо поддаются лучевой терапии, и поэтому хирургическое лечение является методом выбора [Хмельницкий О.К. и соавт., 1984].
Герминогенные опухоли переднего средостения (тератомы) связаны или локализованы в самой вилочковой железе [Mori K. et al., 1987]. Макроскопически зрелые тератомы имеют вид кистозных образований, выполненных мутноватой жидкостью или желеобразной массой. Зрелые тератомы растут медленно, рецидивов после радикального удаления не дают [Васильев Б.Н. с соавт., 1990; Lemarie E. et al., 1992]. Незрелые формы, такие как тератобластома, дисгерминома, хорионэпителиома, эмбриональная карцинома в большинстве случаев характеризуются инвазивным ростом. Гемангиомы и лимфангиомы тимуса составляют не более 6.0% всех опухолей переднего средостения, лечатся хирургически с благоприятным прогнозом [Бирюков Ю.В. и соавт., 1991].
Достаточно часто в переднем средостении выявляются кисты, среди всех новообразований средостения они составляют 1.0 % [Kornreich L. et al., 1992]. Кистозное поражение вилочковой железы имеет разную этиологию. С.А.Гаджиев и соавт. (1971) указывают, что врожденные кисты скорее всего вызваны ретенцией тимо-фаренгиального протока, в просвете которого скапливается жидкость или кровь. Часть кист образуется в результате пролиферации ретикулярной стромы железы с образованием патологических телец Гасоаля и последующим дистрофическим изменением этих телец. Эти кисты могут встречаться как у взрослых, так и у новорожденных [Ветшев П.С. с соавт., 2002; Kornreich L. et al., 1992]. Редко, в основном при врожденном сифилисе или при туберкулезе, развиваются кисты воспалительного происхождения [Вишневский А.А., Адамян А.А., 1977].
Кистозные трансформации тимуса возможны при лучевой терапии лимфом переднего средостения [Veeze-Kuijpers B.et al., 1987]. Кистозные поражения тимуса можно разделить на неосложненные кисты и осложненные [Jaramiilo D. et al., 1989]. Первые имеют тонкую стенку, выстланную чешуйчатым или кубическим эпителием, содержат прозрачную жидкость. Осложненные кисты имеют толстую фиброзную стенку с гранулемными наслоениями и наполнены мутной жидкостью или студенистым содержимым. Они могут иметь как однокамерное, так и многокамерное строение [Goldman R.L, 1992]. Кисты крупного размера имеют клиническую симптоматику, связанную со сдавлением структур грудной клетки [Вишневский А.А. с соавт., 1978; Fraile G. et al., 1992; Hamon D. et al., 1992]. Несмотря на доброкачественное течение, имеются сообщения о малигнизации истинных кист вилочковой железы, что нужно отличать от кистозной дегенерации опухоли.
Терапия тимом, лимфом и герминогенных опухолей значительно различается [Pazdur R. et.al, 2002], поэтому для определения тактики ведения необходимо установление точного гистологического диагноза. А продемонстрированное многообразие морфологических типов новообразований средостения объясняет трудности дифференциальной диагностики.
До широкого использования компьютерной томографии и ультразвуковой диагностики в клиническую практику количество ошибок при диагностике опухолей вилочковой железы достигало 40%, несмотря на то что и сегодня рентгенография является основным методом выявления опухолей средостения [Ипполитов И.Х. с соавт.,1993; Priola A.M. et al., 2006]. Исторически для выявления и уточненной диагностики опухолей переднего средостения использовали боковые и косые проекции и такие методические приемы, как рентгенография в положении больного с поднятыми и отведенными назад руками [Зайратьянц О.В., 1996; Hollman A.S., Adams F.G., 1989], использование высоковольтной рентгенографии [Brown K. et al., 1990]. Рентгеноскопия органов грудной клетки позволяла оценить состояние легких, подвижность диафрагмы (что особенно важно при миастении), форму средостения и изменение ее при дыхании, а также состояние загрудинного пространства. Однако и при использовании указанных методик ряд новообразований может не дифференцироваться на фоне интенсивной срединной тени, а небольшие опухоли в боковых и косых проекциях могут четко не определяться. В этих случаях для визуализации всех элементов срединной тени применялись пневмомедиастинография и пневмомедиастинотомография [Кузнецов И.Д., Розенштраух Л.С.; 1970].
Радионуклеидные исследования широко использовались в диагностике новообразований переднего средостения до появления компьютерной томографии и ультразвукового исследования. Радионуклеидное исследование дает возможность увидеть накопление изотопного препарата в вилочковой железе, ее добавочных долях, выявить степень гиперплазии [Ипполитов И.Х. с соавт.,1993; Лобзин B.C. с соавт., 1988]. Опухоли вилочковой железы так же способны накапливать радиофармацевтические препараты [Min K.W. et al., 1978]. Включение туморотропных радиофармпрепаратов в метаболизм опухолевых клеток, их избирательное накопление в очагах пролиферации послужили основанием для применения данного метода в диагностике опухолей тимуса у больных миастенией [Соколов А.Л., 1988]. Однако наличие множественных очагов повышенного накопления радиофармпрепаратов в переднем средостении при гиперплазии вилочковой железы затрудняет выявление опухоли на этом фоне. Описаны ложноотрицательные результаты при очагах некроза в опухолях, при диагностике опухолей до 2 см в диаметре [Tumeh S.S., Kaplan W.D, 1990]. Однако выполнение радиоизотопного исследования на дает информации об степени инвазии опухоли и поражении окружающих органов и тканей. Метод имеет ограниченное применение вследствие низкой специфичности. По данным разных авторов количество ложно-положительных результатов колеблется от 30 до 40% из-за способности радиофармпрепаратов к фиксации в очагах хронического и острого воспаления, гнойных полостях, лимфатических узлах [Ипполитов И.Х. с соавт., 1993; Ветшев П.С. с соавт., 1991; Moore N.R., 1989].
Внедрение в практику ультразвуковой диагностики повысило информативность исследований при заболеваниях средостения особенно после разработки методики эндоскопического исследования [Ипполитов И.Х. с соавт., 1993; Shaham D. et al., 2004; Durand C. et al., 1997; Wernecke K. et al., 1990; 1988].
При использовании парастернального доступа, структуры переднего средостения можно визуализировать в 97.0% случаев [Wernecke K. et al., 1990]. При положении пациента на правом или левом боку, на выдохе переднее средостение вплотную подходит к передней грудной стенке и создается парастернальное акустическое окно, через которое и проводят исследование [Wernecke K. et al., 1988]. Тимус визуализируется преимущественно до подросткового возраста. У детей по данным многих авторов вилочковая железа имеет треугольную форму или форму «слезы» на продольных срезах и трапециевидный или двудольный вид на поперечных срезах. Обычно тимус виден кпереди от крупных сосудов и спускающимся к сердцу. У некоторых детей можно выявить верхние полюса тимуса в нижних отделах шеи [Han B.K et al., 2001; Tamasi S., 2000; Carty H., 1990].
Самые последние достижения развития оборудования для эндоскопического ультразвукового исследования делают сонографию методом не уступающим возможностям компьютерной томографии, позволяя проводить уточненную диагностику новообразований средостения и выполнять сложные трансбронхиальные пункции [Kanoh K. et al., 2005; Panelli F. et al., 2001].
Компьютерная томография (КТ) расширяет возможности рентгенологического метода в диагностике новообразований средостения, дает возможность обнаруживать невидимые на передних и боковых рентгенограммах патологические процессы в средостении, а при выявлении объемного образования позволяет уточнить его характер и распространенность [Харченко В.П. с соавт., 2005; Харченко В.П., Котляров П.М., Глаголев Н.А., 2002; Ипполитов И.Х. с соавт., 1993; Duwe B.V.et al., 2005; Strollo D.C. et al.,1997; Brown L.R., Aughenbaugh G.L., 1991].
Тимус виден наилучшим образом в переднем средостении на уровне между горизонтальным отрезком левой плечеголовной вены сверху и горизонтальным участком правой легочной артерии снизу [Priola S.M. et al., 2006]. Срезы, на которых железа имеет максимальный размер сечения, расположены в интервале 3-5 см между дугой аорты и стволом легочной артерии. Вилочковая железа располагается вдоль оси человеческого тела, и поэтому в каждый отдельный компьютерный срез попадает только малая ее часть. Она имеет форму треугольника или выглядит как две овальные доли в толще загрудинной жировой ткани. Изображение меняется в зависимости от высоты среза [Priola S.M. et al., 2006; Kacker A. et al., 1999].
Размеры железы и ее плотностные характеристики варьируют в зависимости от возраста. E. Нeiberg et al. (1982) обнаружили, что ширина доли является наиболее надежной мерой размера железы. Возрастные особенности необходимо учитывать при анализе компьютерных томограмм.
Неинвазивная опухоль вилочковой железы обычно выглядит как круглое или овальное образование в переднем средостении, исходящее из одной ее доли. Если она небольшая (1-2 см в диаметре), то определяется как правильное дугообразное выпячивание на поверхности тимуса [Low R.N. et al., 1996].
Некоторые исследователи высказывают мнение о том, что признаком неинвазивности опухоли на КТ является выявляемая тонкая жировая прослойка между опухолью и смежными структурами. Инвазивная опухоль представляется на КТ как неровное, неправильной формы образование без четких контуров [Nicolaou S. et al., 1996; Tecce P.M., et al., 1994; Lee J.D. et al., 1991],
Тератомы тимуса могут иметь также кистозный компонент, но стенка этой кисты обычно более толстая и часто содержит известковые включения [Brown L.R., Aughenbaugh G.L., 1991; Blomlie V.,et al., 1988].
Кисты тимуса, выявляемые после лучевой терапии у больных с лимфогранулематозом, могут выглядеть на КТ-срезах, как обычная тонкостенная киста, иметь сложное многокамерное строение или могут обызвествляться [Priola A.M.et al., 2006; Wernecke K. et al., 1991].
Лимфомы тимуса обычно диагностируют гистологически, так как при КТ-исследовании они не проявляют каких-либо специфических черт: могут представляться как гомогенные образования с четкими контурами, симулируя тимому или представлять образование с мультицентричным ростом, инвазирующее смежные структуры. Поражение внутригрудных лимфатических узлов типично для лимфогранулематоза [Heron C.W. et al., 1988].
Тератоидные образования тимуса при КТ-исследовании разделяют на 2 вида: 1) кистозные образования низкой плотности с толстой стенкой без признаков инвазивного роста, 2) негомогенные инвазивные образования, часто с кальцификацией, имеющей рассеянную шаровидную форму [Lee K.S. et al., 1989]. Второй вид диффузно поражает переднее средостение и происхождение опухоли из тимуса трудно доказать даже на компьютерных томограммах [Dehner L.P, 1990].
Для более четкого отграничения новообразований вилочковой железы от окружающих структур средостения, выявления аневризм и дифференцирования легочных опухолей от медиастинальных применяется методика контрастного усиления изображения путем внутривенного введения йодсодержащих препаратов [Вишневский А.А. с соавт., 1986; Мотус И.Я. с соавт., 1995].
Получение изображения грудной полости в трех измерениях при компьютерной томографии позволяет улучшить визуализацию взаимоотношения опухолей средостения со смежными структурами [Stern R.L. et al., 1989].
Применение методики тонкоигольной пункционной биопсии под контролем КТ вызвано необходимостью морфологической верификации при бессимптомных опухолях переднего средостения или при неоперабельных поражениях значительных размеров перед направлением пациента на лучевую или химиотерапию. Четкая визуализация патологического образования и окружающих его структур при КТ создает условия для безопасной прицельной пункции [Мотус И.Я. с соавт., 1995; Herman S.J. et al., 1991].
КТ широко применяется как для планирования лучевой терапии при опухолях средостения, так и для измерения объема опухоли в оценке реакции на медикаментозную или лучевую терапию[Giaccone G.et al., 2006; Kudva G.C. et al., 2002]
Таким образом, вышеизложенное позволяет заключить, что простота и безопасность компьютерной томографии, ценность получаемой информации, возможность сокращения длительности и облегчения обследования больных за счет отказа от ряда других сложных инвазивных диагностических методов определяют преимущества КТ перед другими методами диагностики поражений вилочковой железы.
Магнитно-резонансная томография (МРТ) с целью исследования структур грудной клетки используется с конца 80-ых [Беленков Ю.Н. с соавт., 1990; Kono M. et al., 1992; Brown L.R., Aughenbaugh G.L., 1991; Swensen S.J. et al.,1989].
Сосудистые структуры средостения хорошо визуализируются на МР-томограммах ввиду того, что сигнал от внутрисосудистых пространств практически отсутствует. Тимус внутри преваскулярного пространства по данным ряда авторов более легко выявляется на МР-томограммах, чем на компьютерных томограммах [Murray J.G., Breatnach E., 1992].
В ряде исследований показано, что форма, размер и интенсивность сигнала нормального тимуса зависит от возраста. У детей тимус имеет промежуточную интенсивность сигнала равную интенсивности сигнала мышц или лимфоузлов [Siegel M.J. et al., 1989; Boothroyd A.E. et al., 1992; Brown L.R., Aughenbaugh G.L., 1991]. У взрослых интенсивность тимуса выше из-за жировой инволюции, хотя она у разных людей варьирует. Сигнал от него более интенсивный, чем от лимфоузлов или большинства опухолей и гомогенный [Murray J.G., Breatnach E., 1992].
МРТ-диагноз опухолей тимуса обычно базируется на локальном увеличении железы [Kushihashi T. et al., 1996; Sakai F. et al., 1992]. Интенсивность сигнала опухоли тимуса та же, что и неизменной ткани вилочковой железы, но часто сигнал характеризуется негомогенностью на Т2-изображениях [Barakos J.A.et al., 1989].
Кисты тимуса обладают низкой интенсивностью сигнала на T1-изображениях и высокой на T2. Спонтанное кровотечение в кисту приводит к повышению сигнала на T1 в связи с парамагнетическим эффектом метгемоглобина [Baracos J.A., 1989].
Тимолипомы на T1-изображениях выглядят как массы с высокой интенсивностью сигнала, что является отражением жировой природы опухоли. Линейные полосы низкой интенсивности сигнала представлены резидуальной фиброзной стромой и/или тканью вилочковой железы, проходящей через тимолипому [Matsudaira N. et al., 1994].
Однако МРТ имеет свои недостатки, ограничивающие применение метода в диагностике заболеваний средостения. Пульсация сердца смещает средостение во время получения изображения и снижает ценность МРТ. Движение во время МР-исследования уменьшает пространственное разрешение (вызывает размазывание), уменьшает интенсивность сигнала и вызывает дискретные артефакты [Westcott J.L. et al., 1985]. Для уменьшения артефактов от движения сердца и пациента необходимо синхронизирование с сердечным циклом. Так, Delplace P.O. et al. (1991) при тщательном исследовании МР-томограмм опухоли средостения с применением синхронизации сердца, показали отсутствие инвазии в хорошо визуализирующийся перикард. Больные с неправильным сердечным ритмом не подходят для МРТ-исследования с синхронизацией сердца. Диагностическая ценность исследования у них обычно низка.
Возможности получения МР-томограмм во фронтальной и сагиттальной плоскостях позволяют полнее оценивать характер опухолей средостения и возможность оперативного лечения их [Batra P. et al., 1988].
Последние исследования в области МРТ привели к разработке новых быстрых последовательностей FLASH, GRASS и FISP, при использовании которых получают МР-томограммы средостения хорошего качества в максимально короткое время. Данные инновации уменьшают количество артефактов связанных с движением (дыхание, сердцебиение, пульсация магистральных сосудов) [Thompson B.H., Stanford W., 2000].
Для повышения эффективности диагностики с помощью МРТ применяется целый класс контрастных препаратов, которые усиливают изображение. Так называемые парамагнетические вещества, не влияя на сигналы, меняют время релаксации протонов и тем самым усиливают интенсивность изображения структур, в которых они накапливаются. Магнитно-резонансная томография метод быстро развивающийся, открывающий перспективы не только точной нозологической диагностики, но и оценки измененной функции органов с использованием МР-спектроскопии, однако все это пока достояние научных лабораторий [Nakatsu M., et al., 2000; Low R.N. et al., 1996].
Однако без визуального контроля провести пункцию опухоли сложно, а в ряде случаев практически невозможно. Для этой цели в настоящее время применяют рентгеноскопию, ультразвуковой метод и компьютерную томографию, последняя по признанию многих авторов является методом выбора [Шехтер Ю.И., Юдин А.Л., 1990; Carlson S.K. et.al., 2001].
В настоящее время в практике широко применяется аспирационная тонкоигольная биопсия и тканевая режущая биопсия, проводимая иглами большего диаметра [de Farias AP. et al., 2003]. Учитывая особенность морфологии опухолей переднего средостения, сложность дифференциальной диагностики из-за близости клеточного состава для точной верификации тимо- и лимфогенных опухолей необходим анализ достаточно большого среза опухоли и проведение иммуногистохимического анализа [Bressler E.L., Kirkham J.A., 1994]. К сожалению количество материала получаемого при тонкоигольной аспирационной биопсии недостаточно для столь сложных заключений.
Обилие применяемых диагностических методов, порой противоречивость мнений авторов об их эффективности, отсутствие рациональной диагностической тактики, последовательности применения и оптимального сочетания диагностических исследований, а также необходимость изучения новых методов диагностики побудили нас провести настоящее исследование.
Зайратьянц О.В. Патология вилочковой железы и аутоиммунные болезни. Дис… докт. мед.наук : М.- 1992. С.5-15.
Котляров П.М., Глаголев Н.А. Компьютерно-томографическое изображение органов и тканей грудной полости: Пособие для врачей. – М.:МЗ РФ, 2002.
Нуднов Н.В., Кармазановский Г.Г. Интервенционные методы диагностики и лечения заболеваний внутренних органов: Москва:Русский врач. – 2001 – С.6-27.
Тараканов С.Н. Комплексная диагностика тимогенных новообразований и злокачественных лимфом. Дис… канд. мед. наук. СПб,1991. С.200-223.
Харченко В.П., Глаголев Н.А. Рентгеновская компьютерная томография в диагностике заболеваний легких и средостения/М.Медика: 2005. – С.95-114.
Харченко В.П., Саркисов Д.С., Ветшев П.С., Галил-Оглы П.А., Зайратьянц О.В. Болезни вилочковой железы/ Триада-Х, Москва. 1998.- с.231.
Baba M., Nomoto Y., Iyoda A., Saito H., Hiroshima K., Shibuya K., Haga Y., Hoshino H., Iizasa T., Horiuchi F., Fujisawa T. Cytomorphologic features characteristic of tumor stages of thymomas. // Oncol. Rep. – 2001 – Vol.8.,N.5. – P.1139-1143.
Baron R.L., Lee J.K.T, Sagel S.S., Peterson R.R. Computed tomography of the normal thymus. Radiology 1982:142:121-125.
Castro C.Y., Chhieng D.C. Cytology and surgical pathology of the mediastinum.//Adv. Exp. Med. Biol. – 2005. – Vol.563. – P.42-54
Chen G., Marx A., Wen-Hu C., Yong J., Puppe B., Stroebel P., Mueller-Hermelink H.K. New WHO histologic classification predicts prognosis of thymic epithelial tumors: a clinicopathologic study of 200 thymoma cases from China.// Cancer. – 2002. – Vol.15;95,N.2. – P.420-429
Crowe J.K., Brown L.R., Muhm J.R. Computed tomography of the mediastinum.// Radiology. – 1978. –Vol.128. –P.75-87.
de Farias AP.,Deheinzelin D., Younes R.N. et al. Computed tomography-guided biopsy of mediastinal lesions: fine versus cutting needles.// Rev. Hosp. Clin. Fac. Med. Sao Paulo. – 2003. – Vol.58. – N.2. –P.69-74.
Dehner L.P.Germ cell tumors of the mediastinum.// Semin. Diagn. Pathol. – 1990. – Vol.7.,N.4.- P.266-284.
Durand C., Baudain P., Pin I., Nugues F., Bibollet C. Usefulness of ultrasonography (US) in the diagnosis of a mediastinal opacity.// Pediatr. Pulmonol. Suppl. – 1997.- N.16. P.56-57.
Duwe B.V., Sterman D.H., Musani A.I. Tumors of the mediastinum. //Chest. – 2005.- Vol.128.,N.4. – P.2893-2909.
Eng T.Y., Thomas C.R. Jr. Radiation therapy in the management of thymic tumors.//Semin. Thorac. Cardiovasc. Surg. – 2005. –Vol.17.,N.1. – P.32-40.
Evans T.L., Lynch T.J. Role of chemotherapy in the management of advanced thymic tumors.// Semin. Thorac. Cardiovasc. Surg. – 2005. –Vol.17.,N.1. – P.41-50.
Ferolla P., Falchetti A., Filosso P. Tomassetti P., Tamburrano G., Avenia N., Daddi G., Puma F., Ribacchi R., Santeusanio F., Angeletti G., Brandi M.L. Thymic neuroendocrine carcinoma (carcinoid) in multiple endocrine neoplasia type 1 syndrome: the Italian series.// J. Clin.Endocrinol. Metab. – 2005 – Vol.90.,N.5. – P.2603-2609.
Giaccone G., Wilmink H., Paul M.A., van der Valk P. Systemic treatment of malignant thymoma: a decade experience at a single institution.//Am. J. Clin. Oncol. – 2006. –Vol.29.,N.4. – P.336-344
Han B.K., Suh Y.L., Yoon H.K. Thymic ultrasound. I. Intrathymic anatomy in infants.// Pediatr. Radiol. – 2001. – Vol.31,N.7. – P.:474-479.
Huang C.S., Hsu H.S., Huang B.S., Lee H.C., Kao K.P., Hsu W.H., Huang M.H. Factors influencing the outcome of transsternal thymectomy for myasthenia gravis.//Acta Neurol, Scand. – 2005. – Vol.112.,N.2. – P.108-114.
Kacker A., April M., Markentel C.B., Breuer F. Ectopic thymus presenting as a solid submandibular neck mass in an infant: case report and review of literature.//Int. J. Pediatr. Otorhinolaryngol. – 1999. – Vol. 20.,N.49. P.241-245.
Kanoh K., Miyazawa T., Kurimoto N., Iwamoto Y., Miyazu Y., Kohno N. Endobronchial ultrasonography guidance for transbronchial needle aspiration using a double-channel bronchoscope.// Chest. – 2005. – Vol. 128.,N.1. – P.388-393.
Kobayashi Y., Fujii Y., Yano M., Sasaki H. Yukiue H., Haneda H., Suzuki E., Endo K., Kawano O. Preoperative steroid pulse therapy for invasive thymoma: clinical experience and mechanism of action.//Cancer. – 2006. – Vol.1;106.,N.9. – P.1901-1907.
Kudva G.C., Maliekel K., Kim H.J., Naunheim K.S., Stolar C., Fletcher J.W., Puri S. Thymoma and myotonic dystrophy: successful treatment with chemotherapy and radiation: case report and review of the literature.// Chest.- 2002. Vol.121.,N.6. – P.2061-2063.
Lee K.S., Im J.G., Han C.H., Han M.C., Kim C.W., Kim W.S. Malignant primary germ cell tumors of the mediastinum: CT features. // Am. J. Roentgenol. – 1989. – Vol.153.,N5. – P:947-951.
Lemaitre L., Leclerc F., Marconi V., Taboureau O., Avni F.E., Remy J. Ultrasonographic findings in thymic lymphoma in children.// Eur.J.Radiol. – 1987. – Vol.7.N.2. –P.125-129.
Levine G.D., Rosai J. Thymic hyperplasia and neoplasia: a review of current concepts.//Hum Pathol. – 1978. – Vol.9.,N.5. – P.495-515.
Low R.N., Sigeti J.S., Song S.Y., Shimakawa A., Pelc N.J. Dynamic contrast-enhanced breath-hold MR imaging of thoracic malignancy using cardiac compensation.//J.Magn.Reson.Imaging. – 1996. – Vol.6.,N.4. – P.625-631.
Macchiarini P., Ostertag H..Uncommon primary mediastinal tumours. //Lancet Oncol. – 2004. – Vol.5.N.2. – P.107-118.
Matsudaira N., Hirano H., Itou S., Matsuura K., Kanou M., Ogawa T. MR imaging of thymolipoma.//Magn. Reson. Imaging. – 1994. –Vol.12.,N.6. – P.959-961.
Mineo T.C., Ambrogi V., Mineo D., Baldi A. Long-term disease-free survival of patients with radically resected thymomas: relevance of cell-cycle protein expression.//Cancer. – 2005.- Vol.15;104.,N.10. – P.2063-2071.
Moore A.V., Korobkin M., Olanow W., Heaston D.K., Ram P.C., Dunnick N.R., Silverman P.M. Age-related changes in the thymus gland: CT-pathologic correlation.//AJR 1983:141:241-246.
Morvay Z., Szabo E., Tiszlavicz L., Furak J., Trojan I., Palko A. Thoracic core needle biopsy using ultrasound guidance// Ultrasound Q. – 2001. – Vol.17,N.2. – P.113-121.
Muller-Hermelink H.K., Marx A. Thymoma.// Curr. Opin. Oncol. – 2000. –Vol.12.,N.5. – P.426-433.
Nakatsu M., Hatabu H., Itoh H., Morikawa K., Miki Y., Kasagi K., Shimono T., Shoji K., Shimada Y., Imamura M., Konishi J. Comparison of short inversion time inversion recovery (STIR) and fat-saturated (chemsat) techniques for background fat intensity suppression in cervical and thoracic MR imaging. //J. Magn. Reson. Imaging. – 2000.- Vol.11.,N.1. – P.56-60.
Ottinger H., Belka C., Kozole G., Engelhard M., Meusers P., Paar D., Metz K.A., Leder L.D., Cyrus C., Gnoth S. Deep venous thrombosis and pulmonary artery embolism in high-grade non Hodgkin’s lymphoma: incidence, causes and prognostic relevance.//Eur. J. Haematol. – 1995. – Vol.54.,N.3. – P.186-194
Panelli F., Erickson R.A., Prasad V.M. Evaluation of mediastinal masses by endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration.// Am. J. Gastroenterol. – 2001.- Vol. 96.,N.2. – P.401-408.
Pazdur R., Coia L.R., Hoskins W.J. et.al Cancer management: a multidisciplinary approach. NY:PRR. – 2002. – P.1-37.
Percopo V., Lorenzo M., Di Prisco B., De Rosa N., Ammirati C.[Thymic carcinoid. Description of 2 cases and review of the international literature]//Minerva Chir. – 1988.- Vol.31;43.,N.13-14. – P.1209-1214. Review.
Priola A.M., Priola S.M., Cardinale L., Cataldi A., Fava C. The anterior mediastinum: diseases.// Radiol. Med. ( Torino ). – 2006. – Vol.111. N.3. –P.312-342.
Priola S.M., Priola A.M., Cardinale L., Perotto F., Fava C. The anterior mediastinum: anatomy and imaging procedures. Radiol. Med. ( Torino ). – 2006. – Vol.111.,N.3. – P.295-311.
Rostock R.A., Giangreco A., Wharam M.D., Lenhard R., Siegelman S.S., Order S.E.CT scan modification in the treatment of mediastinal Hodgkin’s disease.//Cancer.- 1982.- Vol.1;49.,N.11. – P.2267-2275.
Sakai F., Sone S., Kiyono K., Kawai T., Maruyama A., Ueda H., Aoki J., Honda T., Morimoto M., Ishii K. MR imaging of thymoma: radiologic-pathologic correlation.//Am. J. Roentgenol. – 1992.- Vol.158. – N.4.- P.751-756.
Sarrazin R., Le Bas J.F., Coulomb M.The mediastinum in sagittal sectioning. Anatomy and magnetic resonance imaging (MRI).//Surg. Radiol. Anat. – 1987. – Vol.9.,N2. – P.95-105.
Sonobe S., Miyamoto H., Izumi H., Nobukawa B., Futagawa T., Yamazaki A., Oh T., Uekusa T., Abe H., Suda K.Clinical usefulness of the WHO histological classification of thymoma.//Ann. Thorac. Cardiovasc. Surg. – 2005. – Vol.
Strollo D.C., Rosado de Christenson M.L., Jett J.R. Primary mediastinal tumors. Part 1: tumors of the anterior mediastinum.//Chest.- 1997. – Vol.112.,N.2. – P.511-522.
Thompson B.H., Stanford W. MR imaging of pulmonary and mediastinal malignancies.// Magn. Reson. Imaging. Clin. N. Am. – 2000. – Vol.8.,N.4. – P.729-739
Veeze-Kuijpers B., Van Andel J.G., Stiegelis W.F., Boldewijn J.K. Benign thymic cyst following mantle radiotherapy for Hodgkin’s disease. //Clin. Radiol. – 1987. – Vol.38.,N.3. – P.289-290.
Wang Y., Sun Y., Zhang J., Zhou N., Liu Y., Li X., Xu Y. Diagnosis, treatment and prognosis of thymoma: an analysis of 116 cases.//Chin. Med. J. – 2003.- Vol.116.,N.8. – P.1187-1190.
Wernecke K., Diederich S. Sonographic features of mediastinal tumors.//Am. J. Roentgenol. – 1994. – Vol.163.,N.6. – P.1357-1364.