Чем образован гематотимусный барьер
Чем образован гематотимусный барьер
Клиническое наблюдение за женщинами, течение беременности которых было осложнено внутриутробной гипоксией, и их новорожденными детьми, в том числе в семьях потребителей ПАВ, указывает на увеличение процента асфиксии, недоношенности, признаков внутриутробной гипотрофии. Общее количество лимфоцитов в парах мать-дитя в условиях гипоксии было достоверно снижено по сравнению с контрольной группой. Распределение иммунокомпетентных клеток, определенных методом проточной цитофлюориметрии, было нарушено. У женщин с осложненным течением беременности, количество CD25+ и особенно CD 16+, было резко увеличено. У детей данной группы отмечались уменьшения таких кластеров дифференцировки как CD4+ и CD8+. Подобные изменения в совокупности со скудными данными зарубежной и отечественной литературы (Karla V.R., et al., 1983; Trivedi K., et al., 1983; Стефани Д. В., с соавт., 1996) указывают на конфликт процессов позитивной и негативной селекции в тимусе в антенатальном периоде. При этом иммунокомпетентным клеткам матери при патологическим течении беременности отводится цитолитическая роль. По-видимому, при накоплении данного пула клеток выше критической массы вероятно прерывание беременности, а длительное персистирование приводит к повреждению органов иммунной системы плода, в частности, тимуса с формированием антенатальных форм иммунодефицитов.
Катамнестическое наблюдение детей (46 чел), рожденных от патологической беременности, в т.ч. по причинам наркогенеза, указывает на наличие высокой инфекционной нагрузки смешанного типа как основного маркера некомпетентности иммунной системы. Представляется важным получение электронно-морфологических доказательств антенатального повреждения тимуса.
Информационное моделирование в рамках работ по проекту РГНФ № 04-06-88005а/Т на основе данных лабораторных исследований позволяет по-новому подойти к наркологическим аспектам классификации иммунопатологических синдромов, обусловленных дефектами тимуса; прогнозированию характера иммунных нарушений с учетом ведущего повреждающего фактора; оценке тяжести структурно-функционального дефекта при интегральной оценке влияния социально-экономических факторов и загрязнения окружающей среды в регионе.
Работа представлена на заочную электронную конференцию «Приоритетные направления развития науки, технологий и техники», 15-20 марта 2004 г.
ЛИМФОИДНЫЕ ОРГАНЫ. ЛИМФОПОЭЗ. ТИМУС (ЗОБНАЯ, ИЛИ ВИЛОЧКОВАЯ, ЖЕЛЕЗА)



Развитие. Тимус: (thymus) начинает развиваться на 4-5-й неделе эмбриогенеза из выпячивания эпителия глотки на уровне III—IV жаберных карманов. Правое и левое выпячивания растут в каудальном направлении. Затем эти выпячивания сливаются, образуя общую эпителиальную (ретикуло-эпителиальную) строму. Вокруг этой стромы из окружающей мезенхимы формируется соединительнотканная капсула, от которой вглубь отходят трабекулы вместе с кровеносными сосудами. Трабекулы разделяют строму на дольки. По периферии дольки формируется корковое вещество, внутри — мозговое вещество. В мозговом веществе эпителиальные клетки стромы подвергаются ороговению и наслаиваются друг на друга, формируя тельца тимуса (тельца Гассаля). Кроветворение в тимусе начинается на 8,5-10-й неделе.
Строение. Тимус снаружи покрыт соединительнотканной капсулой, от которой отходят прослойки соединительной ткани, разделяющие тимус на дольки. В каждой дольке имеется корковое и мозговое вещество. Стромой долек тимуса является эпителиальная (ретикулоэпителиальная) ткань. Эпителиальные клетки стромы имеют отростки, при помощи которых соединяются друг с другом, образуя сеть (reticulum). Ретикулоэпителиальные клетки стромы лежат на базальной мембране, которая прилежит к капсуле и трабекулам. На базальной мембране лежат базальные клетки. По мере приближения стромальных клеток к центру дольки они подвергаются ороговению, наслаиваются друг на друга и образуют тельца тимуса.
Корковое вещество долек тимуса имеет темный цвет, так как в петлях эпителиальной стромы в большом количестве находятся лимфоциты. Из красного костного мозга с током крови в корковое вещество поступают предшественники Т-лимфоцитов. Под воздействием тимозина, выделяемого макрофагами и тимоцитами, предшественники Т-лимфоцитов подвергаются бласттрансформации, пролиферации и антигеннезависимой дифференцировке. Что такое бласттрансформация? Это преобразование предшественников Т-лимфоцитов в Т-лимфобласты. Пролиферация — это размножение Т-лимфобластов при помощи митоза. Антигеннезависимая дифференцировка — это дифференцировка при незначительном количестве антигенов.
Почему же в корковом веществе долек мало антигенов?
Дело в том, что здесь вокруг капилляров и синусоидой имеется гематотимусный барьер. В состав этого барьера входят 5 компонентов:
1) эндотелий капилляров;
2) их базальная мембрана;
3) перикапиллярное пространство, заполненное жидкостью, где находятся макрофаги и лимфоциты;
4) базальная мембрана эпителиальной стромы;
5) клетки эпителиальной стромы.
В случае, если нарушается гематотимусный барьер, то противоантигенная защита коркового вещества долек усиливается нейтрофильными лейкоцитами, выполняющими фагоцитарную функцию, плазмоцитами, которые содержат антитела, и тканевыми базофилами, регулирующими проницаемость капиллярной стенки. При выделении базофилами гепарина проницаемость стенки капилляров снижается, при выделении гистамина — повышается.
В результате антигеннезависимой дифференцировки Т-лимфоциты приобретают рецепторы к чужеродным антигенам и превращаются в Т-хелперы, Т-супрессоры и Т-киллеры. Некоторые Т-лимфоциты приобретают рецепторы к собственным антигенам (клеткам своего организма) — автоантигенам. Такие Т-лимфоциты здесь уничтожаются при помощи макрофагов. Если такие Т-лимфоциты проникнут в общий ток крови, то они начнут уничтожать клетки собственного организма.
После антигеннезависимой дифференцировки Т-лимфоциты поступают в кровоток и транспортируются в периферические лимфоидные органы кроветворения (селезенку, лимфатический узел), вселяются в антигензависимые зоны этих органов и подвергаются антигензависимой дифференцировке.
Мозговое вещество долек тимуса более светлое, так как в его строме содержится меньше Т-лимфоцитов. Эти Т-лимфоциты отличаются по качеству рецепторов от лимфоцитов коркового вещества. В мозговом веществе Т-лимфоциты образуют рециркуляторный пул. Что такое пул? Это скопление (большая группа) клеток. Что означает «рециркуляторный»? Это означает, что лимфоциты пула из мозгового вещества долек через посткапиллярные венулы поступают в общий ток крови, где циркулируют некоторое время, а затем опять возвращаются в мозговое вещество. Этот процесс называется рециркуляцией. Рециркуляция возможна потому, что в мозговом веществе долек вокруг капилляров и синусоидов нет гематотимусного барьера. В центре мозгового вещества долек видны тельца тимуса (corpusculum thymi), состоящие из наслоенных друг на друга ороговевших эпителиальных клеток стромы.
Кровоснабжение долек тимуса. Артерии, поступающие в тимус, делятся на междольковые (arteria interlobularis), от которых вглубь дольки отходят обычно 2 артериальные ветви (arteria intralobularis). Одна из этих ветвей проходит по корковому веществу вблизи границы с мозговым веществом и описывает дугу. От этой дуги в сторону капсулы или трабекул долек отходят капилляры, окруженные гематотимусным барьером. Эти капилляры впадают в подкапсульную вену, которая покидает дольку и вливается в междольковую вену. Вторая артериальная ветвь направляется в мозговое вещество дольки и делится на капилляры, которые не имеют гематотимусного барьера. Эти капилляры вливаются во внутридольковую мозговую вену, которая тоже впадает в междольковую вену. Таким образом, поступление и отток крови в корковое и мозговое вещество долек тимуса осуществляется по различным сосудам.
Возрастная инволюция тимуса. Тймус окончательно развивается к 3 годам жизни ребенка. С этого возраста и до 20 лет тимус находится в стабильном положении. Затем он подвергается обратному развитию, или возрастной инволюции. При этом разрастается соединительная ткань капсулы и трабекул и развивается жировая ткань. Одновременно с этим из коркового и мозгового вещества долек тимуса исчезают Т-лимфоциты. В результате тимус превращается в жировое тело (corpus adiposum). В таком случае предшественники Т-лимфоцитов подвергаются антигеннезависимой дифференцировке в многослойном плоском эпителии кожи. В случае, если не наступает возрастная инволюция тимуса, в организме возникает состояние, которое называется тимиколимфатическим статусом (status thymicolymphaticus). Такое состояние возникает в организме в том случае, если в коре надпочечников выделяется недостаточное количество глюкокортикоидов. При таком статусе организм оказывается крайне неустойчивым к инфекционным заболеваниям и злокачественным опухолям.
Временная инволюция тимуса. Наблюдается при травмах, заболеваниях, интоксикациях, стрессах и т. д., когда из коры надпочечников выделяется большое количество глюкокортикоидов, под влиянием которых происходит цитолиз лимфоцитов или поглощение их макрофагами, в результате чего корковое вещество долек тимуса становится таким же светлым, как и мозговое. Временная инволюция продолжается до тех пор, пока длится заболевание или стресс. После этого состояние коркового и мозгового вещества возвращается к норме.
Функции тимуса. Ткмус выполняет 2 основные функции:
1) кроветворную, которая заключается в антигеннезависимой дифференцировке предшественников Т-лимфоцитов,
2) гормональную, в результате которой в тимусе выделяется тимозин, стимулирующий функцию периферических лимфоидных органов кроветворения, инсулиноподобный фактор, кальцитониноподобный фактор, снижающий уровень кальция в крови, и фактор роста.
Если у новорожденного животного удалить тимус, то нарушится развитие периферических органов кроветворения и рост тела.
Чем образован гематотимусный барьер
Гематоэнцефалический барьер разграничивает нервную систему от общего кровотока, обеспечивая постоянную и оптимальную по химическому составу среду для ее функционирования.
Межклеточная жидкость занимает 15 % общего объема мозга и окружает нейроны и нейроглию. Схема межклеточных пространств представлена на рисунке ниже. Секретируемая сосудистыми сплетениями спинномозговая жидкость циркулирует в системе желудочков и субарахноидальном пространстве и через пахионовы грануляции проникает в синусы твердой мозговой оболочки.
Затем спинномозговая жидкость путем пассивного транспорта через выстилающую стенки желудочков эпендимоглиальную мембрану проходит во внеклеточные пространства мозга, где смешивается с межклеточной жидкостью, продуцируемой клетками капилляров, и в процессе клеточного метаболизма распространяется через пиаглиальную мембрану в субарахноидальное пространство. «Стекание» спинномозговой жидкости компенсирует отсутствие лимфатических сосудов в ЦНС.
Единственная составляющая спинномозговой жидкости, которая не проникает через гематоэнцефалический барьер,— метаболическая жидкость. В ее состав входят нейромедиаторы, высвобожденные нейронами и не подвергнувшиеся обратному захвату, что обусловливает наличие неспособных преодолеть гематоэнцефалический барьер медиаторов и их метаболитов в субарахноидальном пространстве.
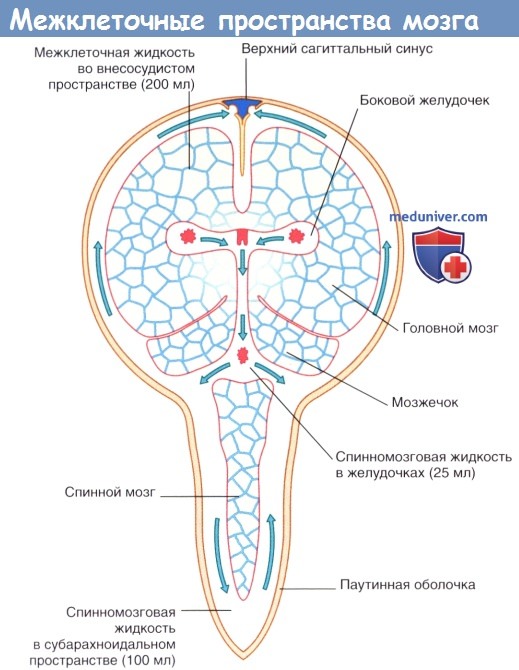
Стрелками показаны направления циркуляции спинномозговой жидкости.
Компоненты спинномозговой жидкости распределены следующим образом (по результатам поясничной пункции):
• жидкость, продуцированная клетками сосудистых сплетений, — 60 %;
• жидкость, продуцированная клетками капилляров, — 30 %;
• метаболическая жидкость — 10%.
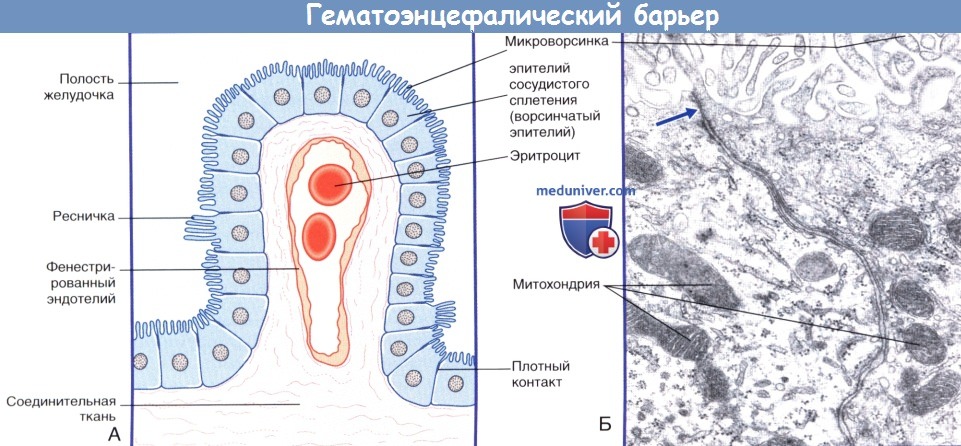
(Б) Ультраструктура эпителия сосудистого сплетения. В эпителиальных клетках расположены множество митохондрий и гранулярная эндоплазматическая сеть.
Клетки соединены плотными контактами в апикальной части.
Гематоэнцефалический барьер состоит из двух компонентов. Первый представлен барьером между кровью и спинномозговой жидкостью на уровне сосудистых сплетений, а второй — барьером между кровью и межклеточной жидкостью на уровне капилляров ЦНС.
а) Барьер между кровью и спинномозговой жидкостью. Барьер между кровью и спинномозговой жидкостью представлен эпендимальным эпителием сосудистых сплетений, который характеризуется следующими особенностями строения.
1. Практически все реснички замещены микроворсинками.
2. Клетки образуют плотные контакты. Именно эти места плотного соединения мембран клеток разграничивают кровь и спинномозговую жидкость.
3. Клетки эпителия содержат ферменты, обеспечивающие транспорт ионов и продуктов метаболизма.
б) Барьер между кровью и межклеточной жидкостью. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров ЦНС, который характеризуется следующими особенностями строения.
1. Эндотелиоциты образуют плотные контакты.
2. В состав клеток входит небольшое количество пиноцитозных пузырьков, а также отсутствуют фенестрации.
3. Транспортные системы в клетках аналогичны таковым в эпителии сосудистых сплетений.
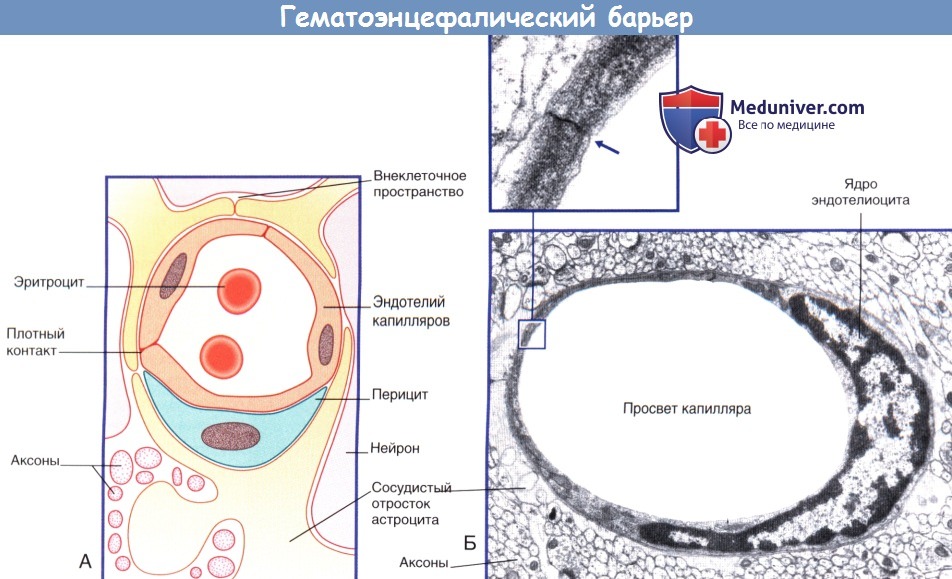
(Б) Капилляр центральной нервной системы. На поперечном срезе показан одиночный эндотелиоцит, полностью окружающий просвет сосуда.
Края эндотелиоцитов образуют плотный контакт. Эндотелиоцит окружен базальной мембраной. Капилляр окружен отростками астроцитов.
в) Функции перицитов капиллярного русла. Перициты и клетки эндотелия связаны с помощью щелевидных контактов. В ходе исследований культур клеток было достоверно доказано, что перициты играют ключевую роль в ангиогенезе капилляров, а также в формировании и поддержании плотных контактов между эндотелиоцитами.
Перициты принимают участие в саморегуляции мозгового кровотока за счет того, что на их поверхности экспрессируются рецепторы к вазоактивным медиаторам: норадреналину, вазопрессину, ангиотензину II. При хронической артериальной гипертензии развиваются гипертрофия и гиперплазия перицитов, а также происходит внутриклеточная продукция цитоплазматических сократительных филаментов, что обеспечивает компенсаторное расширение капилляров.
Поверхность клеточной стенки перицитов способна обеспечивать связывание протромбинового комплекса, за счет чего перициты могут принимать участие в процессе свертывания крови.
Кроме того, перициты обладают способностью к фагоцитозу и свойствами иммунорегуляторных цитокинов.
Общая площадь капиллярного русла головного мозга соответствует размерам теннисного корта! Наличие такой огромной поверхности объясняет тот факт, что мозг потребляет 20 % поступающего кислорода. Плотность капилляров коры головного мозга можно оценить на изображении латексного слепк.
г) Функции гематоэнцефалического барьера:
• Контроль проникновения метаболических веществ. Основной источник питания нейронов — глюкоза. При повышении уровня глюкозы в крови специфический белок-переносчик связывает ее, а при низком уровне — обеспечивает более активный захват.
• Предотвращение поступления в мозг токсических веществ и периферических нейромедиаторов, выделяемых вегетативными нервными окончаниями в системный кровоток.
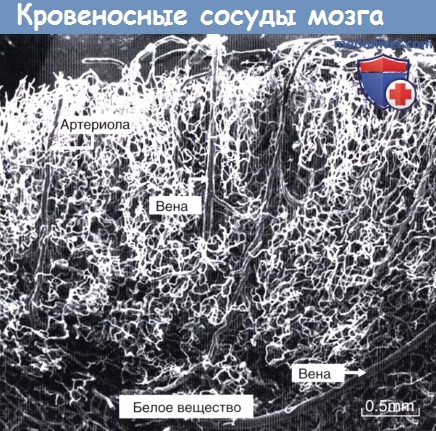
Корковые капилляры имеют вид извилистых белесоватых нитей.
д) Состояния, связанные с нарушением гематоэнцефалического барьера:
1. Пациенты с артериальной гипертензией подвержены приступам гипертонической энцефалопатии в связи с тем, что степень повышения давления превосходит компенсаторные способности стенок артериол. Вследствие такого повышения давления может произойти нарушение плотных межклеточных контактов эндотелия капилляров, что приводит к отеку мозга за счет быстрого выхода плазмы. Клинически эта ситуация проявляется сильной головной болью, рвотой и, в некоторых случаях, появлением судорог и развитием комы.
2. У пациентов с повышенным содержанием углекислого газа в крови (при заболеваниях дыхательной или сердечно-сосудистой системы, а также после хирургических вмешательств) причиной отека мозга даже при нормальном уровне артериального давления может стать расслабление мышечного слоя артериол. Данная ситуация клинически проявляется спутанностью сознания и сонливостью, в дальнейшем переходящими в кому.
3. Повреждения мозга (травмы или спонтанные кровоизлияния) приводят к отеку мозга вследствие осмотического повреждения тканей мозга (и других факторов).
4. Инфекционные заболевания мозга или его оболочек сопровождаются нарушением гематоэнцефалического барьера, предположительно из-за усиленного перемещения лейкоцитов в капиллярном русле мозга. Несостоятельность гематоэнцефалического барьера играет и положительную роль: стенки капилляров проницаемы для жирорастворимых антибиотиков.
Кроме того, капилляры опухолей мозга характеризуются наличием фенестраций, что позволяет идентифицировать злокачественное новообразование при помощи рентгеноконтрастного вещества, неспособного пройти через капилляры непораженных отделов мозга.
Редактор: Искандер Милевски. Дата публикации: 10.11.2018
Гематоэнцефалический барьер и лекарства
Поделиться:
Нормальная деятельность головного мозга возможна лишь в условиях биохимического и электролитного гомеостаза (равновесия). Поэтому жизненно необходимо, чтобы мозг был надежно защищен от попадания веществ, способных изменить работу центральной нервной системы. Для этого и существует гематоэнцефалический барьер, или сокращенно ГЭБ.
Для чего нам нужен ГЭБ
ГЭБ — это полупроницаемая мембрана, которая отделяет мозг от кровеносного русла. Этот барьер состоит из эндотелиальных клеток, астроцитов и перицитов. Мембрана имеет особо «плотное» расположение капилляров, что и является основой барьера, предохраняющего мозг от проникновения большинства веществ, циркулирующих в крови.
ГЭБ сохраняет специфическую внеклеточную среду вокруг нейронов, поддерживая концентрацию аминокислот, аскорбиновой и фолиевой кислот даже при снижении их концентрации в сыворотке крови.
Читайте также:
Инновации в нейронауках
Кроме того, абсолютно необходимо, чтобы никакие патогенные микробы не могли попасть в головной мозг. Иначе наступает катастрофа. Типичный пример: микроб менингита, так называемый менингококк, вполне мирно может проживать в носоглотке, но при ослаблении защитных сил (и нарушении проницаемости ГЭБ) менингококк попадает в центральную нервную систему, поражая оболочки головного мозга и вызывая потенциально смертельную болезнь — гнойный менингит.
Повышение проницаемости ГЭБ также характерно и для других заболеваний нервной системы. Например, при рассеянном склерозе активированные Т-лимфоциты легко преодолевают ГЭБ и вызывают поражение мозга.
Как ГЭБ работает на практике
Проницаемость гематоэнцефалического барьера напрямую зависит от величины молекул. Маленькие молекулы кислорода, углекислого газа проходят вообще без проблем. Но чем крупнее молекула вещества, тем труднее ей пробраться. Впрочем, существуют способы облегчить эту задачу. Например, давно замечено, что жирорастворимые вещества диффундируют через барьер на ура. Это свойство используется при создании некоторых лекарств, например снотворных барбитуратов.
Интересна ситуация с таким важным веществом, как глюкоза. Пониженный ее уровень — гипогликемия мозга — проявляет себя в виде головной боли, нарушений внимания, спутанности сознания и эпилептических приступов. При этом концентрация сахара в крови может оставаться нормальной (!). Тут «заупрямился» ГЭБ и возникли нарушения в системе переноса глюкозы.
Кстати, все больше и больше свидетельств, что классическая эпилепсия, происхождение которой в известной мере остается загадкой для врачей, является «болезнью ГЭБ», когда нарушен транспорт глюкозы в тканях мозга.
ГЭБ и фармакология
Давайте сразу уясним, что большинству лекарств незачем преодолевать этот барьер. К примеру, средство от расстройства желудка должно держаться подальше от мозга и заниматься своим прямым делом в пищеварительном тракте. Но если возникло серьезное поражение центральной нервной системы, «тогда мы идем к вам!».
Антибиотикам желательно добраться до мозга при инфекционных поражениях, противоконвульсивным препаратам — для лечения судорог и, уж конечно, нейролептикам — для купирования острых психозов. Эффективность вышеперечисленных препаратов напрямую зависит от проницаемости ГЭБ.
А вот при болезни Паркинсона, для которой характерен недостаток допамина в мозге, не удастся восполнить этот дефицит ни таблетками, ни уколами, потому что допамин через ГЭБ, к сожалению, не проходит. Хотя, например, предшественник допамина — Л-допа — способен преодолеть ГЭБ. Но все-таки это не совсем то, что нужно.
Кстати, похожая ситуация при депрессиях, в патогенезе которых большую роль играет глютамат. Глютамат также не проникает через через ГЭБ. Поэтому глотать его бессмысленно.
Когда ГЭБ может рухнуть?
Существует ряд ситуаций, при которых страдает ГЭБ и мозг остается незащищенным. Это может случиться при высоком артериальном давлении, поэтому стоит держать его под контролем. Внутривенное введение гиперосмолярных растворов также несет в себе угрозу нарушения барьера. Длительное воздействие микроволнового излучения и радиации доказанно считается причинами нарушений ГЭБ. Инфекции центральной нервной системы типично дают сбои в работе барьера. Также нарушения возможны при травмах мозга, его ишемии, воспалении и инсультах.
А если ГЭБ не пускает, но нам очень нужно?
Существует ряд заболеваний головного мозга, когда жизненно важно пропихнуть лекарство в определенный участок мозга. Чаще всего это онкология. Для этого используется метод «локального открытия ГЭБ». Лучше всего работают маннитол и его аналоги, которые вводятся в артерию мозга под контролем компьютерного томографа.
Маннитол открывает ГЭБ примерно на час, и за это время опухоль подвергается воздействию химиотерапии. С уходом маннитола дверь в мозг закрывается. И правильно — нельзя оставлять мозг без защиты.
Подобным эффектом открытия ГЭБ обладают Лейкотриен С4 и брадикинин. В определенной дозе ГЭБ открывает и гистамин. Кстати, «закрыть дверь» за гистамином можно его антиподом — цимедином. Имейте в виду, что все эти препараты вводятся прицельно в надлежащий кровеносный сосуд. Если принимать их в виде таблеток или инъекций, результата не будет.
Информация для простого пациента
Не ведитесь на рекламу деятелей «народной медицины», утверждающих, что нашли средства, улучшающие состояние психики. Далеко не всякая таблетка, вами проглоченная, вообще доберется до головы. На страже вашего мозга стоит ГЭБ, и чаще всего это только на пользу.
Чем образован гематотимусный барьер
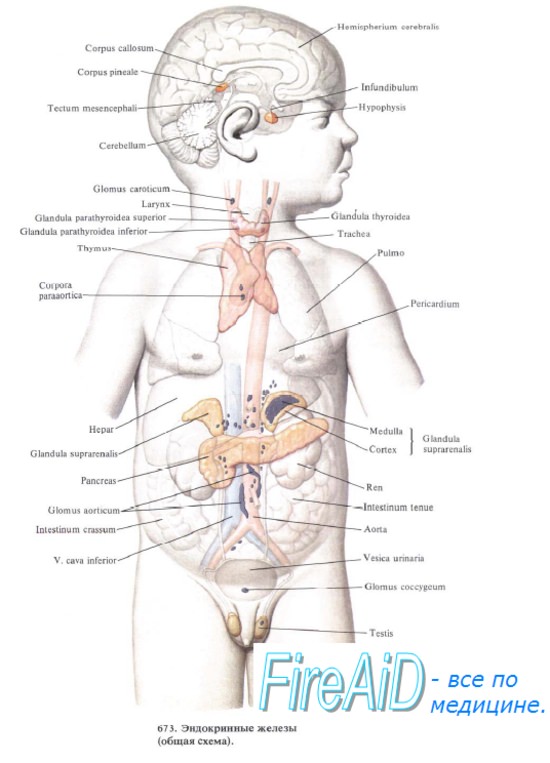
Тимус — центральный орган лимфоидного кроветворения и иммунной защиты организма. В тимусе происходит антигеннезависимая дифференцировка костномозговых предшественников Т-лимфоцитов в иммунокомпетентные клетки — Т-лимфоциты. Последние осуществляют реакции клеточного иммунитета и участвуют в регуляции гуморального иммунитета, что происходит, однако, не в тимусе, а в периферических органах кроветворения и иммунной защиты. Кроме того, в экстрактах тимуса обнаружено более 20 биологически активных веществ, в том числе дистантного действия, что позволяет отнести тимус к железам эндокринной системы.
Развитие тимуса. Тимус закладывается на 2-м месяце эмбриогенеза в виде небольших выпячиваний стенок 3-й и 4-й пар жаберных карманов. На 6-й неделе зачаток железы имеет отчетливо выраженный эпителиальный характер. На 7-й неделе он утрачивает связь со стенкой головной кишки. Эпителий закладки железы, образуя выросты в мезенхиму, приобретает сетевидное строение. Вначале плотная эпителиальная закладка железы разрыхляется благодаря заселению ее лимфоцитами. Число их быстро нарастает, и железа приобретает структуру лимфоэпителиалъного органа.
Врастающая мезенхима с кровеносными сосудами подразделяет тимус на дольки. В каждой дольке различают корковое и мозговое вещество. В гистогенезе тимуса в мозговом веществе долек образуются слоистые эпителиальные образования — эпителиальные жемчужины, или тельца Гассаля. В их составе определяются плотные эпителиальные клетки, концентрически наслаивающиеся друг на друга.
Строение тимуса. Снаружи вилочковая железа покрыта соединительнотканной капсулой. Отходящие от нее перегородки — септы — подразделяют тимус на дольки. Основу дольки составляют отростчатые эпителиальные клетки — эпителиоретикулоциты, в сетевидном остове которых находятся тимические лимфоциты (тимоциты). Источником развития Т-лимфоцитов являются костномозговые стволовые кроветворные клетки. Далее предшественники Т-лимфоцитов (претимоциты) поступают с кровью в тимус и превращаются здесь в лимфобласты.
В корковом веществе тимуса одни из них под действием выделяемых эпителиальными клетками пептидных гормонов — тимозина, тимопоэтина и др., а также макрофагов превращаются в антиген-реактивные Т-лимфоциты — приобретают рецепторы к строго определенным антигенам. Они выходят из тимуса, не попадая в мозговое вещество, и заселяют тимусзависимые зоны лимфатических узлов и селезенки. Здесь в периферических органах иммуногенеза происходит их дальнейшее созревание в Т-киллеры (цитотоксические), Т-хелперы, после чего они способны к рециркуляции, клонированию (пролиферации), образованию клеток-памяти.
Другие Т-лимфобласты превращаются в аутоиммунокомпетентные клетки, реактивные к аутоантигенам. Они подвергаются разрушению путем апоптоза (примерно 95% клеток) и фагоцитируются макрофагами.
Процесс специализации Т-лимфоцитов в корковом веществе долек тимуса происходит в условиях, предохраняющих от избыточного действия на них антигенов. Это достигается за счет образования гематотимического гистиона (барьера), состоящего из эндотелия гемокапилляров с отчетливо выраженной непрерывной базальной мембраной, перикапиллярного пространства с межклеточным веществом и макрофагами, а также из эпителиоретикулоцитов с их базальной мембраной. Корковое вещество тимуса имеет самостоятельное микроциркуляторное русло. Напротив, в мозговом веществе тимуса капиллярная сеть не выполняет барьерной роли, и через эндотелий этих капилляров зрелые лимфоциты могут уходить и возвращаться в тимус, т. е. рециркулировать.
В тимусе эти лимфоциты находятся в мозговом веществе. Зрелые лимфоциты покидают тимус через стенку посткапиллярной венулы.
Мозговое вещество тимуса имеет более светлую окраску, так как лимфоцитов здесь меньше, чем в корковом веществе. Эпителиальный остов выступает более отчетливо, а эпителиоретикулоциты здесь более крупные и многочисленные. В средней части мозгового вещества встречаются слоистые эпителиальные тельца Гассаля. С возрастом количество и размеры их увеличиваются. В строме тимуса кроме эпителиоретикулоцитов находятся макрофаги, дендритные клетки костномозгового происхождения, нейроэндокринные клетки — производные нервного гребня, а также миоидные клетки.
Возрастные изменения и реактивность тимуса.
После 20 лет происходит возрастная инволюция тимуса. Это сопровождается уменьшением количества лимфоцитов и развитием жировой ткани. В тех случаях, когда вилочковая железа не подвергается обратному развитию, возникает пониженная сопротивляемость организма к инфекциям и интоксикациям.
Ткани тимуса являются высокореактивными структурами. При действии повреждающих факторов (интоксикации, травмы и др.) наблюдаются выброс Т-лимфоцитов в кровь и массовая их гибель преимущественно в корковом веществе. Возникающая при таких стресс-воздействиях инволюция тимуса называется временной, быстропроходящей, или акцидентальной. Наблюдаемые при этом явления лимфоцитолиза и фагоцитоза макрофагами гибнущих лимфоцитов рассматриваются как возможные способы высвобождения факторов роста и ДНК, необходимых для восстановительных процессов в тканях. С гибелью лимфоцитов в этих условиях связывают также селекцию Т-лимфобластов.
Реактивные изменения вилочковой железы находятся в тесной корреляции с функциональными изменениями коры надпочечников и уровнем глюкокортикоидов в крови. В тимусе выявлены адренергические и холинергические нервные волокна, входящие в орган вместе с сосудами.





 Читайте также:
Читайте также: