Чем образован гематоэнцефалический барьер и какую функцию он выполняет
Анатомически, BBB представляет собой обширную сеть микрокапилляров протяженностью
650 км, каждый из которых имеет диаметр просвета
На целостность и функцию ВВВ оказывает сильное влияние то, что сейчас называют «расширенной нейрососудистой единицей или блоком» (“extended neurovascular unit”), которая включает в себя не только микрососудистые эндотелиальные клетки и смежные перициты, астроциты и нейроны, но также соседние клетки гладкой мускулатуры и микроглии в мозге, а также клетки крови, находящиеся в капиллярном просвете, например, таких как полиморфноядерные клетки, лимфоциты и моноциты. У
P-гликопротеин (ABCB1 / MDR1) является выдающимся молекулярным открытием доставки лекарственного средства в ЦНС через ВВВ. Стратегически обогащенный на мембране церебральных микрососудистых эндотелиальных клеток, P-гликопротеин использует энергию от АТФ-гидролиза, чтобы вытеснить лекарства обратно в микрокапиллярный просвет против крутых градиентов концентрации.
Кодеиновая анальгезия опосредованно централизована, что требует ее накопления в головном мозге, что и происходит при пассивной парацеллюлярной диффузии. Неконтролируемое увеличение потребления мозгом кодеина во время периферической воспалительной боли из-за патологического увеличения парацеллюлярной проницаемости может привести к значительным побочным эффектам ЦНС, связанным с опиоидами, такими как угнетение дыхания, зависимость и повышенная толерантность.
Гематоэнцефалический барьер (ВВВ) представляет собой физический и метаболический барьер, который отделяет ЦНС от периферического кровообращения. Доставка лекарств в ЦНС (CNS) через BBB является сложной задачей, в первую очередь из-за физического ограничения парацеллюлярной диффузии между эндотелиальными клетками, которые содержат микрососуды ВВВ, и активности транспортеров оттока, которые быстро вытесняют обратно в капиллярный просвет широкий спектр ксенобиотиков. В заключении отметим, что терапевтическое манипулирование трафиком P-гликопротеинов представляет собой относительно недорогой и неспецифический подход для усиления доставки лекарств в ЦНС (множества лекарств) и выбора оптимальных комбинаций лекарственных средств. Субстратами, влияющими на активность Р-гликопротеиновой транспортной системы, являются дигоксин, циметидин, такролимус, нифедипин, кетоконазол и амитриптилин.
Гематоэнцефалический барьер
Мозг является эпицентром электрофизиологической активности. Он объединяет информацию из внешней среды с сигналами из внутренней среды для выполнения определенных действий. Учитывая все специфические процессы, которые происходят на уровне нейронов, крайне важно, чтобы химическая среда, в которой работают эти клетки, имела определенные показатели. Нужно, чтобы к нейронам пропускались одни вещества, которые необходимы мозгу, и задерживались другие, которые для него опасны. Это основная функция гематоэнцефалического барьера (сокращенно – ГЭБ).
Что такое гематоэнцефалический барьер?
Согласно медицинскому определению, гематоэнцефалический барьер представляет собой избирательно проницаемую мембрану, регулирующую прохождение множества больших и малых молекул в микросреду нейронов. Это достигается благодаря множеству клеточных транспортных каналов, разбросанных по мембране.
Все эти каналы нужны мозгу для получения питательных веществ, строительных материалов и поддержания оптимальной работы нейронов.
История изучения ГЭБ
Впервые о ГЭБ стало известно после работ П. Эрлиха, изучавшего проникновение красителей в ткани.
Он отметил в экспериментах с животными, что при введении краски в кровь, структуры мозга не окрашиваются. А при введении краски в спинномозговой канал – окрашивание происходит, но краска не попадает в кровь и ткани тела. Был сделан логичный вывод – существует некий барьер, который разделяет ликвор и кровь. В 1900 г впервые был использован термин ГЭБ.
В дальнейшем знания о ГЭБ расширились, было определено, что существует барьер и между кровью и ликвором и между плазмой и периферическими нервами.
Структура гематоэнцефалического барьера
Мозг имеет большую сеть артериальных и венозных сосудов, соответственно, приносящих кровь к тканям мозга и отводящих ее. Однако, обмен веществ происходит на уровне капилляров. И внутренняя, и внешняя поверхность сосуда выстланы ключевыми структурами, которые формируют избирательный обмен.
Эндотелиальные клетки прикрепляются друг к другу очень плотно. Следовательно, эндотелий функционирует как непроницаемый барьер между просветом капилляра и тканью мозга. Необходимые вещества (вода, глюкоза, кислород, ионы и тд) передаются через специальные каналы. Остальные соединения, которые могут быть опасны, не проникают через гематоэнцефалический барьер.
Неотъемлемыми компонентами в формировании гематоэнцефалического барьера считаются перициты. Они окружают эндотелиальные клетки капилляров и способны сокращаться, чтобы регулировать капиллярный кровоток и количество крови, протекающей через капилляры.
Ключевые функции гематоэнцефалического барьера
Гематоэнцефалический барьер действует как дополнительная граница между циркулирующей кровью и внеклеточным пространством мозга. Барьер является высокоселективным, то есть он позволяет только определенным веществам проникать из кровотока в мозг. Эта функция защищает мозг от токсинов, патогенов и даже циркулирующих нейротрансмиттеров (например, глутамата), который может быть потенциально вредным для нейронов, если их уровень становится слишком высоким. Только вода, определенные газы (например, кислород) и жирорастворимые вещества могут легко диффундировать через барьер (другие необходимые вещества, такие как глюкоза, могут активно транспортироваться через гематоэнцефалический барьер с некоторым усилием).
Особые зоны гематоэнцефалического барьера головного мозга
Есть области мозга, где ГЭБ отсутствует. Эта особенность позволяет областям мозга ощущать и влиять на гомеостатические изменения в системном кровообращении. В результате мозг способен обнаруживать изменения в работе тела и осуществлять необходимые защитные физиологические процессы для смягчения этих действий.
Нарушения гематоэнцефалического барьера
Повреждения головного мозга, вызванные гипертонической энцефалопатией (длительным повышеннымдавлением), эпилептическим статусом или ишемией (длительной нехваткой кислорода), могут привести к нарушениям гематоэнцефалического барьера в течение двух-трех недель. Это разрушение барьера позволит молекулам, которым обычно запрещено контактировать с тканями мозга, попадать в микросреду центральной нервной системы. Одно из предположений о точном механизме, с помощью которого это происходит, состоит в том, что гипертония, ишемия или иные влияния приводят к повреждению эндотелия и последующему разрушению плотных соединений. Неопластические поражения также обеспечивают серьезные поражения гематоэнцефалического барьера. Одним из отличительных признаков опухолей является быстрый ангиогенез (рост сосудов). В случае опухоли мозга, новообразованные сосуды, лишены гематоэнцефалического барьера. Следовательно, участок опухоли также служит точкой входа нейротоксических агентов в нервную ткань.
Проблемы, которые формирует ГЭБ
Хотя ГЭБ – это важный слой защиты между периферическим кровообращением и мозгом, в определенных ситуациях проблематично, что доступ к мозгу является настолько ограниченным. Например, в редком случае, когда есть инфекция головного мозга, барьер очень затрудняет доставку противомикробных препаратов в мозг.
В этом случае возможно применение Глиатилина. Он проникает через ГЭБ и обладает способностью восстанавливать холинергическую систему мозга, нормализуя работу мозга.
Открыть ворота гематоэнцефалического барьера
Оксана Семячкина-Глушковская,
доктор биологических наук, Саратовский государственный университет им. Н. Г. Чернышевского
«Наука и жизнь» №7, 2015
В последнее десятилетие всё чаще врачи сталкиваются с инсультом новорождённых, но лечить его пока не очень получается. Трудности связаны с гематоэнцефалическим барьером — одной из самых загадочных систем мозга, «перегородкой» между кровью, циркулирующей в теле, и мозгом. Именно он решает, что допустить в мозг, а что — нет. Сегодня тема преодоления гематоэнцефалического барьера нужными лекарствами стала одной из горячих и «денежных» в нейрофизиологии.
130 лет назад человечеству приоткрылся один из механизмов работы мозга: была обнаружена «перегородка» между мозгом и кровеносной системой тела — гематоэнцефалический барьер. Он состоит из нескольких слоёв: со стороны тела кровеносный капилляр мозга выложен клетками эндотелия на базальной мембране. Со стороны ткани мозга находится слой нейронов, так что они переплетаются в трёхмерную сеть. Такая структура позволяет регулировать проникновение из крови в мозг биологически активных веществ, метаболитов, но препятствует поступлению в мозг чужеродных веществ, микроорганизмов, токсинов
Гематоэнцефалический барьер — тонкая физиологическая организация — оставался вне поля зрения учёных до тех пор, пока не стало очевидно, что именно он тормозит успехи современной медицины и именно в его работе скрыты ресурсы для новой эпохи в фармакологии. За последние 20 лет в мире было синтезировано более 40 новых препаратов, из которых всего два — для лечения болезней мозга. Гематоэнцефалический барьер создаёт для некоторых веществ «зелёный» коридор, но для целого ряда препаратов он остаётся непроницаемым, и потому врачи безоружны в борьбе со многими неврологическими патологиями, такими, например, как инсульт мозга. Задача проницаемости барьера встала, когда было признано, что у новорождённых это заболевание встречается так же часто, как у взрослых.
Десять лет назад диагноз «инсульт» детям ставили крайне редко. Сегодня прогресс в развитии безопасных технологий для внутреннего исследования мозга (визуализация) позволил исследователям увидеть серьёзность проблемы. Особенность детского инсульта в том, что он проходит зачастую бессимптомно или «маскируется» под другие заболевания. Последствия катастрофичны для ребёнка. У большинства маленьких пациентов возникают серьёзные нарушения: задержка умственного и речевого развития, гиперреактивность, затруднения в концентрации внимания, у них страдают логика и адаптация к стрессам, что не сразу и не очевидно проявляется в первые дни жизни.
Но диагностика инсульта мозга у новорождённых — лишь первый этап. Главный вопрос — как лечить и как предупредить это заболевание. Детский и взрослый инсульты — разные! Мы знаем, какие факторы провоцируют развитие инсульта у взрослых — к примеру, гипертензия. Но для малышей эти факторы не так актуальны, и даже такие очевидные на первый взгляд причины, как родовые травмы, не вошли в лидирующую десятку провокаторов инсульта у детей.
Почему инсульты мозга у новорождённых и взрослых так различаются? После появления на свет мозг ребёнка ещё продолжает развиваться, причём особенно интенсивно в первые дни после рождения. В настоящий момент не существует тактики лечения инсульта мозга у новорождённых. Мало зная об этом заболевании у младенцев, врачи вынуждены применять к ним терапию, показанную для взрослых. Она оказывается неэффективной, а иногда даже мешает выздоровлению. Успех в лечении таких детей — зачастую случайность, а не результат заранее спланированной тактики врача.
Возникло предположение, что многие препараты, которые существуют в арсенале врача для лечения инсульта, просто не доходят до мозга новорождённого из-за капризного гематоэнцефалического барьера, который закрывается и не даёт поработать препаратам.
Несмотря на прорывные технологии в визуализации структур мозга, решения проблем детского инсульта не было, потому что не хватало подходящего инструментария для исследования «ворот», пропускающих лекарства в гематоэнцефалическом барьере.
В экспериментальной медицине платформа для изучения любых болезней — моделирование патологии на животных. Среди существующих на сегодняшний день моделей инсульта ни одна не пригодна для новорождённых.
Есть два типа инсульта — ишемический, когда сосуды мозга сужаются, что ограничивает его питание и кровоснабжение, и геморрагический, когда сосуды рвутся без явных на то причин. У новорождённых преобладает второй тип инсульта. Однако модели, традиционно применяемые для изучения геморрагического инсульта, работают по принципу механического введения крови в мозг экспериментальных животных, что сильно ограничивает исследовательские возможности.
На биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского разработали модель инсульта, с помощью которой можно увидеть, как сосуды мозга разрываются самостоятельно, без дополнительных вмешательств. Для этого используется звуковой стресс (120 дБ, 7 Гц). Звуковые волны за счёт способности глубоко проникать в мозг нарушают центры регуляции его кровотока.
Сосудистые «катастрофы» у новорождённых случаются не сразу, а через два-три дня после рождения. Аналогичные изменения происходят с сосудами лабораторных животных после влияния звукового стресса. И хотя звук — это неадекватный провоцирующий фактор для детского инсульта, на сегодняшний день это единственная модель, которая позволяет изучать развитие данной патологии без инвазивных вмешательств, запуская внутренние патологические процессы, максимально приближенные к естественному ходу событий.
Однако для взрослых животных простого стресса недостаточно, чтобы вызвать инсульт головного мозга. Для них требуется наличие хронически высокого артериального давления, изнашивающего сосуды и делающего их стресс-неустойчивыми. Для того чтобы изучать, как работает «барьер» на первых этапах жизни и на последующих этапах развития, мы вооружились современными методами флуоресцентного обнаружения белков окклудин и клаудин-5, работающих «таможенниками» на границе между мозгом и кровью. Воспользовались и старым методом изучения прохождения барьера красителем Evans blue (голубой Эванса), связывающимся с белками крови. Именно этот краситель в 1885 году помог открыть гематоэнцефалический барьер немецкому нейрофизиологу Паулю Эрлиху. Когда он ввёл краситель в кровь, то обнаружил, что все внутренние органы окрасились, а мозг нет. Позже опыты повторил его ученик Эдвин Голдман, но он вводил краситель уже непосредственно в спинномозговой канал лабораторного животного. Мозг становился синим, при этом вся краска оставалась в нём, не проникая на периферию. И по сей день краситель Evans blue — надёжный способ проверки работы гематоэнцефалического барьера. Конечно, появились и другие, более точные способы тестирования проницаемости барьера, например светящиеся метки, закреплённые на полисахаридах — декстранах разной массы (3 кДа и 70 кДа).
Появление голубого окрашивания тканей мозга у взрослой (справа) и у новорождённой (слева) крыс на фоне развития инсульта и введения красителя Evans blue
А теперь посмотрим, как работает гематоэнцефалический барьер при развитии геморрагического инсульта и как эти процессы отличаются друг от друга в первые дни после рождения лабораторного животного и в последующем его развитии.
Оказалось, внутривенное введение красителя крысам на фоне развития инсульта сопровождается появлением голубой окраски тканей мозга только у взрослых, но не у новорождённых особей.
Мы исследовали, какие вещества проходят через гематоэнцефалический барьер в условиях, когда организму необходимо бороться с инсультом. Для этого использовали флуоресцентные метки — лёгкие (декстран 3 кДа) и тяжёлые (декстран 70 кДа), которые своим свечением подсказывают нам их местонахождение и помогают определить путь движения.
Лёгкие флуоресцентные метки (декстран 3 кДа) распределены по-разному: у взрослой крысы (слева) — распределение по всему мозгу, а у новорождённой (справа) — концентрирование в сосуде на фоне развития инсульта мозга
Как оказалось, у взрослых крыс мозг при инсульте как решето: пропускает даже высокомолекулярные соединения (декстран 70 кДа). А у новорождённых декстрановые флуоресцентные метки застревают в сосудах: барьер закрывается так плотно, что даже низкомолекулярные соединения (декстран 3 кДа) остаются в пределах сосудов и не попадают в мозг.
Используя метод иммуноблоттинга (метод определения специфических белков), удалось увидеть белки, которые и делают барьер непроницаемым. Мы наблюдали за двумя критически важными белками — клаудином-5 и окклудином. У новорождённых крыс этих белков в разы больше, чем у взрослых. Вот почему краситель Evans blue и флуоресцентные метки у новорождённых особей «застревают» в барьере, в то время как у взрослых он становится более «лояльным» — проницаемым для веществ, которые в обычных условиях в мозг не попадают.
Экспрессия структурных белков гематоэнцефалического барьера — окклудина и клаудина-5 у новорождённых и взрослых крыс (более тёмные полоски отражают более высокую экспрессию)
Возможно ли найти объяснение разного поведения мозга в момент его начального развития и когда статус организма уже сформировался? Мозг развивается по принципу избыточности. Он старается иметь сразу всё и много и только потом разбирается, что с этим делать. Часть его структур, к примеру адренергические нейроны, у которых медиаторами служат норадреналин и адреналин, образуется задолго до рождения, но созревает только к двум годам жизни. Другие структуры, альфа2-адренорецепторы, наоборот, созревают до рождения в огромном количестве, а после их плотность заметно снижается. Но так или иначе, многие молекулярные структуры мозга, равно как и его биохимия, формируются заведомо с избытком. Возможно, это одна из причин, почему у новорождённых наблюдается повышенная экспрессия «барьерных» белков, препятствующих проникновению многих «взрослых» препаратов, которые применяют при лечении инсульта мозга.
Тайна гематоэнцефалического барьера — как грань между небом, землёй и воздухом. Его можно «увидеть», но трудно постичь. Нужны бойцы-невидимки, которые могли бы обмануть строгих стражей барьера, пронести необходимую «гуманитарную помощь» страдающему мозгу маленького пациента и помочь ему в борьбе с инсультом. Такими помощниками могут стать транспортные системы — липосомы, капсулы, углеродные нанотрубки, которые активно разрабатываются с этой целью во всём мире.
Исследования проводились на биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского в рамках проекта Российского научного фонда (№14-15-00128) и гранта Президента РФ (МД-2216.2014.4).
Прямо в мозг: препятствия и способы их преодолеть
Введение наночастиц в носовую полость мыши для изучения транспорта веществ в мозг в обход гематоэнцефалического барьера.
рисунок автора статьи
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: В ходе работы мы выяснили механизм проникновения наночастиц из носовой полости в мозг, минуя гематоэнцефалический барьер (ГЭБ). Для этого были использованы наночастицы оксида марганца (Mn3O4), которые визуализировались при томографии. На данный момент описано несколько возможных путей транспорта веществ из носовой полости в мозг, но точный механизм еще не определен. Чтобы увидеть, как именно наночастицы проникают в мозг, проводились серии экспериментов по блокированию захвата/транспорта наночастиц в нейронах; проверялась и гипотеза транспорта по внеклеточному пространству. Актуальность данной работы — выявление путей доставки лекарственных препаратов и изучение проникновения вирусов в мозг в обход ГЭБ.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
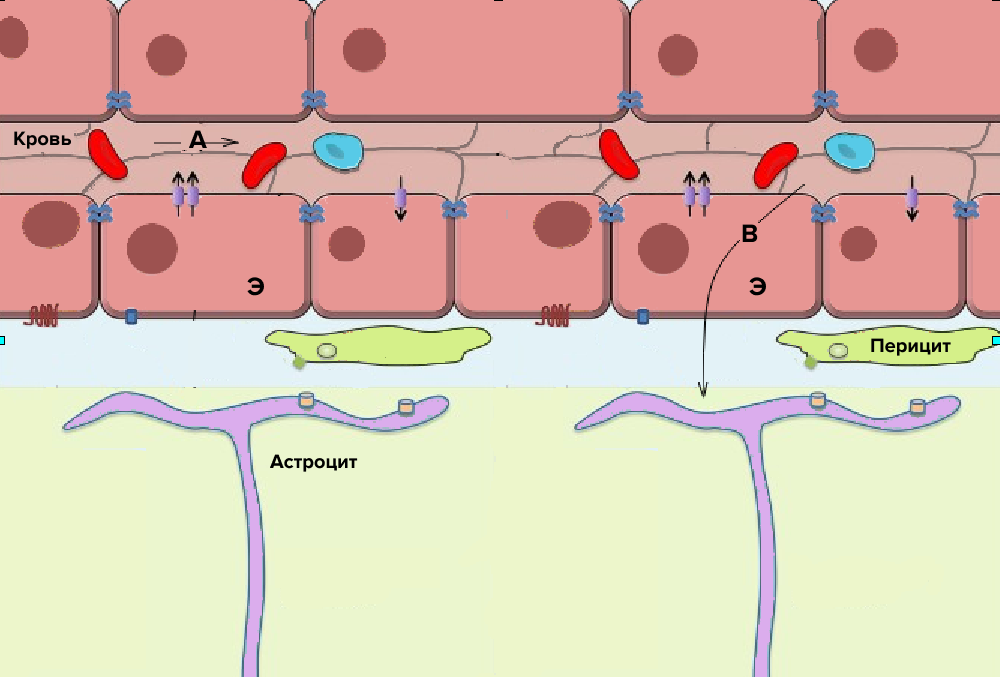
В организме человека существует специальная система защиты мозга от проникновения в него крупных молекул, в том числе инфекционных агентов — это гематоэнцефалический барьер (ГЭБ). Давайте подробнее рассмотрим его структуру (рис. 1). Первая линия защиты — плотный стой эндотелия капилляров, соединенных плотными контактами. В отличие от большинства капилляров тела, в них нет крупных щелей (пор) для прохождения некоторых белков плазмы [1]. Далее на пути к мозгу находятся перициты (клетки соединительной ткани) и астроциты (вспомогательные клетки в нервной ткани), которые механически не позволяют пройти молекулам крупнее определенного размера. Гематоэнцефалический барьер не пропускает вещества более 400–500 Да по массе, в зависимости от свойства вещества. (Для сравнения, сывороточный альбумин человека, самый распространенный белок в крови, имеет массу 65 000 Да). Также барьер непроницаем для ионов, но пропускает жирорастворимые вещества, воду, кислород, углекислый газ, некоторые обезболивающие и алкоголь (рис. 1).
Рисунок 1. Схема строения гематоэнцефалического барьера.
Э — клетки капилляров, соединенные плотными контактами; A — вещества, не проникающие через ГЭБ; B — вещества, проникающие через ГЭБ каким-либо способом, описанным ниже. Стрелками обозначены белковые системы транспорта веществ внутрь клетки и из нее.
рисунок автора статьи
Таким образом, долгое время считалось, что мозг полностью защищен от проникновения некоторых веществ из крови, пока не было обнаружено возможности прохода через ГЭБ. Такой способ доставки нужен прежде всего для доставки лекарств в нервную систему, поэтому было важно найти способы преодолеть барьер: ослабить клеточные контакты эндотелия (клеточного слоя) капилляров мозга, использовать системы транспорта веществ через мембрану капилляров или проникнуть в мозг с помощью эндоцитоза [2]. У данных способов есть свои недостатки, например, разрушение плотных контактов эндотелия приводило к местному накоплению веществ в мозге, повышению внутричерепного давления и требовало значительного времени на восстановление барьера [3]. Использование систем транспорта растворимых в воде метаболитов для доставки действующего вещества в мозг накладывает ограничения на само вещество. В данном случае оно должно либо имитировать «привычный» для данного белка-транспортера метаболит клетки, либо связываться с метаболитом для прохождения через мембрану [4]. Транспорт веществ путем эндоцитоза (захвата внешнего материала) клетками эндотелия тоже имеет свои недостатки — неспецифический эндоцитоз сведен к минимуму в капиллярах мозга, а специфический эндоцитоз часто включает в себя частичное пропускание вещества. Например, при доставке ионов железа посредством белка ферритином этот белок связывается с рецептором на эндотелии капилляра, проникает в клетку, высвобождает ионы железа для их дальнейшего транспорта в мозг, а потом удаляется из клетки обратно в просвет капилляра [5]. У всех перечисленных выше способов есть общий нюанс — вещество попадает в мозг через кровь, а значит, вещество распределяется равномерно по всему организму, поэтому нужно учитывать его системный эффект. Это накладывает дополнительные ограничения и увеличивает время испытания нового лекарства. В последние десятилетия ученые пытались преодолеть барьер и доставить лекарства с помощью наночастиц, введенных в кровь [6–8].
Наночастицы — собирательное название для группы веществ размером от 1 до 1000 нм. Они могут иметь различаться по форме и своим свойствам, в зависимости от пути преодоления ГЭБа. Это могут быть различные полимеры, натуральные или синтетические, или металлические частицы. Однако пока что наночастицы показывают не лучшие результаты в качестве транспортеров лекарств через барьер, если их вводить в кровь, а способ их проникновения через барьер — все еще спорный вопрос [9]. Как отметил Франческо Элдро, было потрачено много времени на изменение (модификацию) действующих веществ в составе лекарств для преодоления барьера, но гораздо меньше изучали способы их проникновения в мозг [10], [11].
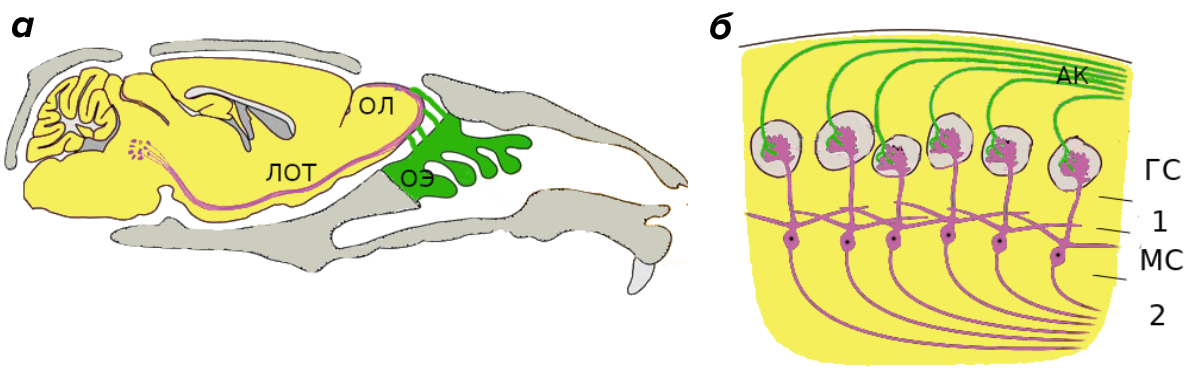
Существуют способы проникнуть в нервную систему, даже минуя стадию попадания в кровь. Конечно, можно просверлить отверстие в черепе и ввести вещество иглой через барьер — это довольно эффективный способ преодолеть ГЭБ. Единственный недостаток в том, что введенное вещество практически не распространяется по мозгу [12]. Но есть и гораздо менее инвазивный вариант — проникнуть в мозг через носовую полость в обход ГЭБа. Рассмотрим, почему этот способ вызывает особый интерес у ученых. Вспомним строение обонятельной системы позвоночных на примере мыши (рис. 2). В носовой полости есть специальный участок скопления рецепторных окончаний нейронов — обонятельный эпителий. От дендритов сигнал проходит через тело, транспортируется по аксону и передается митральной клетке, входящей в состав обонятельной луковицы; место передачи называется синапсом.
Рисунок 2. Строение обонятельной системы.
(a) — строение обонятельной системы мыши в разрезе. ОЭ — обонятельный эпителий, ОЛ — обонятельная луковица, ЛОТ — латеральный обонятельный тракт.
(б) — cтроение обонятельной луковицы мыши. АК) — аксоны обонятельных рецепторов, ГС — гломерулярный слой, МС — митральный слой, 1 и 2 — внешний и внутренний плексиформные слои обонятельной луковицы.
рисунок автора статьи
Тела митральных клеток образуют митральный слой, а аксоны этих клеток формируют латеральный обонятельный тракт. По нему передается информация о запахах в центры головного мозга, которые обрабатывают сигнал. Из-за «доступности» такого способа попадания в мозг, который вдобавок не требует серьезных ограничений по структуре и размерам веществ, данная тема требует более подробного анализа.
Данная работа посвящена изучению процесса проникновения наночастиц в головной мозг через носовую полость. Этот путь актуален не только с точки зрения доставки лекарственных препаратов, но и с точки зрения изучения процесса проникновения вирусов в головной мозг. У всех сейчас на слуху специфический симптом коронавирусной инфекции — потеря обоняния, что свидетельствует о возможности неспецифического проникновения любого вещества в нашу нервную систему.
Описание эксперимента и результаты
Для более точной визуализации транспорта веществ в мозг через носовую полость мы использовали наночастицы оксида марганца (Mn3O4, диаметр
34 нм). Введя их в одну ноздрю мыши, можно увидеть положение наночастиц при томографии (рис. 3).
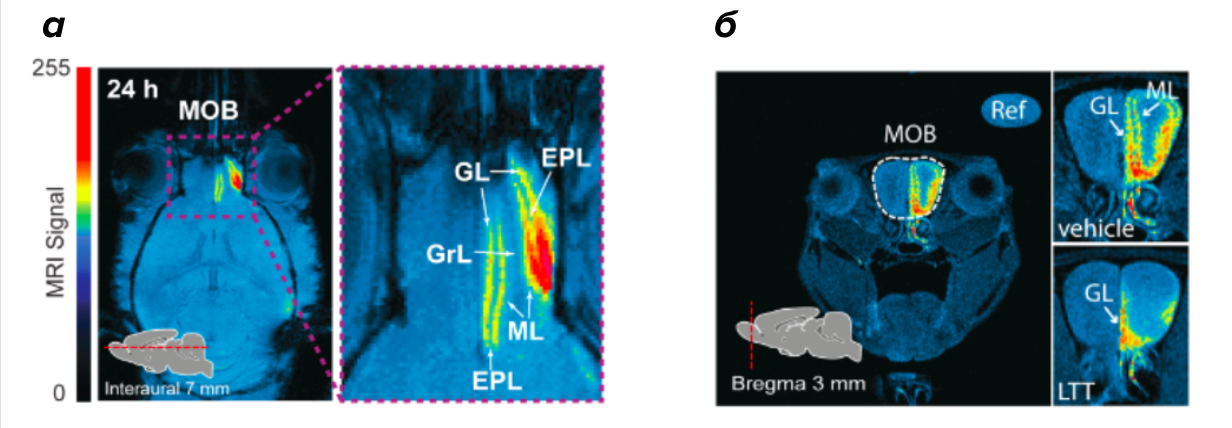
Рисунок 3. Томограмма обонятельной луковицы мыши.
(a) — распределение МРТ сигнала по слоям обонятельной луковицы (MOB): гломерулярному слою (GL), наружному плексиформному слою (EPL), слою митральных клеток (ML), слою зернистых клеток (GrL) спустя 24 часа после введения Mn3O4-наночастиц в правую ноздрю. Интенсивность сигнала выделена с помощью псевдоокрашивания (компьютер окрашивает изображение в различные цвета в зависимости от интенсивности МРТ-сигнала).
(б) — снимок в присутствии (LTT) и отсутствии (vehicle) ингибитора пресинаптической активности нейрона. Белыми стрелками показаны слои: гломерулярный слой (GL) и слой митральных клеток (ML).
рисунок автора статьи
В ходе работы было проанализировано влияние различных ингибиторов на захват и транспорт наночастиц в головной мозг мыши для ответа на основной вопрос: наночастицы проходят из носовой полости по нейронам или они попадают в нервную систему через внеклеточное пространство [13].
Чтобы проследить путь наночастиц из обонятельного эпителия в обонятельную луковицу, были использованы специфические и неспецифические ингибиторы эндоцитоза, а также вещества, разрушающие плотные контакты клеток обонятельного эпителия. Отличия между ингибиторами эндоцитоза в том, что специфические ингибиторы блокируют захват клетками определенного вещества, а неспецифические снижают общую способность клеток к эндоцитозу. Исходя из полученных данных, мы заключили, что частицы поглощаются клетками ольфакторного эпителия, а не проходят между ними. Также можно сделать вывод, что захват наночастиц происходит без сопряжения с каким-либо веществом, так как специфические ингибиторы эндоцитоза не влияли на уровень МРТ-сигнала.
Чтобы проследить дальнейший путь наночастиц, мы использовали ингибиторы аксонального транспорта (колхицин, лидокаин). Колхицин блокирует перемещение грузов от тела нейронов до синапса; лидокаин подавляет проведение импульсов в нейронах вследствие блокирования натриевых каналов (поэтому наночастицы, попав в нейрон, не могут передаваться дальше в синапс). Оба ингибитора достоверно повлияли на транспорт Mn3O4-наночастиц из носовой полости в мозг. Таким образом, мы показали, что Mn3O4-наночастицы проникают в обонятельную луковицу через аксон, а их транспорт зависит от активности нейрона.
Продолжая двигаться в мозг с наночастицами, мы попадаем во внешний слой обонятельной луковицы. Здесь наночастицы стоят перед выбором: либо идти через синапс в следующий нейрон и дальше транспортироваться по латеральному обонятельному тракту, либо перемещаться через межклеточное пространство.
Понять это возможно посредством влияния блокаторов. Ингибиторы пре- и постсинаптической активности нейронов влияют лишь на стадию транспорта наночастиц из обонятельной луковицы (MOB) в латеральный обонятельный тракт (LOT). Причем значительное влияние оказывают только ингибиторы пресинаптической активности — баклофен и LTT (левитриацетам). Такой эффект появляется из-за того, что наночастицы не работают как нейромедиаторы. Чтобы вызвать у нейрона постсинаптическую активность, вещество должно связаться с рецептором на поверхности нейрона и вызвать появление потенциала действия в нем (передать сигнал дальше по нервной цепочке). Наночастицы не могут связываться со специфическими рецепторами; они попадают в следующий нейрон за счет неспецифического эндоцитоза. Из-за этого ингибиторы постсинаптической активности практически никак не влияют на транспорт наночастиц из обонятельной луковицы в латеральный обонятельный тракт. Поэтому можем сделать вывод: наночастицы передаются транссинаптически по структурам головного мозга, отвечающим за обоняние в обход ГЭБ.
Обсуждение
Таким образом, на примере магнитных наночастиц мы показали, что возможен транспорт частиц из носа в мозг в обход ГЭБ внутри нейрональных клеток. Более того, процесс назального транспорта частиц зависит от активности нейронов. Так как данные наночастицы схожи по размерам и другим физическим свойствам с респираторными вирусами, можно предположить что транспорт вирусов в нервную систему возможен не только путем проникновения через ГЭБ [14]. Таким образом, найденный способ транспорта наночастиц в обход ГЭБ дает основу для исследования передачи вирусных заболеваний этим путем, а также для создания новых противовирусных препаратов. Особой актуальностью обладает исследование транспорта SARS-CoV-2, так как одним из симптомов коронавирусной инфекции является потеря вкуса и обоняния.
Заключение
Итогом работы стало подтверждение гипотезы о том, что наночастицы транспортируются через нейроны в головной мозг, а не через межклеточное пространство. Также мы можем сказать, что они не только захватываются обонятельными рецепторами, но и проходят через синапс в митральную клетку обонятельной луковицы, после чего по латеральному обонятельному тракту транспортируются в головной мозг. Понимание точного механизма транспорта веществ в обход ГЭБ может значительно упростить создание лекарственных препаратов против известных заболеваний — болезни Паркинсона и болезни Альцгеймера, а также поможет расширить представление о способах проникновения вирусов в нервную систему человека.