Чем нейтрализовать плавиковую кислоту в домашних условиях
ПЕРВАЯ ПОМОЩЬ: ХИМИЧЕСКИЙ ОЖОГ
ХИМИЧЕСКИЕ ОЖОГИ являются результатом воздействия на ткани (кожные покровы, слизистые оболочки) веществ, обладающих выраженным прижигающим свойством (крепкие кислоты, щелочи, соли тяжелых металлов, фосфор). Большинство химических ожогов кожных покровов являются производственными, а химические ожоги слизистой оболочки полости рта, пищевода, желудка чаще бывают бытовыми.
ПОД ДЕЙСТВИЕМ ЕДКИХ ВЕЩЕСТВ КОЖА И СЛИЗИСТЫЕ ОБОЛОЧКИ БЫСТРО ОМЕРТВЕЮТ. Агрессивные химические вещества медленно проникают в ткани, поэтому длительно поражают организм, разрушая эритроциты, нарушая обмен в тканях, функции внутренних органов (общее отравление). С момента соприкосновения этих веществ с покровами тела до завершения химических реакций обычно проходит время. Вследствие этого степень проявления ожога химическим соединением во многом зависит от типа этого вещества, его концентрации, времени воздействия на организм пострадавшего, состояния и индивидуальных особенностей (повышенной чувствительности) человека.
· Немедленно вызовите «скорую помощь».
· Быстро снимите одежду, удалите с кожи химическое вещество (сухим тампоном, платком и т.д.). при ожоге кислотой пользоваться влажным тампоном опасно, так как вещество, смешавшись с водой, глубоко проникнет в кожу через поры.
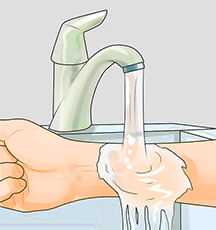
· При ожогах кислотой лейте на поверхность кожи в течение 15-20 минут раствор соды (1 чайная ложка на стакан воды) или холодную мыльную воду. Ожог плавиковой кислотой промывайте проточной водой 2-3 часа.
· Если ожог вызван щелочью, промытые водой участки кожи обработайте раствором лимонной или борной кислоты (половина чайной ложки порошка на стакан воды) либо столовым уксусом, наполовину разбавленным водой.
· Участки тела, пораженные фосфором, погрузите в воду или промойте сильной струей воды (на воздухе фосфор вспыхивает). Обработайте место ожога 5%-ным раствором медного купороса и закройте чистой сухой повязкой. При смазывании зоны ожога жиром, маслом или мазями фосфор всасывается в кожу – ЭТО ОПАСНО!
· Ожог, вызванный негашеной известью, сразу смывать водой нельзя (выделяется тепло и усиливается термическая травма). Удалите известь с кожи куском сухой чистой ткани; затем промойте кожу проточной водой и обработайте любым растительным маслом. Наложите сухую стерильную повязку.
Действия в условиях возможного химического заражения (при аварии с выбросом соляной кислоты)
Памятка населению «Действия в условиях возможного химического заражения»
(при аварии с выбросом соляной кислоты)
Население, проживающие вблизи химически опасных объектов, должно знать свойства, отличительные признаки и потенциальную опасность аварийно химических опасных веществ, уметь действовать при возникновении аварии, оказывать первую медицинскую помощь пострадавшим.
СОЛЯНАЯ КИСЛОТА – бесцветная прозрачная агрессивная негорючая жидкость с острым запахом хлористого водорода. Хорошо растворяется в воде во всех пропорциях, «дымит» на воздухе из-за образования хлористого водорода с парами воды капелек тумана. Разрушает бумагу, дерево, ткани. При попадании на кожу вызывает ожоги. Воздействие тумана соляной кислоты, образующегося в результате взаимодействия хлористого водорода с водяными парами воздуха, вызывает отравления. На расстоянии свыше 50 метров от очага концентрация резко уменьшается. Тяжелее воздуха.
При вдыхании паров : кашель, першение в горле, слезотечение, насморк, нарушение ритма дыхания, удушье, охриплость голоса, загрудинные боли, рвота с кровью.
При поступлении через рот : ожоги губ, слизистой полости рта, резкие боли за грудиной, боли в области желудка, рвота с кровью, охриплость голоса, спазм и отек гортани, болевой шок, коллапс.
Промышленные и гражданские противогазы, при их отсутствии – ватно-марлевые повязки, смоченные 5% раствором пищевой соды или гашеной извести. Для защиты кожи используют костюмы из кислотостойкой ткани, сапоги, рукавицы, перчатки из кислотостойкой резины.
МЕРЫ ПЕРВОЙ ПОМОЩИ.
При ингаляционном отравлении – придать пострадавшему горизонтальное положение; свежий воздух, питье теплого молока с питьевой содой; антигистаминные и противокашлевые препараты.
При попадании через рот – обильное питье холод- ной воды с кусочками льда, молока (по возможности с несколькими взбитыми сырыми яйцами или антацидными препаратами, не содержащими гидрокарбонаты). Осторожно с введением карбонатов, «нейтрализацией».
. Противопоказано вызывать рвоту искусственным путем.
. Во всех случаях срочная госпитализация.
ПОРЯДОК ДЕЙСТВИЙ НАСЕЛЕНИЯ ПРИ ОПОВЕЩЕНИИ ОБ АВАРИИ С ВЫБРОСОМ СОЛЯНОЙ КИСЛОТЫ
1. Выслушайте сообщения и рекомендации по радиоприемнику или телевизору
2. Наденьте средства защиты органов дыхания и кожи
При наличии индивидуальных средств защиты, убежища, а также возможности выхода из зоны аварии:
1. Наденьте средства защиты органов дыхания и кожи;
2. Закройте окна и форточки;
3. Отключите газ, воду, электричество, погасите огонь в печи;
4. Возьмите необходимые вещи и документы;
5. Возьмите питание (трехдневный запас непортящихся продуктов);
6. Укройтесь в ближайшем убежище или покиньте район аварии.
При движении на зараженной местности соблюдайте следующие правила:
— двигайтесь быстро, но не бегите и не поднимайте пыли;
— не прислоняйтесь к зданиям и не касайтесь окружающих предметов;
— не наступайте на встречающиеся на пути капли жидкости или порошкообразные россыпи неизвестных веществ;
— не снимайте средства индивидуальной защиты;
— при обнаружении на коже, одежде, обуви, средствах индивидуальной защиты капель сильнодействующих ядовитых веществ удалите их тампоном из бумаги, ветоши или носовым платком, по возможности промойте зараженное место водой;
— оказывайте помощь пострадавшим, детям и престарелым, не способным двигаться самостоятельно;
— не принимайте пищу, не пейте воду.
При отсутствии индивидуальных средств защиты, убежища, а также возможности выхода из зоны аварии:
1. Плотно закройте окна и двери;
2. Входные двери плотно зашторьте плотной тканью;
3. Проведите герметизацию жилища, заклейте окна и стыки рам пленкой, лейкопластырем или обычной бумагой.
ВАЖНО : п ри авариях с выбросом соляной кислоты необходимо укрываться на верхних этажах зданий, следует избегать пониженных участков местности, подвалов, цокольных этажей.
Действия населения после выхода из зоны химического заражения
Утилизация кислот: серной, соляной, азотной, уксусной и др.
Исследовательские центры и химические производства хранят продукты или образцы, которые они используют редко или никогда не используют. Нередко химикаты покупают оптом, чтобы сэкономить деньги. Вскоре их срок годности подходит к концу, об этих просроченных химикатах, включая и кислоты, можно забыть, положить их не на место или использовать только наполовину. Выбросить их в мусор нельзя. Обязательно проводится утилизация кислоты с истекшим сроком годности в соответствии с разработанными процедурами.
Зачем нужна утилизация кислот?
Проблема неграмотной утилизации кислот многогранна. Дело не только в загрязнении окружающей среды. Вред может наносится существенно раньше, чем через годы, доставляя неприятности не гипотетической окружающей среде, а непосредственно предприятию или учреждению, в котором хранится.
В крайних случаях некоторые из этих химических веществ, такие как пикриновая кислота, становятся взрывоопасными с возрастом. В течение нескольких месяцев она может взорваться только от трения открытия крышки.
Но наибольший ущерб кислоты наносят существенно чаще в виде штрафов за нарушение законов о хранении и утилизации опасных отходов. Тем более это актуально, если такие действия стали причиной ухудшения здоровья персонала. Чтобы предотвратить нежелательные последствия, рекомендуется придерживаться следующих рекомендаций:
Чтобы защитить сотрудников от потенциальных опасностей или просто сократить объем нежелательных материалов и риски штрафов, предприятия должны периодически удалять эти неиспользованные химические вещества. Рекомендуется прибегать к помощи специальных компаний. Но в некоторых случаях утилизацию кислот можно провести самостоятельно.
Утилизация кислот
В целом кислоты не должны выбрасываться в канализацию. Для их сбора и хранения нужно использовать емкость для отходов, предназначенную только для этих химикатов. Перед утилизацией их нужно разбавить. Если в канализацию удаляются небольшие количества разбавленных кислот и оснований ( Особенности утилизации кислот для отдельных видов
Утилизация серной кислоты может проводится тремя способами обезвреживания:
Утилизация соляной кислоты потребует разные щелочные растворы, которые ее нейтрализуют, а именно: каустическую соду, гашеную известь и едкий натрий – каждого по 5%.
Утилизация уксусной кислоты, как и в предыдущем случае требует применения раствора 5% щелочей. При ее попадании в грунт, его придется срезать и отвозить на захоронение на специальные полигоны.
Утилизация азотной кислоты проводится с помощью воды, которой разбавляют химикат. В процессе задействуют нитрат кальция, при помощи которого извлекают йод.
Централизованная утилизация
Если количество кислот, которые требуется утилизировать, измеряется литрами или десятками литров, требуется заказывать услуги специальных компаний. Процедура выглядит следующим образом:
Для пользователей сайта Vyvoz.org нами был собран (и постоянно пополняется) перечень организаций в крупных (и не только) городах России, которые занимаются утилизацией кислот:
На предприятии или учреждении должна сохраняться соответствующая документация: журналы учета опасных отходов, приказ о назначении ответственного лица, договор на утилизацию, акты приема-передачи и утилизации, переработки кислот. При отсутствии этих документов представители контролирующих органов составят акт о нарушении и наложат штраф. Юридическим лицам придется уплатить до 250 т.р. и более.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
О едком и не очень
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н + — бабах: вот и кислота стала сильнее.

А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Это — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?




